ФИЗХИМ ВСЕ ЭЛЬДАНА. 4 апта 40сра QU формуласы сйкес келеді изохоралык процесті жылулы эффектісі Формуласы арылы анытауа болады dSnr in V2V1 nr in P1P2
 Скачать 2.71 Mb. Скачать 2.71 Mb.
|
|
V тарау. Химиялық кинетика. Химиялық кинетика зерттейді: +химиялық реакция жылдамдығын. химиялық энергияның жылулық эффектісін. химиялық реакциялардың өту мүмкіндігін. химиялық реакциялардың өту механизмін. реакция жылдамдығының түрлі факторларға тәуелділігін. Химиялық реакция жылдамдығы үшін теңдеу w = -dC/dt жазылса, онда реакция жылдамдығы газ тәріздес реакция өнімі қысымы бойынша. +газ тәріздес реакция өнімі концентрациясы бойынша. қатты реакция өнімі массасы бойынша. катализатор массасы бойынша. тек қана бастапқы зат концентрацияларының өзгерісі бойынша. аА + bB + cC = mM + nN реакциясы үшін тура реакциясы реті: 1-а. +a+b+c. m+n. b. n. 2-ші ретті кинетикалық теңдеулер: w = kCA2 w = kCACB +w = k. w = kCA2CB w = kCACDCC Реакцияның молекулярлығы бола алады кез-келген оң мәнде. теріс мәнде. нөлге тең. +тек қана 1, 2, 3. бөлшек сан. Келтірілген реакциялардың ішінен тримолекулярлыны таңдаңыз: J2 = 2J. CH3COCH3 = C2H4 + H2 + CO. +H + H + M == H2 + M. 2NO + O2 = 2NO2. J2 + H2 = 2HJ. aA + bB ↔ cC + dD кері реакциясы үшін реттілік тең a+b. a*b. +c+d. c*d. a+b+c+d. Нөлінші ретті реакция жылдамдығы анықталатын теңдеу: w=kC. +w=k. w=kC2. w=kC3. w=kC-2. СО + Cl2 = COCl2 реакциясы: Мономолекулярлы реакция. Екінші ретті реакция. Бимолекулярлы реакция. Бірінші ретті реакция. Тримолекулярлы реакция. Жалпы кинетикалық теңдеуінде бірнеше жылдамдық константасы көрсетілген реакциялар: Қарапайым. Қайтымды. +Күрделі. ферментативті. Биохимиялық. Бірдей зататрдың бір уақытта әрекеттесіп, бірақ түрлі өнімдер түзетін реакциялар аталады: Тізбекті. +Параллельді. Қайтымды. Қосарланған. Кезектескен. Бірінен соң бірі кезектесіп жүретін реакциялар аталады: Тізбекті. Параллельді. Қайтымды. Қосарланған. +Кезектескен. Бастапқы реакция өздігінен жүріп, екінші реакция бірінші реакцияның есебінен жүретін реакцияларды қалай атайды: Тізбекті. Параллельді. Қайтымды. +Қосарланған. Кезектескен. Бір уақытта қарама-қарсы екі бағытта жүретін реакциялардың аталуы: Тізбекті. Параллель. +Қайтымды. Қосарланған. Кезекті. «Температураны әрбір 10 градусқа көтерген сайын химиялық орташа 2-4 есе артады» Вант-Гофф ережесі қолданылмайтын реакция: +Ферментативті. Бірінші ретті. Екінші ретті. Үшінші ретті. Фотохимиялық. Өз бетінше катализатор емес, бірақ катализаторға қосқанда оның активтілігін арттыратын зат аталады: +Промотор. Каталитикалық у. Акцептор. Индуктор. Актор. Реакция жылдамдығы азаяды: температураны арттырғанда. +каталитикалық удың әсерінен. промотор әсерінен. ингибитор әсерінен. реагент концентрациясын ұлғайтқанда. Субстрат: ферменттің бастапқы затпен аралық комплексі. ферментативті реакцияның өнімі. ферментативті реакцияның катализаторы. +берілген ферменттің әсер беретін қосылысы. ферментативті реакцияны тежейтін зат. Бастапқы А затының уақыт бірлігінде концентрациясының өзгерісіне сәйкес келетін кинетикалық қисықты таңдаңыз (А + В→ Д +Е)  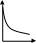  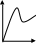 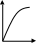 С c c c c t t t t t 1 2 3 4 5 1 2 3 4 5 A реакция өнімінің концентрациямының уақыт бірлігінде концентрациясының өзгерісіне сәйкес келетін кинетикалық қисықты таңдаңыз (А+B→Д+Е)  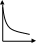  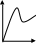 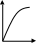 C c c c c T t t t t 1 2 3 4 5 1 2 3 4 5 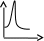  о ретті химиялық реакция жылдамдығының әрекеттесуші заттар концентрациясына тәуелділігін сипаттайтын графикті табыңыз 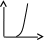 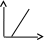 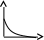 V v v v v V v v v v1 c 2 c 3 c 4 c 5 c 1 2 3 4 5 1 ретті химиялық реакция жылдамдығының әрекеттесуші заттар концентрациясына тәуелділігін сипаттайтын графикті табыңыз 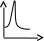  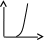 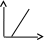 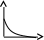 V v v v v V v v v v1 c 2 c 3 c 4 c 5 c 1 2 3 4 5 2 ретті химиялық реакция жылдамдығының әрекеттесуші заттар концентрациясына тәуелділігін сипаттайтын графикті табыңыз 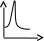  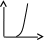 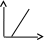 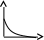 V v v v v V v v v v1 c 2 c 3 c 4 c 5 c 1 2 3 4 5  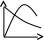 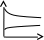  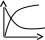 А< -- > Bтипті қайтымды реакция үшін әрекеттесуші заттар және реакция өнімдерінің уақыт бірлігінде өзгерісін сипаттайтын графикалық тәуелділікті көрсетіңіз   С Св Ca Св Са Са С Св Ca Св Са СаСа Св Са Св Св T t t t t 1 2 3 4 5  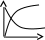    АB типті қайтымды реакция үшін әрекеттесуші заттар және реакция өнімдерінің уақыт бірлігінде өзгерісін сипаттайтын графикалық тәуелділікті көрсетіңіз С Св Ca Св Са Са Са Св Са Св Св T t t t t 1 2 3 4 5 Қандай график ферментативті реакция жылдамдығының температураға тәуелділігін көрсетеді?       w w w w w w w w w w 1 T1k 2 T1k 3 T1k 4 T1k 5 T1k 1 2 3 4 5      CD CB CA CD CD CB CD CB CB CB CA CA CD CA CA 1 t 2 t 3 t 4 t 5 t  B BA------- D Типті параллель реакция үшін заттар концентрациясының өзгерісін сипаттайтын кинетикалық қисықтар бейнеленген суретті көрсетіңіз: 1. 2. 3. 4. 5. Реакцияның молекулярлығы дегеніміз: + Реакцияның стехиометриялық коэффициенттерінің қосындысы. Берілген химиялық реакцияға қатысатын молекулалар саны . Реакцияның ретіне тең шама, егер реакция реті бүтін сан болса. Қарапайым бір актісіне қатысатын молекула саны. Анықтамалардың ешқайсысы сәйкес келмейді. Бірнеше қатар кезекті стадиядан тұратын кез-келген күрделі химиялық реакцияның жылдамдығы анықталады: Барлық стадиялардың орташа жылдамдығымен. Ең жылдам стадияның жылдамдығымен. + Ең баяу стадияның жылдамдығымен. Бірінші стадияның жылдамдығымен. Соңғы стадияның жылдамдығымен.  W B D E C Михаэлис – Ментен теңдеуіне сәйкес W=Wmax*Cs/(Km+Cs) субстраттың аз концентрацияларында (Cs) АВ ауданында: Нөлінші ретті. + Бірінші ретті. Екінші ретті. Үшінші ретті. Бөлшек ретті. Химиялық реакцияның молекулярлығы бола алады: Тек бөлшек сан. + Тек 1,2,3. Теріс мәнде. Кез-келген (бөлшек сан, бүтін сан,оң және теріс мәндерде). 1,2,3,4. Бимолекулярлы реакцияны көрсетіңіз (Көрсетілген теңдеу элементарлы стадия ретінде санаңыз): J2→2J. H2→2H. NH4Cl→NH3 +HCl. +H2 + J2→ 2HJ. NH4CNS→ (NH2)2CS. Тримолекулярлыреакцияны көрсетіңіз (Көрсетілген теңдеу элементарлы стадия ретінде санаңыз): CO + Cl2 = COCl2. H2→2H. NH4Cl→NH3 +HCl. Ca(HCO3)2 →H2O+CO2+CaO. +2NO+O2=2NO2. aA+bB=mM+nN тура реакциясының ретін анықтайтын теңдеуді көрсетіңіз: n=a*b. n=m*n. +n=a+b. n=a+b+m+n. n=m+n. Егер реакцияның кинетикалық теңдеуі w=CAaCBbCDd түрінде жазылса, онда реакцияның жалпы реті: +берілген теңдеудегі стехиометриялық коэффициенттері дәреже түрінде берілген әрекеттесуші заттардың концентрациясының қосындысына. берілген теңдеудегі стехиометриялық коэффициенттері дәреже түрінде берілген әрекеттесуші заттардың концентрациясының қосындысына. 1,2 немесе 3 тең. Анықтау мүмкін емес. К=a+b-d формуласы бойынша табылады. Тура 4NH3+5O2→4NO+6H2O реакциясы үшін әрекеттесуші массалар заңына сәйкес келетін өрнекті көрсетіңіз: w=k[NH3]4+[O2]5. w=k[NH3]*[O2]5. w=k[NH3]*[O2]. w=k[NH3]4*5[O2]. +w=k[NH3]4*[O2]5. 2NO(г)+Cl2(г)→2 NOCl(г) кері реакциясы үшін әрекеттесуші массалар заңына сәйкес келетін өрнекті көрсетіңіз: k= [NOCl] . [NO]2 [Cl2] +k= [NOCl]2 . [NO]2 [Cl2] k= [NOCl]2 . [NO]2 + [Cl2] k= 2[NOCl] . 2[NO] [Cl2] k= [NO] [Cl] . [NOCl]2 Қысымның өзгерісі реакцияның тепе-теңдігін ығыстырмайды: C(к)+CO2(г)=2CO(г)+Q. 2NO(г)+Cl2(г)→2NOCl(г)+Q. 2SO2(г)+O2(г)→2SO 3(г)+Q. +N2(г)+O2→2NO(г)+Q. 2NO2(г)→N2O4(ж)+Q. Егер жүйедегі қысымды 5 есе ұлғайса, N2(г)+O2↔2NO(г) тура реакция жылдамдығы: 5 есе артады. 5 есе кемиді. Өзгермейді. +25 есе артады. 25 есе кемиді Реакцияның температуралық коэффициенті γ=3. Егер температураны 25˚С-тен 55˚С-ке өзгертсе, реакция жылдамдығы: 27 есе кемиді. +27 есе артады. 9 есе артады. 9 есе кемиді. Өзгермейді. Реакцияның температуралық коэффициенті γ=2. Егер температураны 373К-нен 323К-ге дейін өзгертсе, реакция жылдамдығы: 10 есе артады. 10 есе кемиді. 32 есе артады. +32 есе кемиді. Өзгермейді. 3 ретті реакцияның кинетикалық теңдеуін көрсетіңіз: w=k. +w=kCACB2. w=kCA. w=k CB2. w=k CACB. 1 ретті реакция үшін жартылай ыдырау уақытын анықтауға болатын өрнекті табыңыз: t1/2=C. 2k t1/2=ln2. k +t1/2=0.69. k t1/2=1 . kCn t1/2=1 3 . k 2Cn2 Химиялық реакция жылдамдығының өлшем бірліктері: молек. *см-3*с-1. +моль*л-1*с-1. молек.*см3*с-1. моль/л. моль*л-1*с1. Ферментативті процестер жылдамдығын сипаттайтын теңдеу: Смолуховский. +Михаэлис-Ментен. Аррениус. Вант-Гофф. Гибб. |
