ФИЗХИМ ВСЕ ЭЛЬДАНА. 4 апта 40сра QU формуласы сйкес келеді изохоралык процесті жылулы эффектісі Формуласы арылы анытауа болады dSnr in V2V1 nr in P1P2
 Скачать 2.71 Mb. Скачать 2.71 Mb.
|
|
29.Эбулиоскопиялық тұрақты Е: еріткіштің табиғатына тәуелді  30.Гетерогенді жүйеде фазалар саны (f): ф>1 30.Гетерогенді жүйеде фазалар саны (f): ф>1  31.Гомогенді термодинамикалық жүйе: әр түрлі нүктелерде бірдей қасиеттерге ие және бір фазадан тұрады 31.Гомогенді термодинамикалық жүйе: әр түрлі нүктелерде бірдей қасиеттерге ие және бір фазадан тұрады 32.Клапейрон-Клаузиус теңдеуі тепе-теңдік қысымның температураға тәуелділігін сипаттайды: бір компонентті бір фазалы жүйе 32.Клапейрон-Клаузиус теңдеуі тепе-теңдік қысымның температураға тәуелділігін сипаттайды: бір компонентті бір фазалы жүйе 33.Таза еріткішпен салыстырғанда ерітіндіде: қату температурасы төмендейді 33.Таза еріткішпен салыстырғанда ерітіндіде: қату температурасы төмендейді 34.Егер рОН=3, онда: рН=11 34.Егер рОН=3, онда: рН=11 35.Бір фазалы жүйелердің еркіндік дәрежесі: 2 35.Бір фазалы жүйелердің еркіндік дәрежесі: 2 36.Электролиттердің константа диссоциация константасы (тұрақтысы) қай заңға негізділіп анықталады? Оствальд 36.Электролиттердің константа диссоциация константасы (тұрақтысы) қай заңға негізділіп анықталады? Оствальд37.Ерітіндінің қайнау температурасын өлшеуге негізделген талдау әдісі қалай аталады: эбулиометрия 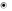 38.Плазмолиз- бұл:Осмостық қысымы жоғары ерітіндіге эритроцитті салғанда байқалатын құбылыс 38.Плазмолиз- бұл:Осмостық қысымы жоғары ерітіндіге эритроцитті салғанда байқалатын құбылыс39.Теңіз суында жүзу кезінде көздің аздап ауыруы және қызаруы келесі себептерден туындайды: көз алмасынан су осмосы 40.Егер рН 3-ке тең болса: pOH=11 41. Аналитикалық (жалпы) концентрация (с) және активтілік (а) арасындағы тәуелділік: c=a/γ 42. Плазмадағы рН мәні қалыпты жағдайда: 7,4 43. Осмостық қысым қай ерітіндіде көбірек болады? С(NaCl) = 0,5 моль/л 44. Дәрілік заттардың изотондық концентрациясын есептеуге болады: Раульдің екінші заңы бойынша 45. Келесі қасиеттер коллигативті қасиеттерге жатады: а)рН ерітінділері.; б)ерітінділердің буферлік сыйымдылығы ; в) осмостық қысым ; г) ерітінділердің иондық күші; д) еріткіштің қаныққан буының ерітіндіге түсіретін қысымы; е) ерітінділердің қату және қайнау температурасы в,д,е 46. Изотоникалық коэффициент болуы мүмкін: 1-ден көп, бірақ иондар саны аз 47. Құрамында 0,01 моль / л Ca (NO3) 2 және 0,01 моль / л CaCl2 бар ерітіндідегі иондық күшті есептеңіз. 0,06 48. Эбулиоскопиялық тұрақты Е: 1000 г еріткіште 1моль еріген зат бейэлектролит болғандағы ерітіндінің қайнау температурасының жоғарылауы 49. Буферлі жүйелер құрамына қарай қалай бөлінеді? қышқылдық,негіздік,амфолиттік 50. Депрессия деген не? ерітінді бетіндегі еріткіштің қаныққан бу қысымының салыстырмалы төмендеуі еріген заттың мольдік үлесіне тең 51. Тепе-теңдік жағдайында тура және кері бағытта жүретін таза заттың кристалдық модификациясының өзара ауысуы қалай аталады энантроптық 52. Бірфазалы біркомпоненті жүйелерде еркіндік дәрежесіне тең: 2 53. Гетерогенді жүйеде фазалар саны (f): ф>1 54. Екіфазалы екі компонентті жүйелерде еркіндік дәрежесі нешеге тең: 1 55. Идеал жүйеде еріген заттың тәжірибе жүзінде табылған молекулалық массасы: формулалық мәніне тең 56. Плазма мен эритроциттердегі буферлік жүйе дегеніміз не? протеин 57. Ерітіндінің қайнау температурасын өлшеуге негізделген талдау әдісі қалай аталады: эбулиометрия 58. Жоғары осмостық қысымның әсерінен жасушаның осмотикалық серпімділік күйі аталады:Тургор 59. Клапейрон-Клаузиус теңдеуі тепе-теңдік қысымның температураға тәуелділігін сипаттайды:бір компонентті бір фазалы жүйе 60. Ерітіндінің бастапқы қайнау температурасы мен тұрақты қысымдағы еріткіштің қайнау температурасын салыстыруға негізделген, сұйытылған ерітінділерді зерттеу әдісі қалай аталады Эбулоскопия 61. Қандай ерітінді қанға изотониялық болып табылады:0,9%-дық(NaCl), 62. Таза еріткішпен салыстырғанда ерітіндіде:қату температурасы төмендейді 63. Оствальдтың сұйылту заңының матемикалық теңдеуі:Кд = α2 С(X) 64. Ерітіндінің осмостық қысымы есептеледі: π = (m/M)*V*RT 65. Ерітіндінің иондық күші мына формуламен анықталады: I = ½ Σ Ci Zi2. 66. Плазмолиз- бұл: Осмостық қысымы жоғары ерітіндіге жасушаны салғанда оның жиырылуы 67. Теңіз суына шомылғанда көздің қызарып, аздаған ауру белгілерінің сезілуі байланысты: көз алмасынан судың осмосына 68. Егер 2 литр суда 2 моль фруктозаны ерітсе, судың қату температурасы қалай өзгереді? Судың криоскопиялық константасы 1.860: 86 градусқа азаяды 69. "Қышқыл-негіздік"әсерлесу кезінде протондар қосып алатын заттар қалай аталады негіздер 70. Қышқылдар мен негіздердің электронды теориясы (Г. Льюис): қышқыл-негіз реакцияларында донор-акцептор өзара әрекеттесуі жүреді 71. Протолиттік теорияға сәйкес негіздер деген: Қышқыл-негіздік әсерлесу кезінде протондарды қосатын заттар 72. Еріген заттың молярлық массасын криоскопиялық анықтау үшін келесі қатынастар қолданылады:Тқату = Кm2 73. Тамыр ішілік дәрі ретінде қолданылатын дәрілік заттың ерітіндісі қан плазмасына (көз жас сұйықтығы) қатысты болуы керек:изотондық 74. Компоненттің ликвидус қисығы дегеніміз:оның қоспадан cұйықтыққа түсу қисығы 75. Бейэлектролит ерітінділер:қант, глицерин,бензол 76. Тепе-теңдік күйіндегі жүйе: 2SO2(г)+O2(г)=2SO3(г) гомогенді 77. Ерітіндінің қату температурасы байланысты:еріген заттың концентрациясына 78. Сұйылтылған FeCl3 ерітінділерінде изотоникалық коэффициент ішіндегі мәндерді қабылдайды: 3 < i < 4 79. Изотондық ерітінділер дегеніміз бірдей ерітінділер: осмостық қысым 80. Еріткіштің қайнау температурасы тәуелді:еріткіштің қаныққан буының ерітіндіге түсіретін қысымы 81. Егер ұсынылған стехиометриялық реакция теңдеуі 2CO +O2=2CO2 механизміне сәйкес келсе, онда реакция молекулалығы тең болады:3 1)Ерітінділерді сұйылту кезінде күшті және әлсіз электролиттердің эквивалентті электрөткізгіштігі қалай өзгерді: өседі 2)Иондық тасымалдау саны қалай аталады: электролит катионы мен анионы белгілі бір уақыт аралығында қткізген электр энергиясының мөлшері 3)Кольраштың бірінші заңы қолданылады: күшті электролиттердің концентрлі ерітінділері үшін 4)Меншікті кедергі: электролит ерітіндінің табиғатына байланысты 5)Кондуктометриялық титрлеудің артықшылығы: түрлі түсті және лайланған ерітінділерді зерттеуге болады 6. Диссоциация тұрақтысы неғұрлым үлкен болса, онда:көбірек диссоциацияланған қышқыл 7. Кондуктометрлік ұяшық константасын анықтайтын формула:K =RKCl ∙ ϰӕKCl 8. Диссоциациялану дәрежесі- бұл эквивалентті электрөткізгіштіктің шекті электрөткізгішке қатынасы:әлсіз электролиттер үшін 9. Кедергіге кері мән: электрөткізгіштік 10. Концентрацияның артуымен меншікті электрөткізгіштік: өседі 11.Шексіз сұйылту кезінде сулы электролит ерітіндісінің эквивалентті электрөткізгіштік тең болады: +шекті иондық қозғалғыштардың қосындысына 12. Электролиттер дегеніміз:+иондардан түзілген заттар 13. Фарадей санының өлшемі:+Кл/моль 14. Электролиттің электрлік өткізгіштігі (λ∞ ) тәуелді:+ерітіндідегі электролит иондарының қоғалу жылдамдығына 15. NH4Cl тұзындағы NH4+ тасымалдау саны 0,488 құрайды. Тасымалдау саны Cl- қа Кондуктометрлік ұяшық константасын анықтайтын формула:ндай?+0,512 16.Меншікті кедергіні анықтайтын формула:ρ=RS/l 17. Диссоциация дәрежесі қалай аталады:иондарға диссоциацияланатын молекулалар санының еріген электролит молекулаларының жалпы санына қатынасы 18. λс=λ∞-A түбір астында С теңдеуі түбір астындағы концентрацияға ... :сызықты тәуелді 19. Әлсіз электролиттер үшін диссоциациялану константасы анықталады:Оствальдтың сұйылту заңымен 20. Кондуктометриялық титрлеуде индикатор болып табылады:электрөткізгіштік 21. Кондуктометриялық титрлеу әдісінің кемшілігі:төмен селективтілігі 22.Кондуктометрия әдісі ... негізделген: ерітіндінің өткізгіштігін өлшеуге 23.Электролиттің электрлік өткізгіштігі (λ∞ ) шегіне жетеді: сұйық ерітінділерде 24. электрондардың қозғалуы нәтижесінде өткізетін өткізгіштер: Металдар 25. екінші заңы мына концентрациялар үшін жарайды: 0-0,003 г/экв·л 26. емес жауапты табыңыз: Тура кондуктометрия әр түрлі физика- химиялық шамаларды әр түрлі температурада электрөткізгіштігін өлшеуге негізделген әдіс 27.Электрөткізгіштіктің электролит концентрациясына тәуелділігінен катиондар мен аниондардың қозғалысының абсолюттік жылдамдығы қалай өрнектеледі: Uk+Ua=χ*1000/ C*F 28.Электролиттердегі электр өткізгіштігінің физикалық табиғаты қандай?Иондық 29.Күшті электролиттер үшін электрөткізгіштік коэффициенті былай өрнектеледі:fλ=λ/ λ∞ 30.Кольрауштың екінші заңы әлсіз электролиттер үшін қолданылмайды, себебі:Олардың толық диссоциациясы өте төмен концентрацияларды жүреді 31.Электрөткізгіштіктің нақты өлшем бірлігі қандай. См·м-1 32.Температураның жоғарылауымен электролит ерітіндінің электр өткізгіштігі ...жоғарылайды 33.Электролиттердің диссоциациялану дәрежесін, ерітіндінің концентрациясын анықтап береді:Тікелей кондуктометрия+++ 34.Ерітіндіні сұйылту артқан сайын:Молярлы электөткізгіштік артады+++ 35.Иондардың неғұрлым заряды жоғары немесе радиусы аз болған сайын:Иондардың қозғалғыштығы аз+++ 36.Молярлық электрөткізгіштік анықталады:λc=χ*1000/C+++ 37.Дұрыс емес жауапты табыңыз:Кондуктометрлік титрлеу өте әлсіз қышқылдар мен әлсіз негіздердің тұздарын талдауда қолданылмайды+++ 38.Тұрақты кондуктометриялық ұяшық … есептеуде қолданылады: меншікті электрөткізгішті 39. Молярлық электрөткізгіштіктің өлшем бірлігі қандай: См·м2·моль-1 40. Электролит ерітіндісінің нақты электрөткізгіштігі деп аталады (егер ол См·м-1-де көрсетілсе): электродтар арасында 1 м қашықтықта және 1 м2 алаңда орналасқан ерітінді бағанының электр өткізгіштігі 41. Сулы электролит ерітіндісінің баламалы электрөткізгіштігі максимумға тең: шексіз сұйылту кезінде 42. Екі жеке зарядталған ионға диссоциацияланатын күшті электролит ерітіндісі үшін Кольрауш иондарының тәуелсіз қозғалысының теңдеуі келесі түрге ие: λ∞=λk+λa 43. Күшті электролит ерітіндісі үшін шекті эквивалентті электрөткізгіштікті анықтаған кезде, Кольрауш заңының түрі болады: λ=λ∞-A түбір асты С 44.Ерітінділерді сұйылту кезінде күшті және әлсіз электролиттердің эквивалентті электр өткізгіштігі қалай өзгереді:Кемиді 45. Шексіз сұйылту кезінде эквивалентті өткізгіштік өрнектеледі: λ∞ = λ+ + λ- 46.Электрөткізгіштік коэффициенті – бұл эквиваленттік электрөткізгіштің шекті электрөткізгішке қатынасы:күшті электролиттер үшін 47.Электрөткізгіштікті өлшеудің қосымша әдісі:жанама кондуктометрия 48.Кондуктометриялық әдіспен анықтайды:ерітіндідегі аз еритін заттардың санын 49.Электролиттер- бұлар:1 текті өткізгіштіктер 50.Кондуктометриялық титрлеуде координата тұрғызғанда, график бойынша эквиваленттік нүктені табады:меншікті электрөткізгіштік- титрант көлемі 1) Молекулалар санының азаюы: активтендіру энергиясын арттырады 2) Ферменттерді бейорганикалық катализаторлардан ажырататын сипаттамалық белгілер:рН физиологиялық диапазоны 3) Михаэлис-Ментен теңдеуінде реакцияның максималды жылдамдығы сипатталады: субстраттың жоғары концентрациясында 4) Протеаза ферменті ыдыратады: протеиндерді 5) Ферментативті реакциялар кезінде ферментттер қатысады: аз мөлшерде 6) Ферменттің 1 субстратқа айналуы болып табылады:Жоғары спецификалық 7. Апофермент - бұл: екі компонентті ферменттердің аминқышқылдық ақуыздық бөлігі 8. 1 моль сахароза ферменті 1000 моль қызылша қантын ыдырата алады: 1 сек 9. Михаэлис-Ментен теңдеуі қолданылады: ферментативті процестің бастапқы кезеңіне дейін 10. Ферменттің тұрақты концентарциясы субстарт мөлшерінің жоғарылауымен реак жылд: өседі, содан кейін тұрақты болып қалады 11. Қайтымды активтендіру аймағында pH: pH=5-8 12.Михаэлис тұрақтысының kм физикалық мәні неде: kм саны жағынан реакция жылдамдығы максимумның жартысына тең болатын субстрат конценнтрациясына тең 13.Реакция жүруін шектейтін фактор-бұл..... түзілуі болып табылады: фермент-субстрат кешені 14.Ферменттерге тән: спецификалық қасиеттер 15.Қан плазмасындағы ферменттің белсенділігі: ХБ/л 16.Күрделі ферменттердің белсенді орталығы мыналардан қалыптасады: бірнеше аминқышқылдары мен ақуыз емес компоненттердің қалдықтарынан 17. Ферменттер-бұл: Химиялық реакцияларды жылдамдататын биологиялық катализаторлар 18. Белсенді-орталық бұл байланыс жүретін фермент молекуласының аймағы: Субстрат молекулалары 19. 1 моль фермент 1000-1000000 моль заттың (субстраттың) өзгеруіне әкелуі мүмкін: 1 секундта 20. Ферменттер класы мынаны көрсетеді: Берілген фермент катализдейтін химиялық реакция түрін 21. Ферментативті катализде жүреді: Күрделі химиялық реакциялар 22. Қарапайым ферменттердің белсенді орталығы мыналардан қалыптасады: Бірнеше аминқышқылдарының қалдықтарынан 23. Фермент деп аталады: карбоангидраза 24. Қарапайым ферменттер тұрады: аминқышқылдардан 25. S P ферментативті катализ реакциясы үшін Е ферментінің қатысуымен Михаэлис-Ментен механизмін келесі схема бойынша ұсынуға болады: S+E- SE- P+E 26. Асқазан-ішек жолдарының бұзылуы кезінде қолданылады: пепсин 27. Ферментативті катализде катализатор болып табылады: ақуыз 28. Ақуыз ферменттері үшін реттілік аминқышқылдарының реттілігі 29. Михаэлис тұрақтысы ферменттің ерекшелігін ... қатысты сипаттайды: субстратқа 30. Ферментативті реакция жылдамдығы байланысты болады -субстрат концентрациясына 31. Тірі организмде химиялық реакциялар үшін қатаң жағдайлар - мүмкін емес 32. Субстрат мөлшерінің артуымен ферментативті реакция жылдамдығы: өседі содан кейін тұрақты болып қалады 33.ферменттердің әсерінен түрлендірілетін заттар .... деп аталады Субстрат 34. Ферменттер сипатталатын ең жоғарғы тиімділікті көрсетеді: рН көрсеткіштерімен 35.Ферменттер белсенді орталығы: субстраттың қосылуы және ферментативті катализ 36.Ферменттердің көпшілігі ең белсенді болады қандай рН мәпәндер- 6,0-8,0 37. Ферменттер химиялық реакцияларды жылдамдатады ... есебінен - активтендіру энергиясының төмендеуі 38. Ферменттердің әсер ету спецификасы (ерекшелігі): бір субстраттың айналуын катализдеу 39. Фермент субстратпен әрекеттескенде конформациялық өзгерістер мыналарға тән: ферменттерге 40. Реакция нәтижесінде катализатор: жұмсалмайды 41. КМ қаншалықты аз болса: спецификалық (арнайылық) сөғұрлым жоғары болады 42. Протеолитикалық ферменттер қай жағдайда қолданылады: өкпенің іріңді қабынуы, іріңді жараларды емдеуде 43. Ең белсенді фермент: карбоангидраза 44.Ақуыздар мен ферменттердің физико-химиялық қасиеттері: Бірдей 45.Холофермент бұл Екі компонентті ферменттердің аминқышқылдық ақуыздық бөлігі ақуыз емес бөлігімен бірге 46. Ұқсас заттар тобына мыналар жатады: Аз спецификалық 47. Әр түрлі топтағы заттардың өзгеруі … болып табылады Спецификалық емес 48. Ферментативті реакция жылдамдығы мыналарға байланысты: Ферменттің табиғатына 49. Ферментативті реакциялар кинетикасы-… ғылым: Ферментативті реакциялардың жылдамдығы әртүрлі факторларға тәуелділігі туралы 50. Ферменттің субстартқа жоғары жақындығы сипатталады : Михаэлис тұрақтысының төмен мәнімен Гетерогенді процестегі химиялық реакция бұл: Лимитирленуші саты Жоғары жылдамдықпен жүретін, электрондар жоғары энергетикалық деңгейге тез ауыса алатын фотохимиялық реакциялардың қай кезеңі: Бірінші кезеңі Фотохимиялық реакцияның жүруінің негіззгі шарттарын көрсетіңіз: Көрінетін жарыққа жақын толқын ұзындығымен сәулеленуі Қатты фазаның меншікті еру жылдамдығы мына тендеу бойынша аныкталады: Щукарев Фотохимиялық реакциялардың негізгі кинетикалық теңдеуі: -dcA/dt= KJ0(-e-Elc) Үдеріс кинетикалық режимде жүреді , егер лимитирленуші сатысы : химиялық реакция Молекулалар белсенді күйг өтеді: сәулеленудің квантын сіңіргенде Сәулелені әсерінен үреттін толқын ұзындығы көрінетін сәулеге жақын реакциялар: фотохимиялық Лимитирленуші сатылар болуы мүмкін: барлық сатылар Бос радикалдардың әсерінен жүзеге асатын фотохимиялық реакциялар: белсенді бөлшектердің 21. Егер гетерогенді реакция Агаз ->Вгаз типінде қатты бетте Агаз->Аадсорб.->Вадсорб->В газ механизмінде жүрсе, онда Жалпы процестің жылдамдығы А затының қысымына тәуелді емес, өйткені реакция беттік адсорбциялық қабатта жүреді 22. Ақ +Вқ =Сқ +Кс гетерогенді үдерісі үшін қай саты сәйкес келеді: А мен В арасындағы химиялық реакция, С және К жаңа өнімдерінің түзілуі. Реакция жылдамдығы химиялық кинетика заңдарымен анықталады. 23. Фик заңы анықталады: Диффузиялық режимде 24. Диффузтялық ағынға қарай реагент концентрациясы: Төмендейді 25. Концентрация градиенті: Теріс 6)Бос радикалдардың әсерінен жүзеге асатын фотохимиялық реакциялар:-белсенді бөлшектердің 7)Концентрация градиенті:- теріс 8)Химиялық раекцияның жылдамдығы:- диффузия жылдамдығынан жоғары 9)Фик заңы анықталады:- диффузиялық режимде 10)Беттік меншікті аудан үлкен болады:- гетерооенді процестің жылдамдығы неғұрлым көп болса 31. Теориялық квантық шығым: бірге тең 32. Молекулалар белсенді күйге өтеді: сәулеленудің квантын сіңіргенде 33. Реакциялық қоспа арқылы сәулелердің сіңірілуі: Фотохимияның 1заңы 34. Жарық кванты бір молекуланы немесе бірқатар молекулаларды белсендіреді: Фотохимияның 2 заңы 35. Практикалық кванттық шығым: бірден үлкен немесе кіші |
