Тема 16. Оксикислоты. 4 и др кетоны, напр
 Скачать 249.23 Kb. Скачать 249.23 Kb.
|
 ОКСИКИСЛОТЫ ОКСИКИСЛОТЫ (гидроксикарбоновые к-ты, гидроксикис-лоты), содержат в молекуле карбоксильную и гидроксиль-ную группы. В статье рассмотрены алифатические оксикислоты (см. также Оксибензойные кислоты и Оксинафтойные кислоты). В зависимости от взаимного расположения групп ОН и СООН различают Оксикислоты широко распространены в природе, их остатки входят в состав сфинголипидов животных и растений. Оксикислоты- кристаллич. в-ва, низшие оксикислоты из-за сильной гигроскопичности - густые сиропообразные жидкости, хорошо раств. в воде. Физ. св-ва нек-рых оксикислот представлены в таблице. Оксикислоты вступают в р-ции, характерные для карбоновых к-т и спиртов, обладают также специфич. св-вами. Они более сильные к-ты, чем соответствующие карбоновые. Это объясняется существованием внутримол. водородной связи между группами ОН и СООН в 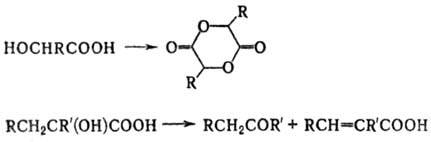 С солями нек-рых металлов, напр. Fe(III), Cu(II), 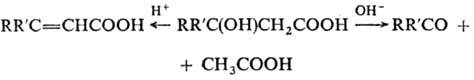 Образование лактонов с более удаленной группой ОН (больше 7 атомов С в молекуле) затруднено; их получают нагреванием Общие методы синтеза оксикислоты: восстановление СО-группы альдегиде- и кетокислот или их взаимод. с реактивами Гриньяра; гидролиз галогензамещенных к-т или диазотиро-вание аминокислот; присоединение воды к непредельным к-там, напр.: 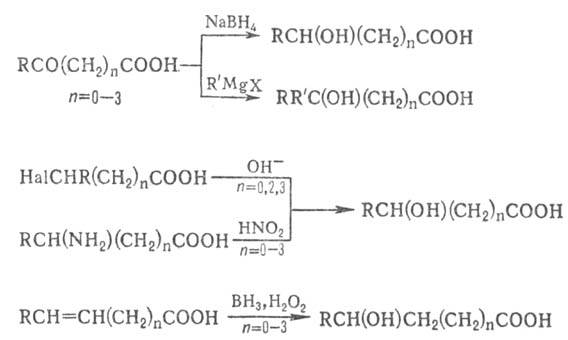 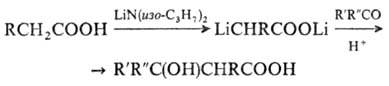 Оксикислоты играют важную роль в биохим. процессах. Лимонная кислота и яблочная кислота - ключевые продукты цикла трикарбоновых к-т; Из оксикислот применение находят глицериновая к-та и гликолевая кислота -для травления и снятия ржавчины с металлич. покрытий, гликолевая к-та-также в качестве протравы при крашении; гидракриловая - в синтезе эмульгаторов; ацетоновая-как добавка к полимерам для увеличения их вязкости; Винные кислоты Винные кислоты, диоксиянтарные, двухосновные органические кислоты с двумя асимметричными атомами углерода в молекуле. Известны все теоретически возможные винные кислоты: D-винная (виннокаменная) кислота (I), растворы которой вращают плоскость поляризованного света вправо; её оптический антипод (см. Антиподы оптические) — L-винная кислота (II); D, L-винная (виноградная) кислота(рацемическое соединение D- и L-винных кислот, см. Изомерия) и мезовинная (антивинная) кислота (III), оптически недеятельная, что объясняется внутримолекулярной компенсацией вращения плоскости поляризации, обусловленной наличием дополнительной оси симметрии (аб). 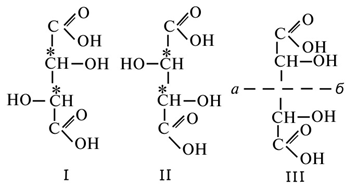 Наибольшее значение имеет D-винная кислота (обыкновенная винная, или виннокаменная, кислота), которая в свободном состоянии или в виде солей содержится во многих плодах, особенно в винограде. При брожениивиноградного сока осаждается малорастворимая кислая калиевая соль D-винной кислоты, так называемый винный камень. Получают D-винную кислоту действием минеральных кислот на её кислую калиевую соль. D-винную кислоту и её соли (тартраты) широко применяют в пищевой промышленности (например, при приготовлении лимонадов и печенья), медицине (рвотный камень), при крашении, в органическом синтезе, аналитической химии и т.д. D-винная кислота в щелочной среде растворяет Cu (OH)2 с образованием прозрачного ярко-синего раствора — фелинговой жидкости, которая служит реактивом на восстановительную способность веществ. ВИННЫЕ КИСЛОТЫ (дигидроксиянтарные к-ты), мол. м. 150,09; бесцв. кристаллы. Существует в виде трех стереоизомеров и рацемата (виноградной к-ты; см. ниже): 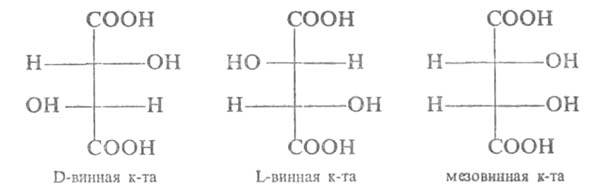 D-Винная к-та (виннокаменная к-та, винная к-та) - т. пл. 170°С; d4201,7598; Абсолютная конфигурация, стерические ряды и вальденовское обращение При рассмотрении пространственного строения веществ с асимметрическими атомами различают их относительную и абсолютную конфигурации. Относительная конфигурация — это взаимное расположение заместителей при разных асимметрических атомах по отношению друг к другу; обычно ее обозначают приставками к основному названию вещества(цис- и транс-, трео- и эритро-, мезо-, алло- и др.). Абсолютная конфигурация — это истинное расположение в пространстве заместителей при каждом асимметрическом атоме молекулы; чаще всего ее обозначают буквами D или L. Например, правовращающая и левовращающая винные кислоты обладают противоположными (антиподными) абсолютными конфигурациями, но одинаковой относительной конфигурацией, отличающейся в то же время от относительной конфигурации мезовинной кислоты (различные расстояния между группами ОН, СООН и т. д.): 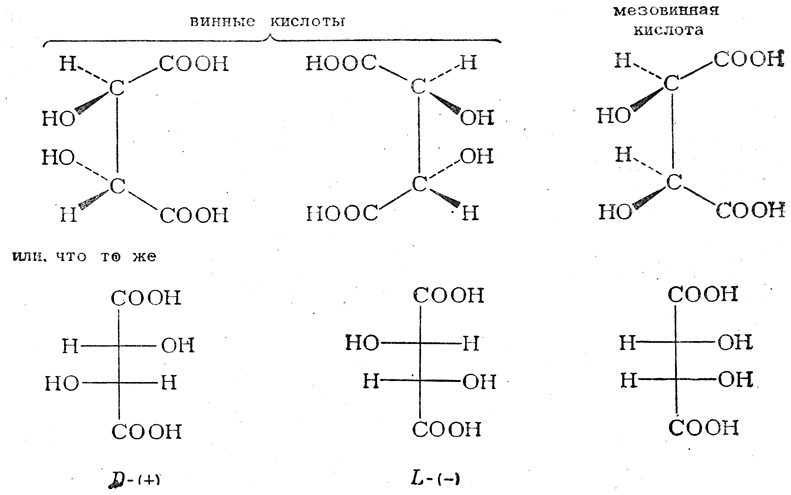 Относительная конфигурация многих веществ может быть выяснена различными химическими и физическими методами. Прямое же определение абсолютной конфигурации, напротив, представляет очень трудную задачу, которую пока удалось решить только на одном примере: в 1951 г. путем рентгеноструктурного анализа калий-рубидиевой соли D(+)-винной кислотыбыло установлено, что эта кислота обладает абсолютной конфигурацией, изображаемой приведенными выше формулами. Тем не менее одного этого эксперимента достаточно, чтобы решить вопрос об истинном пространственном строении огромного числа оптически деятельных соединений путем корреляции (установления соответствия) их абсолютных конфигураций и сведения этих соединений в стерические ряды. В качестве стереохимического стандарта еще в 1906 г., по предложению М. А. Розанова, был избран глицериновый альдегид, (+)-форме которого была произвольно приписана формула (I), а (—)-форме — формула (II):  С тех пор абсолютные конфигурации других оптически деятельных соединений рассматривались как соответствующие либо правовращающему, либо левовращающему антиподу глицеринового альдегида, в результате чего возникли два ряда конфигуративно родственных соединений —D-ряд и L-ряд. При этом корреляция конфигураций различных веществ чаще всего осуществлялась химическим путем. Например, (+)-глицериновый альдегид был окислен в (—)-глицериновую кислоту, которая была получена также из (+)-изосерина при его диазотировании; (+)-изосерин в свою очередь был дезаминирован с образованием (—)-молочной кислоты и получен из (+)-винной кислоты через (—)-хлоряблочную и (+)-яблочную кислоты: 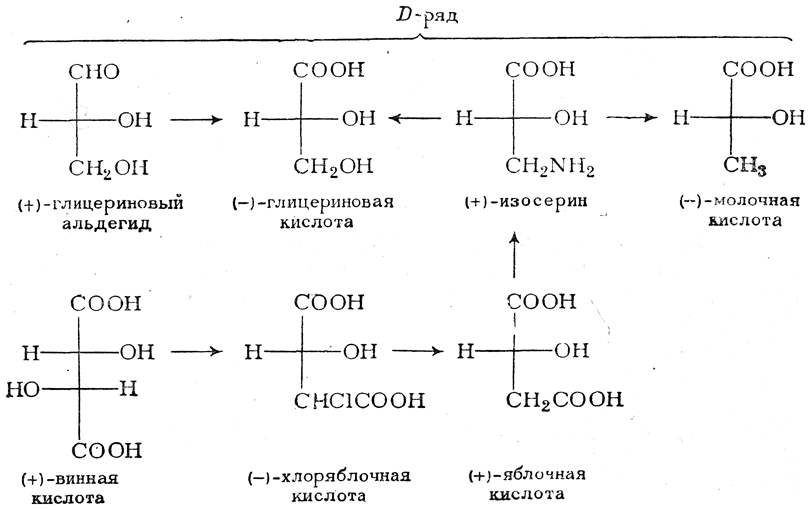 D — обозначение (от слова dexter — правый), указывающее на принадлежность одного из пары зеркальных изомеров (энантиомеров) к ряду соединений с определенной пространственной конфигурацией (D-ряд, или ряд D-глицеринового альдегида). Зеркальные изомеры с противоположной пространственной конфигурацией обозначают символом L (от слова laevus— левый), что также указывает на принадлежность их к стерическому ряду (L-ряд, или ряд L-глицеринового альдегида). Проекционные формулы зеркально-изомерных глицериновых альдегидов: 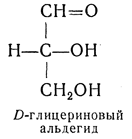 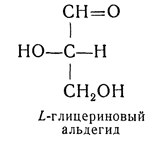 d — сокращение от слова dexter (правый); первоначально применялось для обозначения оптически активных соединений, вызывающих правое вращение плоскости поляризации света; оптические антиподы, вызывающие левое вращение, обозначали символом l — сокращение от слова laevus (левый). Затем символы d и l стали применять для обозначения принадлежности зеркальных изомеров по их пространственным конфигурациям к определенным стерическим рядам, и в этом значении они встречаются в литературе, наряду с символами D и L (d-ряд или D-ряд; l-ряд или L-ряд, см. выше). В последние годы во избежание путаницы для обозначения соответствующих пространственных конфигураций символы d и l стремятся заменить символами D и L. Символы d и l предложено сохранить в их первоначальном значении для обозначения правого и левого вращения плоскости поляризации, наряду со знаками (+) и (—). трео- — приставка, обозначающая, что в соединении два смежных асимметрических центра имеют одинаковую конфигурацию (как у моносахарида треозы); в противоположность этому приставка эритро- указывает на различную конфигурацию этих центров (как у моносахарида эритрозы): 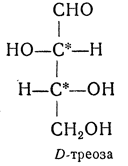 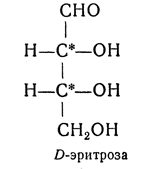 Диастереомеры — стереоизомеры, не являющиеся зеркальными отражениями друг друга[1]. Диастереомерия возникает, когда соединение имеет несколько стереоцентров. Если два стереоизомера имеют противоположные конфигурации всех соответствующих стереоцентров, то они являются энантиомерами. Однако, если конфигурация различается лишь у некоторых (а не у всех) стереоцентров, то такие стереизомеры являются диастереомерами[2]. Если диастереомеры отличаются конфигурацией лишь одного стереоцентра, то они называются эпимерами[3]. К диастереомерам также относят соединения с различной конфигурацией двойной связи (геометрические изомеры). В отличие от энантиомеров, диастереомеры различаются по физическим свойствам и реакционной способности. Разделение оптически недеятельных веществ на оптические антиподы(оптическое расщепление). На примере виноградной кислоты Пастер дал ряд классических методов, с помощью которых возможно отделить оптические антиподы друг от друга. Первый метод основан на том, что микроорганизмы обладают способностью при химических процессах, связанных с их жизнедеятельностью, потреблять предпочтительно лишь одну из двух антиподных конфигураций, и притом обыкновенно ту, которая встречается в качестве естественного продукта в растительном или животном мире. Так, при прорастании и размножении чернильной плесени — Penicillium glaucum — на разбавленных растворах виноградной кислоты или ее солей растворы вскоре приобретают левое вращение. Через некоторое время в растворах остается лишь одна левовращающая кислота, которая и может быть получена путем выпаривания раствора и кристаллизациитвердого остатка. Лишь после израсходования всей правой кислоты, и притом гораздо медленнее, плесенью потребляется левая кислота. Второй метод Пастера основан на различной растворимости солей, образованных оптически противоположными кислотами с одним и тем же оптически деятельным основанием. Так, виноградная кислота могла быть разделена на оптические изомеры в виде солей оптически деятельного алкалоида цинхонина. Цинхониновая соль левой винной кислоты трудно растворима в воде, соль же правой кислотырастворяется значительно легче; поэтому соли этих кислот могут быть разделены кристаллизацией. По этому методу i-молочная кислота в виде солей стрихнина, хинина или морфина была разделена на D- и L-молочные кислоты; кристаллизацией цинхониновых солей была разделена i-яблочная кислота и т. д. Аналогичным путем, т. е. кристаллизацией солей оптически недеятельных оснований с оптически деятельными кислотами, можно разделить i-основания на D- и L-изомеры. ПРОИЗВОДНЫЕ УГОЛЬНОЙ КИСЛОТЫ Угольную кислоту формально можно рассмотреть как карбоновую кислоту, которая вместо углеводородого остатка содержит гидроксильную группу. 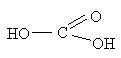 Cвойства производных угольной кислоты в основном подобны свойствам производных карбоновых кислот. Отличие от карбоновых кислот состоит в том, что производные угольной кислоты представляют собой результат замещения одной или двух гидроксильных групп. Поэтому и те и другие являются бифункциональными соединениями. Это открывает допонительные возможности вариации их структуры, а также делает симметричные структуры потенциальным сырьем для получения поликонденсационных полимеров. Рассмотрим некоторые наиболее важные производные угольной кислоты.  Фосген Хлоругольная кислота Фосген является устойчивым соединением, хлоругольная кислота неустойчива, известны ее производные, например эфиры. Фосген получают свободнорадикальным хлорированием оксида углерода (II) Фосген и эфиры хлоругольной кислоты проявляют свойства хлорангидридов карбоновых кислот, однако в отличие от последних более реакционноспособны в реакциях нуклеофильного замещения. Они являются реагентами для получения эфиров угольной и хлоругольной кислот. 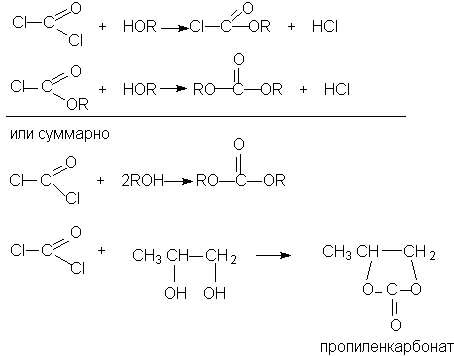 Если в качестве реагента используют фенолы, то результатом является образование диарилкарбонатов. 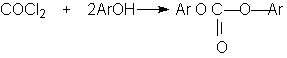 Фосген является бифункциональным соединением, поэтому его используют для получения пластмасс – поликарбонатов. 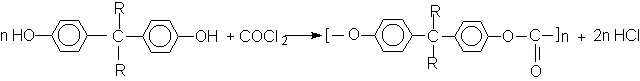 Эфиры угольной кислоты 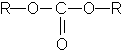 Эти соединения проявляют свойства обычных эфиров карбоновых кислот, в том числе вступают в реакции сложноэфирной конденсации и поэтому используются в органическом синтезе для введения в структуру органических алкоксикарбонильной группы. 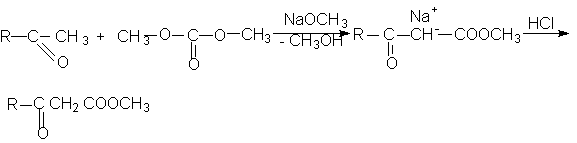 Амиды угольной кислоты Типичным представителем амидов угольной кислоты является мочевина (карбамид) В промышленности она может быть получена из аммиака и CO2 Процесс проводят при 180-2000С, 18-20 МПа и 100%-ном избытке NH3. Замещенные мочевины могут быть получены взаимодействием фосгена с аминами Эта реакция осуществляется ступенчато через промежуточное образование карбаминоилхлорида 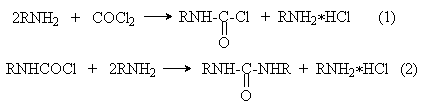 Можно видеть, что синтез замещенных мочевин требует применение избытка амина. Если реакцию проводить в избытке фосгена, то количественно образуется карбаминоил хлорид (реакция (1)). Последний может быть использован для получения изоцианатов RN=C=O: причем реакцию проводят в условиях диссоциации гидрохлорида амина, образующегося на стадии (1) и снова вовлекающегося в реакцию (1). Суммируя реакции (1), (3), (4), имеем стехиометрию процесса синтеза изоцианата Изоцианаты используют для получения уретанов (эфиров карбаминовой кислоты) Cами карбаминовые кислоты RNHCOOH , представляющие собой амиды, нестабильны и легко распадаются на амины(аммиак) и CO2 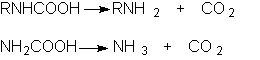 Практическое значение имеют диизоцианаты, образующие при сополимеризации с двухатомными спиртами полиуретаны. 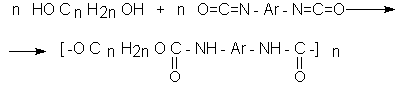 Полиуреаны применяют для получения синтетических волокон, каучуков, клеев и лаков. Из них получают пенопласты, для чего в процессе полимеризации добавляют немного воды, которая гидролизует часть изоцианитных групп с выделением диоксида углерода. CO2 вспенивает полимер, придавая ему пористую структуру. Другой способ получения уретанов (карбаматов) – амидирование эфиров хлоругольной кислоты: 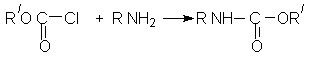 Многие эфиры замещенных карбаминовых кислот являются ценными пестицидами, достаточно легко разлагающимися в природных условиях с образованием малотоксичных соединений. Саму мочевину широко используют в сельском хозяйстве как высококачественное удобрение и кормовую добавку. Другие направления использования мочевины – карбамидная депарафинизация и синтез мочевино – формальдегидных смол Тиомочевина может быть получена изомеризацией роданида аммония, этот синтез аналогичен классическому синтезу мочевины из цианата аммония (кислородного аналога роданида) по Вёлеру:  Вместе с тем, в отличие от мочевины, тиомочевина при нагревании находится в равновесии с роданидом аммония: равновесная смесь при температуре 140 °C содержит 28,1 % тиомочевины, при 156 °C — 26,7 %, при 180 °C — 21,8 %[1]. Подобно синтезу мочевины из аммиака и диоксида углерода, тиомочевина также может быть синтезирована при взаимодействии аммиака и сероуглерода: {\displaystyle {\mathsf {CS_{2}+2NH_{3}\rightarrow (NH_{2})_{2}CS+H_{2}S}}} Тиомочевину также получают взаимодействием H2S или сульфидов аммония либо щелочных металлов с цианамидом кальция CaCN2 в водных растворах: {\displaystyle {\mathsf {CaCN_{2}+(NH_{4})_{2}S+2H_{2}O\rightarrow (NH_{2})_{2}CS+Ca(OH)_{2}+2NH_{3}}}}Структура молекулы тиомочевины может быть представлена мезомерными канонической тиоамидной формой и тиоимидными формами, несущими отрицательный заряд на атоме серы и положительный на атомах азота амидиновогофрагмента: 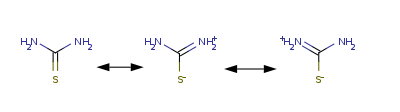 В результате атом серы является сильным нуклеофильным центром и тиомочевина протонируется по атому серы с образованием солей с сильными кислотами. Атаки мягких электрофилов также направляются на атом серы: тиомочевина алкилируется алкилгалогенидами и алкилсульфатами с образованием изотиурониевых солей: 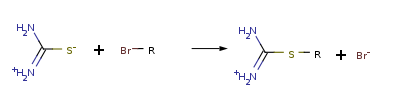 Аналогично протекает реакция тиомочевины с арилдиазониевыми солями. ЦИАНОВАЯ КИСЛОТА (цианатная к-та) С NH3 циановая кислота дает цианат аммония NH4NCO, при нагр. превращающийся в мочевину (Н2N)2СО. В водных р-рах циановая кислота гидролизуется: HNCO + H2O Разб. р-ры циановой кислоты в диэтиловом эфире, бензоле и толуоле устойчивы в течение длит. времени. В спиртовом р-ре циановая кислота превращается в эфиры аллофановой к-ты: При недостатке циановой кислоты продуктом р-ции является уретан. С ненасыщенными соед. образует изоцианаты: RCH = СН2 + HNCO При т-ре ниже 150 °С циановая кислота полимеризуется, в осн. до линейного циамелида Циановую кислоту обычно получают деполимеризацией очищенной циануровой к-ты (примеси м. б. причиной взрыва) при 400 °С в токе N2. Продукт р-ции конденсируют при -80 °С, встряхивают с Р2О5 и Ag2O для освобождения от следов влаги и HCN и перегоняют в глубоком вакууме. Другие методы - окисление HCN при 630-650 °С на контактной сетке из золота. Циановая кислота -исходный продукт в синтезе цианатов и изоцианатов, уретанов, аллофанатов, семикарбазида и его производных. Токсична. |
