Контрольная работа.docx_Биохимия_24. 4. Витамины В3, В
 Скачать 1.31 Mb. Скачать 1.31 Mb.
|
|
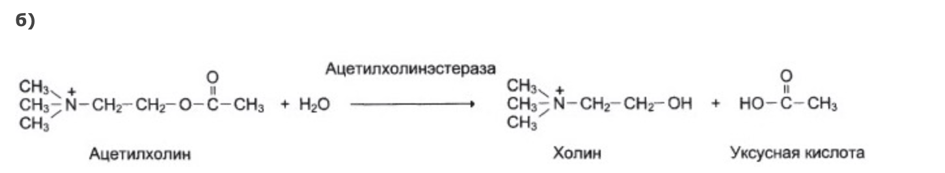
Контрольная работа. Вариант 24 4. Витамины В3, В5, их структура, биологическая роль. Коферментные формы витаминов. Приведите два примера биохимических реакций с участием данных коферментных форм, механизм процесса. Витамин В3 Витамин В3 (пантотеновую кислоту) иногда называют антидерматическим витамином. Открыт в рисовых отрубях и тканях печени. Витамин В3 является важным фактором в метаболизме углеводов, жиров и белков, являясь незаменимой частью КоА. В частности, он участвует в окислении и биосинтезе жирных кислот, окислительном декарбоксилировании кетокислот, цикле Кребса, биосинтезе стероидов, нейтральных жиров и т.д. 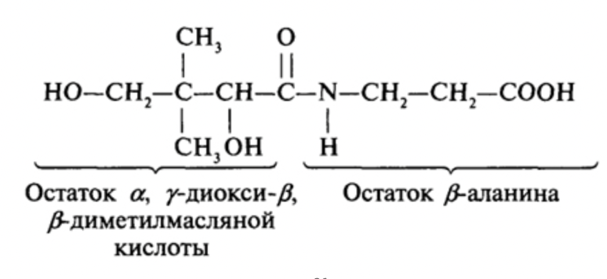 Структура Витамина В3 Структура Витамина В3Его коферментными формами являются кофермент А (коэнзим А, HS-КоА) и 4-фосфопантетеин. - Биохимическая реакция коэнзима А - как переносчика ацильных групп (в виде ацил-SKoA) при окислении жирных кислот и в реакциях синтеза жирных кислот, при синтезе триацилглицеролов и фосфолипидов. 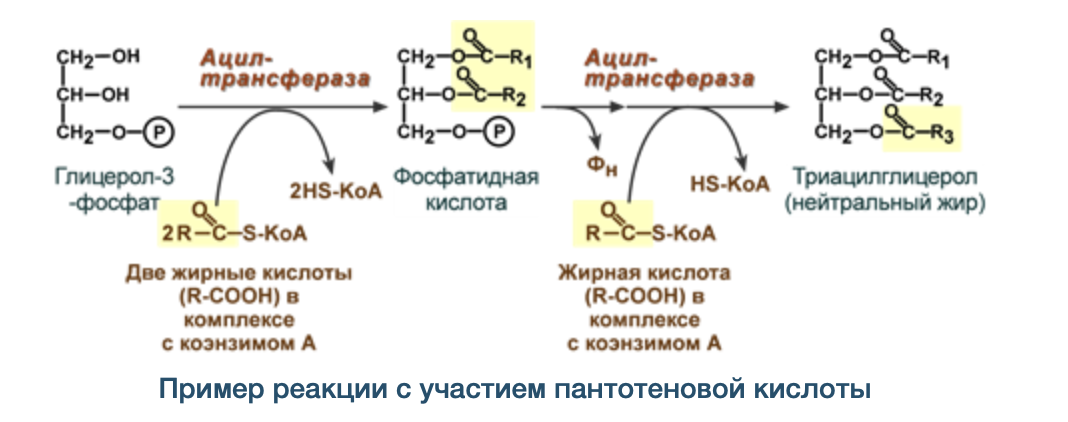 Витамин В5 Открытие витамина B5, или PP (никотинамида), связано с изучением природы пеллагры. Болезнь известна с XVIII в. в странах, где основным продуктом питания была кукуруза. Лишь К. Функ в 1914 г. установил, что причиной болезни является отсутствие никотиновой кислота и ее амида. Витамин широко распространен в природе, частично синтезируется микрофлорой пищевого канала при наличии в рационе триптофана. 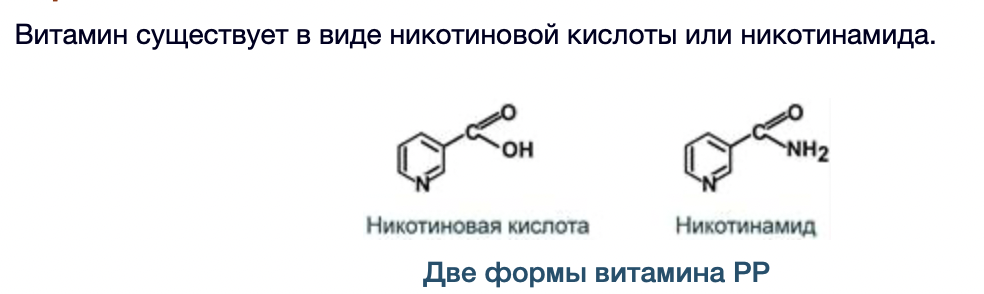 Никотинамид является составной частью многих ферментов, участвующих в процессах биологического окисления. В молекулу ферментов входит в виде коферментов - никотинамид-аденин-динуклеотида (НАД) и никотинамид-аденин- динуклеотид-фосфата (НАДФ). Биохимические реакции  15. Макроэргические соединения. АТP, строение и биологическая роль. Макроэргические соединения - органические соединения, при гидролизе которых освобождается значительное количество энергии, используемой для осуществления различных функций организма. Ведущее положение среди макроэргических соединений занимают аденозинтрифосфорная и аденозиндифосфорная, играющие основную роль в энергетическом обмене организма. К макроэргическим соединениям относятся также креатинфосфат, аргининфосфат, 1,3-дифосфоглицериновая кислота, ацетилфосфат, фосфоенолпировиноградная кислота. Строение АТФ: 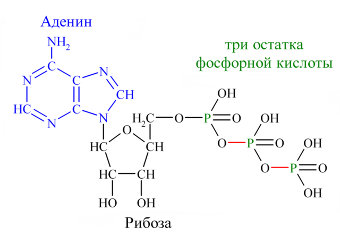 Биологическая роль АТФ Главная роль АТФ в организме связана с обеспечением энергией многочисленных биохимических реакций. Являясь носителем двух высокоэнергетических связей, АТФ служит непосредственным источником энергии для множества энергозатратных биохимических и физиологических процессов. Всё это реакции синтеза сложных веществ в организме: осуществление активного переноса молекул через биологические мембраны, в том числе и для создания трансмембранного электрического потенциала; осуществления мышечного сокращения. Помимо энергетической, АТФ выполняет в организме ещё ряд других не менее важных функций: Вместе с другими нуклеозидтрифосфатами АТФ является исходным продуктом при синтезе нуклеиновых кислот. Кроме того, АТФ отводится важное место в регуляции множества биохимических процессов. Являясь аллостерическим эффектором ряда ферментов, АТФ, присоединяясь к их регуляторным центрам, усиливает или подавляет их активность. Также известна роль АТФ в качестве медиатора в синапсах и сигнального вещества в других межклеточных взаимодействиях (пуринергическая передача сигнала). 24. Гликолиз, химизм процесса и его регуляция, энергетический эффект. Какую реакцию катализируют ферменты глюкокиназа и гексокиназа? Почему печень содержит глюкокиназу, а мозг и другие ткани - гексокиназу? Гликолиз–универсальный и основной процесс катаболизма углеводов для большинства организмов, это последовательность реакций, приводящих к превращению глюкозы в пируват с одновременным образованием АТФ. Исследования химизма гликолиза показали, что начальные этапы процессов брожения и дыхания имеют общий путь. При дыхании у аэробных организмов гликолиз предшествует циклу трикарбоновых кислот и цепи переноса электронов. Пируват проникает в митохондрии, где он полностью окисляется до СО2, в результате чего с высокой эффективностью из гексозы извлекается свободная энергия. При брожении, в анаэробных условиях (дрожжи, молочнокислые бактерии), пируват превращается в продукты брожения (этанол, лактат). Все реакции гликолиза протекают в цитоплазме клетки и катализируются десятью различными ферментами. Расчет энергетического эффекта гликолиза. В первом этапе гликолиза происходит затрата 2 моль АТФ: на фосфорилирование глюкозы и на фосфорилирование глюкозо-6-фосфата. Во втором этапе гликолиза можно найти две реакции субстратного фосфорилирования, в которых образуется 2 моль АТФ при распаде 1 моль 3-фосфоглицеринового альдегида. Следовательно, при распаде 2 моль 3-фосфоглицеринового альдегида образуется 4 моль АТФ. Суммируя полученное и затраченное количество АТФ, получаем суммарный энергетический эффект гликолиза - 2 моль АТФ. Ферменты глюкокиназа и гексокиназа катализируют превращение глюкозы в глюкозо-6-фосфат, но различаются по значению константы Михаэлиса, а также по локализации в организме: глюкокиназа — это фермент печени, а гексокиназа обнаруживается в печени, мышцах и других органах. Глюкокиназа не игибируется глюкозо-6-фосфатом, что и обеспечивает беспрепятственный синтез гликогена в печени при высокой концентрации глюкозы 36. Заполните таблицу, укажите отличия процессов β-окисления и синтеза высших жирных кислот (ВЖК).
47. Образование аммиака в организме. Механизм токсического действия аммиака. Синтез и распад глутамина, аспарагина, глюкозоаланиновый цикл. Биологическая роль этих процессов. Одним из конечных продуктов обмена аминокислот является высокотоксичный для организма аммиак. 1. Аммиак легко проникает через мембраны в клетки и в митохондриях сдвигает реакцию, катализируемую глутаматдегидрогеназой, в сторону образования глутамата: 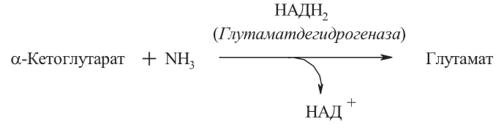 Уменьшение концентрации а-кетоглутарата вызывает угнетение реакции транс- аминирования аминокислот, а также снижение скорости цикла Кребса и развитие энергодефицита. 2. Аммиак является основанием, и повышение его концентрации в крови сдвигает pH в щелочную сторону, вызывая алкалоз, который увеличивает сродство гемоглобина к кислороду, что препятствует отдаче им кислорода. В результате развиваются гипоксия тканей 3. Аммиак является липофильным веществом, он легко проникает в клетки центральной нервной системы. Высокие концентрации аммиака, при участии глута- минсинтетазы, стимулируют синтез глутамина из глутамата в нервной ткани: Накопление глутамина в клетках нейроглии приводит к повышению в них осмотического давления, набуханию астроцитов и в больших концентрациях вызывает отек мозга. Связывание (обезвреживание) аммиака - Основной реакцией связывания аммиака, протекающей во всех тканях организма, является синтез глутамина под действием глутамин-синтетазы: Основными тканями-поставщиками глутамина служат мышцы, мозг и печень. С током крови глутамин транспортируется в кишечник и почки. 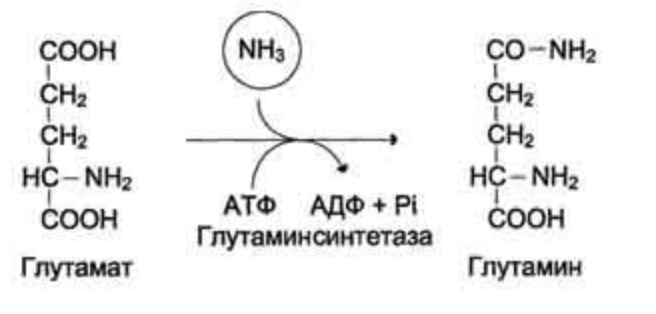 В клетках кишечника под действием фермента глутаминазы происходит гидролитическое освобождение амидного азота в виде аммиака: 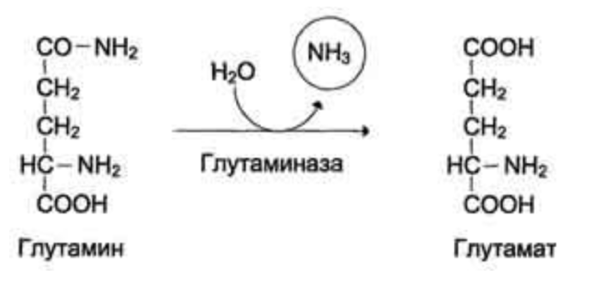 - Ещё одной реакцией обезвреживания аммиака в тканях можно считать синтез аспарагина под действием аспарагинсинтетазы. Однако такой путь обезвреживания аммиака в клетках животных используется редко и требует больших энергетических затрат, чем синтез глутамина. 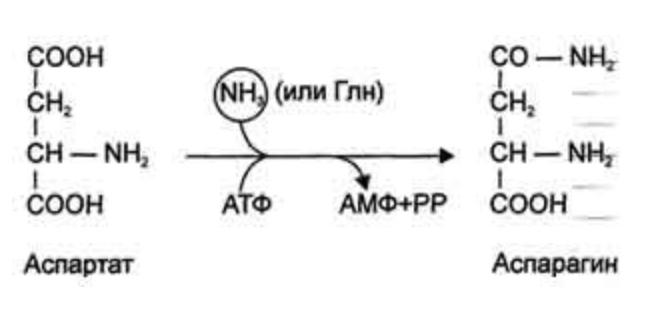 - Из мышц и кишечника избыток аммиака выводится преимущественно в виде аланина. Глюкозо-аланиновый цикл 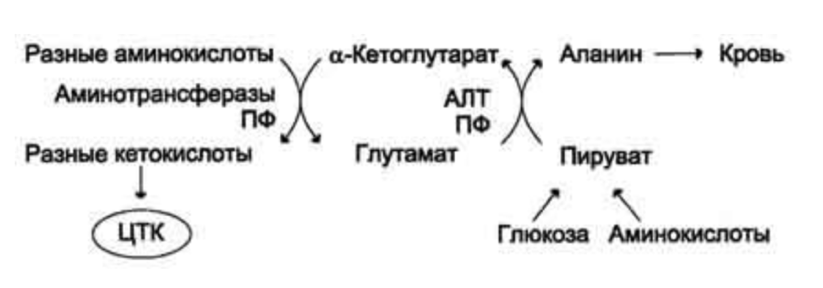 Аминогруппы разных аминокислот посредством реакций трансаминирования переносятся на пируват, основным источником которого служит процесс окисления глюкозы. Мышцы выделяют много аланина в силу их массы, а также потому, что часть энергии они получают за счёт распада аминокислот. Образовавшийся аланин поступает в печень, где подвергается непрямому дезаминированию. Выделившийся аммиак обезвреживается, а пируват включается в глюконеогенез. Глюкоза из печени поступает в ткани и там, в процессе гликолиза, опять окисляется до пирувата 56. Выберите соединения, являющиеся конечными продуктами распада нуклеотидов:
|