Сера рабочий лист. Раздаточный материал. А ллотропия и физические свойства серы
 Скачать 179.24 Kb. Скачать 179.24 Kb.
|
|
А  ллотропия и физические свойства серы. В отличие от кислорода, образующего две аллотропные формы, сера образует значительно большее число аллотропных видоизменений (модификаций), отличающихся не только составом, но и строением кристаллической решетки, а следовательно, и свойствами. ллотропия и физические свойства серы. В отличие от кислорода, образующего две аллотропные формы, сера образует значительно большее число аллотропных видоизменений (модификаций), отличающихся не только составом, но и строением кристаллической решетки, а следовательно, и свойствами.Сера в свободном виде образует две относительно устойчивые аллотропные модификации: ромбическую и моноклинную (табл. 15). Известны и другие, менее стойкие модификации серы. На образование аллотропных модификаций влияет и способность серы образовывать цепи —S—S—S—S—S—S—S—S—, которые могут замыкаться в кольца, образуя циклические молекулы из восьми атомов S8. Из них состоят молекулярные кристаллы ромбической и моноклинной серы (рис. 16). Все аллотропные модификации со временем переходят в ромбическую форму как наиболее устойчивую. 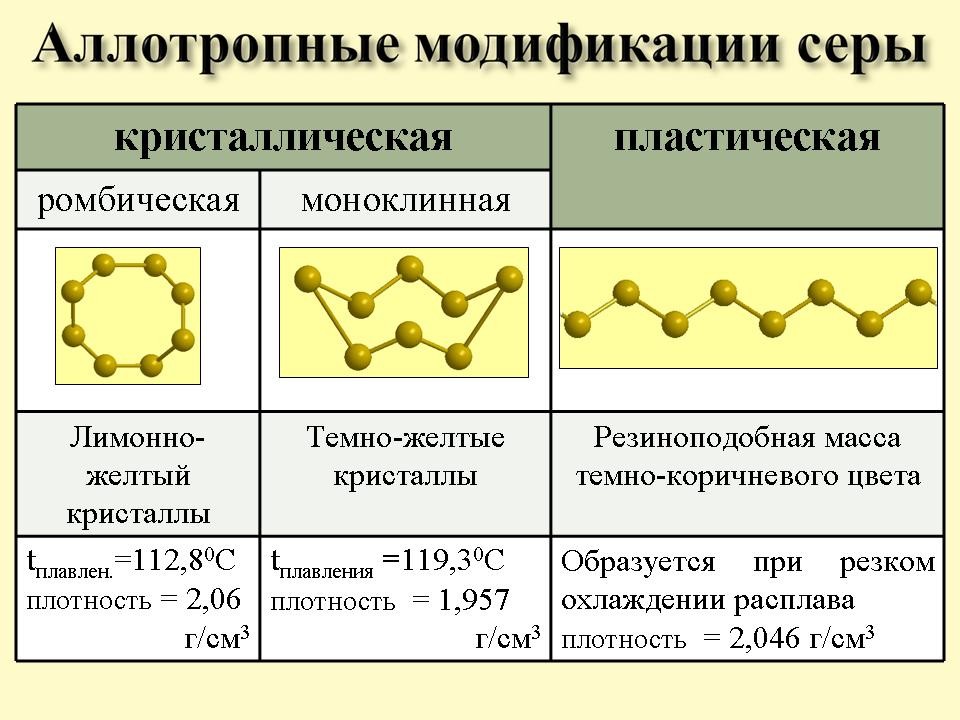 Ромбическая сера встречается в природе в свободном состоянии. При обычных условиях это хрупкое кристаллическое вещество желтого цвета. Ее кристаллы плавятся при 119 °С. Она нерастворима в воде, но хорошо растворяется в сероуглероде, бензине, бензоле и других органических растворителях. Сера плохо проводит тепло и электричество. При нормальных условиях в узлах кристаллической решетки ромбической серы находятся кольцевые молекулы S8. При нагревании выше 119 °С сера плавится. Начинается разрыв колец с образованием открытых цепей, способных соединяться друг с другом, что приводит к увеличению вязкости, разрушению кристаллической решетки и переходу серы в пластическую модификацию.  Нахождение в природе и получение Нахождение в природе и получениеВ природе сера встречается как в самородном виде, так и в виде соединений, главным образом, сульфатов и сульфидов. Большие запасы самородной серы обнаружены в Средней Азии, Польше, Мексике, на юге Италии. Часть природной серы имеет вулканическое происхождение, а часть образовалась из сульфатов под действием сульфатредуцирующих бактерий. Сера входит в состав природных сульфатов и сульфидов, например: — мирабилит — гипс — медный блеск — свинцовый блеск — пирит — киноварь — цинковая обманка — антимонит В виде органических соединений сера содержится в нефти, каменном угле, входит в состав белков. 1. В промышленных масштабах серу получают открытым способом на месторождениях самородной серы, либо из вулканов. Из серной руды серу получают также пароводяными, фильтрационными, термическими, центрифугальными и экстракционными методами. Пароводяной метод — это выплавление из руды с помощью водяного пара. 2. Способ получения серы в лаборатории – неполное окисление сероводорода. 2H2S + O2 → 2S + 2H2O 3. Еще один способ получения серы –взаимодействие сероводорода с оксидом серы (IV): 2H2S + SO2 → 3S + 2H2O Химические свойства серы В нормальных условиях химическая активность серы невелика: при нагревании сера активна, и может быть как окислителем, так и восстановителем. 1. Сера проявляет свойства окислителя (при взаимодействии с элементами, которые расположены ниже и левее в Периодической системе) и свойства восстановителя (с элементами, расположенными выше и правее). Поэтому сера реагирует с металлами и неметаллами. 1.1. При горении серы на воздухе образуется оксид серы (IV): S + O2 → SO2 1.2. При взаимодействии серы с галогенами (со всеми, кроме йода)образуются галогениды серы: S + Cl2 → SCl2 (S2Cl2) S + 3F2 → SF6 1.3. При взаимодействии фосфора и углерода с серой образуются сульфиды фосфора и сероуглерод: 2P + 3S → P2S3 2P + 5S → P2S5 2S + C → CS2 1.4. При взаимодействии с металлами сера проявляет свойства окислителя, продукты реакции называют сульфидами. С щелочными металлами сера реагирует без нагревания, а с остальными металлами (кроме золота и платины) – только при нагревании. Например, железо и ртуть реагируют с серой с образованием сульфидов железа (II) и ртути: S + Fe → FeS S + Hg → HgS Еще пример: алюминий взаимодействует с серой с образованием сульфида алюминия: 3S + 2Al → Al2S3 1.5. С водородомсера взаимодействует при нагревании с образованием сероводорода: S + H2 → H2S Химические свойства серы 2. Со сложными веществами сера реагирует, также проявляя окислительные и восстановительные свойства. Сера диспропорционирует при взаимодействии с некоторыми веществами 2.1. При взаимодействии с окислителями сера окисляется до оксида серы (IV) или до серной кислоты (если реакция протекает в растворе). Например, азотная кислота окисляет серу до серной кислоты: S + 6HNO3 → H2SO4 + 6NO2 + 2H2O Серная кислота также окисляет серу. Но, поскольку S+6 не может окислить серу же до степени окисления +6, образуется оксид серы (IV): S + 2H2SO4 → 3SO2 + 2H2O Соединения хлора, например, бертолетова соль, также окисляют серу до +4: S + 2KClO3 → 3SO2 + 2KCl Взаимодействие серы с сульфитами (при кипячении) приводит к образованию тиосульфатов: S + Na2SO3 → Na2S2O3 2.2. При растворении в щелочах сера диспропорционирует до сульфита и сульфида. Например, сера реагирует с гидроксидом натрия: S + 6NaOH → Na2SO3 + 2Na2S + 3H2O При взаимодействии с перегретым паром сера диспропорционирует: 3S + 2H2O (пар) → 2H2S + SO2 |
