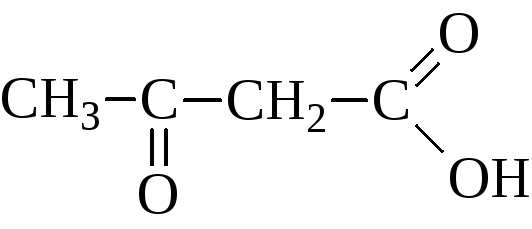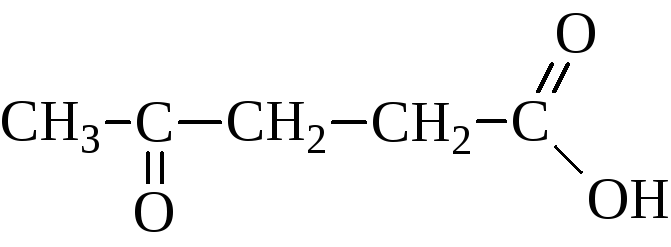Тема 17. Кетокислоты. Альдегидо и кетокислоты
 Скачать 255.72 Kb. Скачать 255.72 Kb.
|
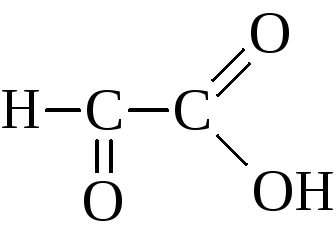
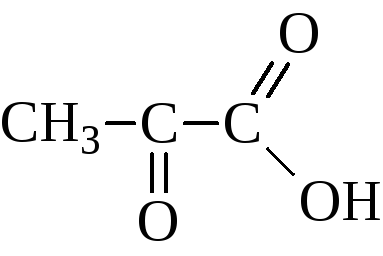
       АЛЬДЕГИДО- И КЕТОКИСЛОТЫ (оксокарбоновые к-ты, оксокислоты), соединения, содержащие карбоксильную и карбонильную (альдегидную или кетонную) группы. В соответствии с взаимным расположением этих групп в молекулеразличают Единственный представитель 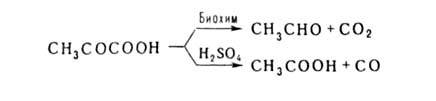 Окисляется Н2О2 в уксусную к-ту. Является важнейшим промежут. продуктом, связывающим превращения углеводов, белков и липидов (см., напр., Трикарбоновых кислот цикл). Применяется в произ-ве лек. в-в, напр. цинхофена (атофана). Для 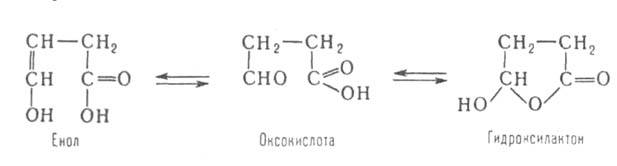 (пеницилловая) в кристаллич. состоянии и в водном р-ре находится в форме гидроксилактона. Обладает св-вами антибиотиков. Простейший представитель 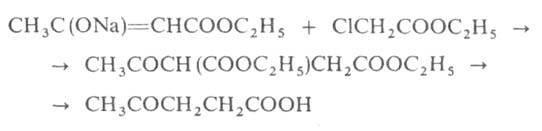 Левулиновая к-та не отщепляет самопроизвольно СО2. Как и др. 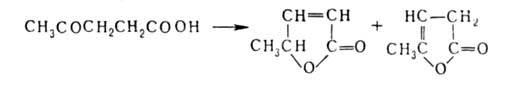 Применяется в произ-ве лек. ср-в, в гальванотехнике при хромировании, как флюс для пайки. Большое биол. значение имеют Щавелевоуксусная к-та НООССОСН2СООН является одновременно Альдегидо- и кетокислоты Альдегидо- и кетокислотами называются органические соединения, содержащие в молекуле карбоксильную и альдегидную или кетонную группы соответственно. В зависимости от взаимного расположения этих двух групп они разделяются на α, β, γ … - альдегидо- и кетокислоты. Примером этих кислот могут служить:
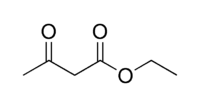
Пировиноградная кислота своё название получила по способу получения пиролизом виноградной кислоты 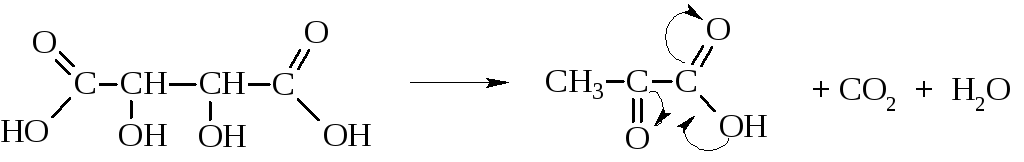 Кипит при 165 °С. Как кислота она сильнее уксусной – сказывается влияние карбонильной группы. Ацетоуксусная кислота, как и все β-кетокислоты, неустойчива и при слабом нагревании разлагается с выделением СО2. 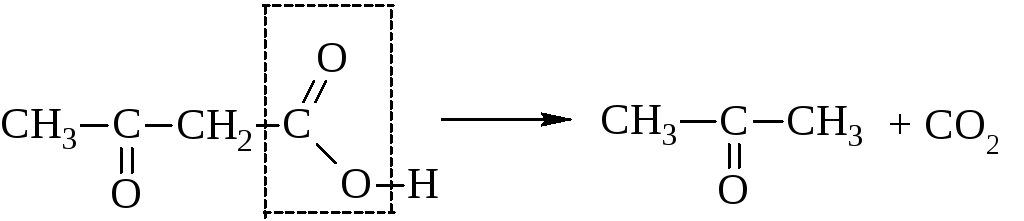 Из производных кетокислот наибольшее значение имеет этиловый эфир ацетоуксусной кислоты, называемый обычно ацетоуксусным эфиром 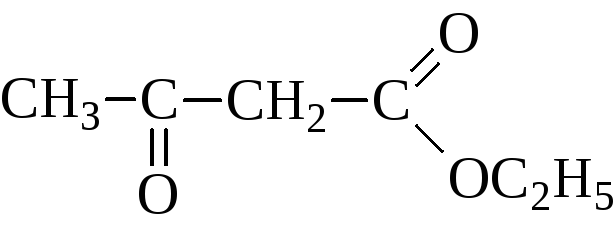 Это соединение является типичным примером соединений, способных к кето-енольной таутомерии. 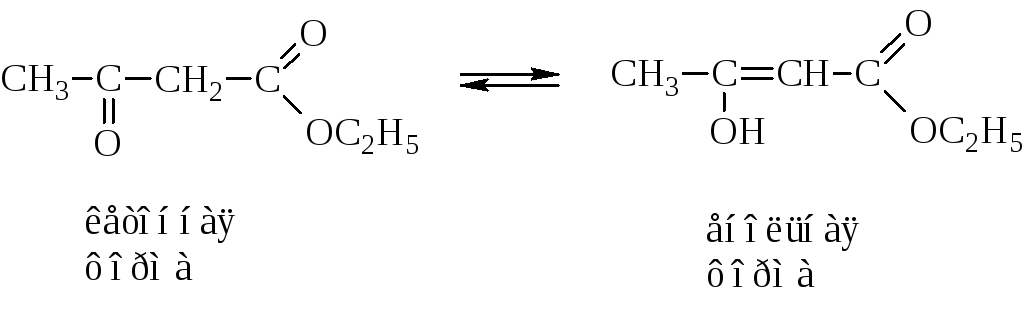 Енольные формы соединений обычно бывают неустойчивыми. Однако в данном случае при образовании енольной формы она стабилизируется за счёт сопряжения и образования внутримолекулярной водородной связи 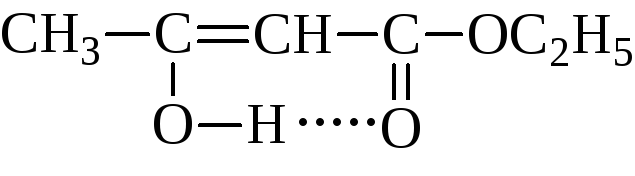 Благодаря этому обе формы могут быть выделены в свободном состоянии. Однако в «обыкновенном» ацетоуксусном эфире обе формы находятся в равновесии, причём енола содержится обычно меньше 10 %. Увеличение полярности растворителя повышает содержание кетонной формы. Ацетоуксусный эфир может реагировать и в кетонной и в енольной формах. Тип взаимодействия определяется средой и реагентом. Для ацетоуксусного эфира, как и для других 1,3-дикарбонильных соединений характерна кето-енольная таутомерия: 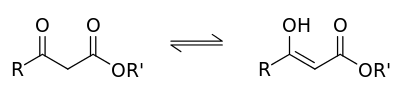 , ,Согласно правилу Эльтекова енольные формы карбонильных соединений неустойчивы. Однако в ряде случаев енольные формы могут быть достаточно стабильными. Например, енольный таутомер стабилизирован за счет образования сопряжённой системы ( (H):О—C(CH3)=C(H) —C(:OC2H5)=O: ; см. 2-ю формулу енольной формы на рис., R — CH3, R’ — C2H5) и внутримолекулярной водородной связи между протоном и соседним карбонильным кислородом. Положение равновесия и, соответственно, соотношение таутомеров зависит от растворителя и температуры. Так, в чистом ацетоуксусном эфире при комнатной температуре концентрация енольной формы составляет 7,5 % (кетонной — 92,5 %). Равновесие сдвигается в сторону енольной формы при уменьшении полярности растворителя, так, при 18 °C доля енольной формы в водном растворе составляет 0,4 %, в диэтиловом эфире — 27,1 %, в циклогексане — 46,4 %. Кетонная форма ацетоуксусного эфира может быть выделена из равновесной смеси вымораживанием, енольная - вакуумной перегонкой в кварцевой посуде. Скорость установления кето-енольного равновесия зависит от температуры и материала сосуда, чистые таутомеры хранятся в кварцевой посуде при низких температурах (-80°C - охлаждение сухим льдом). Содержание енольной формы определяется бромометрически: бром практически мгновенно присоединяется по двойной связи енола, что сопровождается исчезновением желто-оранжевой окраски молекулярного брома. Реакциями енольной формы также обусловлено O-ацилирование ацетоуксусного эфира хлорангидридами карбоновых кислот в пиридине, при этом образуются сложные эфиры β-гидроксикротоновой кислоты: CH3(HO)C=CHCOOC2H5 + ROCl {\displaystyle \to } CH3(ROO)C=CHCOOC2H5 + HCl При взаимодействии с пентахлоридом фосфора гидроксил енольной формы ацетоуксусного эфира замещается на хлор с образованием этилового эфира β-хлоркротоновой кислоты: CH3(HO)C=CHCOOC2H5 + PCl5 {\displaystyle \to } CH3ClC=CHCOOC2H5 + POCl3 + HCl С металлами ацетоуксусный эфир образует хелаты, в которых ацетилацетат-анион выступает в роли бидентантного лиганда, так, с солями трехвалентного железа ацетоуксусный эфир образует окрашенный в пурпурный цвет комплекс: 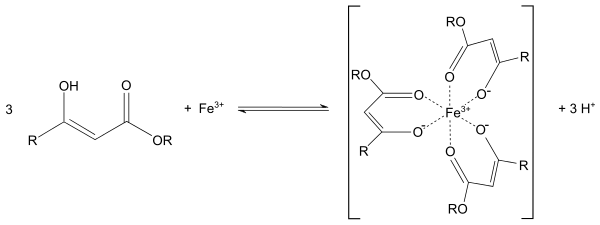 Под действием сильных оснований и щелочных металлов ацетоуксусный эфир депротонируется с образованием резонансно стабилизированного аниона: 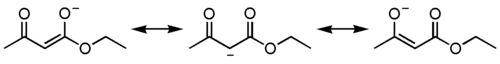 Образование натриевой соли ацетилацетата (натрийацетоуксусного эфира) под действием алкоголята натрия - в том числе и под действием этилата натрия, образующегося in situ при действии металлического натрия на ацетоуксусный эфир - широко используется в синтетической практике вследствие высокой нуклеофильности аниона. Ацетилацетат натрия в реакциях с мягкими электрофилами выступает в роли C-нуклеофила. Так, он легко алкилируется галогеналкилами с образованием соответствующих алкилацетоуксусных эфиров, из которых, в свою очередь, могут быть получены и затем проалкилированы натриевые производные: CH3COCH2COOC2H5 + EtONa {\displaystyle \to } CH3COCH-COOC2H5 Na+ + EtOH CH3COCH-COOC2H5 Na+ + RHal {\displaystyle \to } CH3COCHRCOOC2H5 + NaHal В безводных условиях в присутствии бикарбоната натрия ацетоуксусный эфир самоконденсируется с образованием дегидроацетовой кислоты[1]:
Под действием серной кислоты на ацетоуксусный эфир происходит самоконденсация двух молекул эфира с замыканием α-пиронового цикла, ведущая к образованию изодегидроацетовой кислоты[2]. Под действием водных кислот или разбавленных растворов щелочей ацетоуксусный эфир омыляется с образованием нестабильной ацетоуксусной кислоты, которая в мягких условиях декарбоксилируется с образованием ацетона: CH3COCH2COOC2H5 + H2O {\displaystyle \to } CH3COCH2COOH + C2H5OH CH3COCH2COOH {\displaystyle \to } CH3COCH3 + CO2 + H2O Аналогичным образом ведут себя и моно- и дизамещенные ацетоуксусные эфиры, полученные алкилированием натрийацетоуксусного эфира (кетонное расщепление), эта реакция используется для синтеза замещенных метилкетонов. Иначе протекает взаимодействие ацетоуксусного эфира с концентрированными растворами щелочей: в этом случае протекает отщепление ацетильной группы с образованием двух молекул уксусной кислоты (кислотное расщепление), эта реакция идет и с замещенными ацетоуксусными эфирами и используется для синтеза гомологов уксусной кислоты через алкилпроизводные ацетоуксусного эфира: CH3COCHRCOOC2H5 + OH- + H2O {\displaystyle \to } CH3COO- + RCH2COOH + C2H5OH Синтез Классическим методом синтеза ацетоуксусного эфира является сложноэфирная конденсация этилацетата в присутствии этанола под действием металлического натрия, катализатором конденсации является образующийся in situ этилат натрия. Образующийся натрийацетоуксусный эфир действием разбавленной минеральной кислоты переводят в ацетоуксусный эфир[3]: 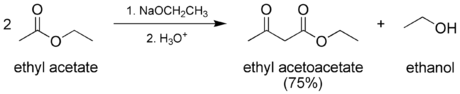 Ацетоуксусный эфир также может быть синтезирован ацилированием этанола дикетеном, этот метод является промышленным методом синтеза: 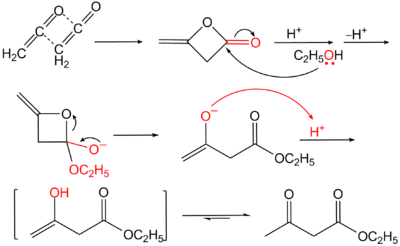 Применение Ацетоуксусный эфир широко применяется в органическом синтезе. Алкилирование натрийацетоуксусного эфира 2 с последующим кетонным либо кислотным расщеплением моно- и дизамещенных ацетоуксусныых эфиров 3 используется как препаративный метод синтеза метилкетонов 4 и замещенных уксусных кислот 5: 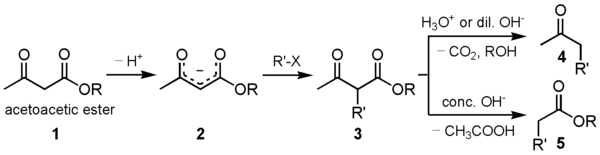 Будучи 1,3-дифункциональным реагентом, он применяется для синтеза гетероциклических соединений. В промышленности применяется в производстве фармацевтических препаратов (пирамидона, акрихина, витамина B1), ряда органических веществ. В фотографии использовался как жёлтая диффундирующая цветообразующая компонента, образующая краситель в процессе цветного фотографического проявления[4]. | ||||||||||||||||||||