бх 1 зянятие белки. бх белки 1. Аминокислоты
 Скачать 375.91 Kb. Скачать 375.91 Kb.
|
АминокислотыАминокислоты – это строительные блоки макромолекул – белков. По строению они являются органическими карбоновыми кислотами, у которых, как минимум, один атом водорода замещен на аминогруппу. КЛАССИФИКАЦИЯПо абсолютной конфигурации молекулы – D- и L-формы. Различия связаны со взаимным расположением четырех замещающих групп, находящихся в вершинах воображаемого тетраэдра. Как известно, тетраэдр – это довольно жесткая структура, в которой невозможно произвольным образом передвинуть вершины. Точно так же для молекул, построенных на основе атома углерода. За эталон конфигурации принята структура молекулы глицеральдегида, установленная с помощью рентгеноструктурного анализа. Принято, что в качестве маркера используют наиболее сильно окисленный атом углерода, связанный с асимметричным атомом углерода (на схемах его располагают сверху). Таким атомом в молекуле глицеральдегида служит альдегидная группа, для аланина маркерной является СООН-группа. Атом водорода располагают так же, как в глицеральдегиде. В дентине, белке зубной эмали, скорость рацемизации L-аспартата равна 0,10% в год. При формировании зуба у детей используется только L-аспартат. Это позволяет определять возраст долгожителей в сомнительных случаях. Для ископаемых останков наряду с радиоизотопным методом также используют определение рацемизации аминокислот в белке. В белке любого организма содержится только один изомер, для млекопитающих это L-аминокислоты. Однако оптические изомеры претерпевают самопроизвольную не ферментативную рацемизацию, т.е. L-форма переходит в D-форму. Это обстоятельство используется для определения возраста ткани. По строению бокового радикала – неполярные (алифатические, аромати- ческие) и полярные (незаряженные, отрицательно и положительно заряжен- ные); По кислотно-основным свойствам – электрохимическая. Подразделяют нейтральные (большинство), кислые (Асп, Глу) и основные (Лиз, Арг, Гис) аминокислоты. По необходимости для организма (физиологическая классификация) – не- заменимые (Лей, Иле, Вал, Фен, Три, Тре, Лиз, Мет) и заменимые. Две ами- нокислоты являются условно незаменимыми (Арг. Гис) ФИЗИКО - ХИМИЧЕСКИЕ СВОЙСТВА АМИНОКИСЛОТЯвляются амфотерными электролитами, Аминокислоты сочетают в себе свойства и кислот и оснований. Соответственно, в водном доноры протонов и как основания – акцепторы протонов. Если общий заряд аминокислоты равен 0, то это ее состояние называют изоэлектрическим. Величина рН, при которой заряд аминокислоты равен 0, называется изоэлектрической точкой (pI). рI большинства аминокислот располагается в диапазоне рН от 5,5 (Фен) до 6,3 (Про). рI кислых аминокислот – рIГлу 3,2, рIАсп 2,8 рI основных аминокислот – рIГис 7,6, рIАрг 10,8, рIЛиз 9,7 рI гистидина позволяет ему использоваться в буферной системе гемоглобина, в котором он содержится в большом количестве. Гемоглобин легко принимает и легко отдает протоны водорода при малейших сдвигах физиологической рН крови ( в норме 7,35-7,45). Заряд аминокислот зависит от величины рН среды. Отправным пунктом для понимания причин появления заряда у аминокислот является величина изоэлектрической точки. Ситуация различается для нейтраль- ных, кислых и основных аминокислот. Для нейтральных аминокислот: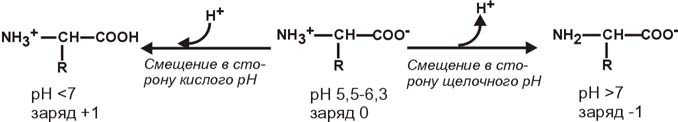 Для кислых аминокислот: 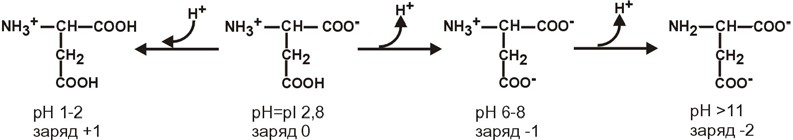 Для основных аминокислот: 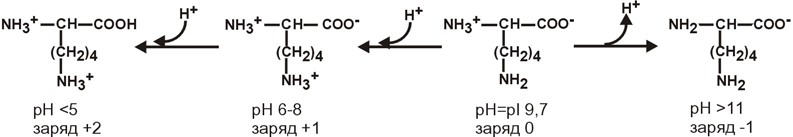  БЕЛКИ СТРОЕНИЕ БЕЛКОВ Аминокислоты способны соединяться между собой связями, которые называются пептидными, при этом образуется полимерная молекула. Если количество аминокислот не превышает 10, то соединение называется пептид; если от 10 до 40 аминокислот – полипептид, если более 40 аминокислот – белок. Пептидная связь — это связь между -карбоксильной группой одной аминокислоты и -аминогруппой другой аминокислоты. 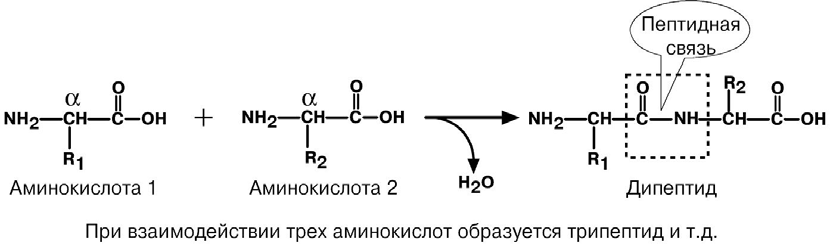 При необходимости назвать пептид ко всем названиям аминокислот добавляют суффикс ,,-ил", только последняя аминокислота сохраняет свое название неизменным. Например глутатион. СВОЙСТВА ПЕПТИДНОЙ СВЯЗИ КопланарностьВсе атомы, входящие в пептидную группу находятся в одной плоскости, при этом атомы Н и О расположены по разные стороны от пептидной связи, Транс-положение заместителей (радикалов) аминокислот по отношению к C-N 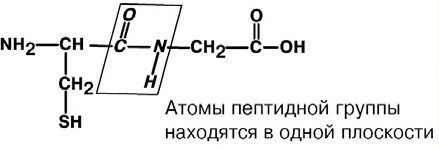 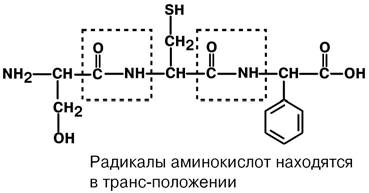 связи, связи,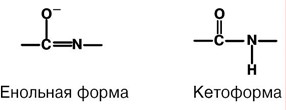 Наличие кето- и енольной форм. Наличие кето- и енольной форм.Способность к образованию двух водородных связей с другими группами, Пептидная связь имеет частично характер двойной связи. В результате она является жесткой структурой и вращение вокруг нее затруд- нено. Но, благодаря тому, что кроме пептидной в белке есть и другие связи, цепочка аминокислот способна вращаться вокруг основной оси, что придает белкам различ- ную конформацию (пространственное расположение атомов). Структурная:ФУНКЦИИ БЕЛКОВ в соединительной ткани – коллаген, эластин, кератин построение мембран и формирование цитоскелета (интегральные, полуин- тегральные и поверхностные белки) – спектрин, гликофорин. построение органелл – рибосомы Ферментативная –Практически все ферменты являются белками. Гормональная.Регуляция и согласование обмена веществ в разных клетках организма – инсу- лин, гормон роста. Рецепторная.Избирательное связывание гормонов, медиаторов. ТранспортнаяПеренос веществ в крови (липопротеины, гемоглобин, трансферрин) или через мембраны (Na+,К+-АТФаза, Сф2+-АТФаза) Пищевая и резервная – яичный альбумин, казеин молока. Защитная – иммуноглобулины, белки свертывания крови. УРОВНИ ОРГАНИЗАЦИИ БЕЛКОВП ЕР ВИЧ Н АЯ СТ РУК Т У Р А Это последовательность аминокислот в полипептидной цепи. Учитывая, что в синтезе белов принимает участие 20 аминокислот можно сказать о невообразимом количестве возможных белков. Первичная структура белков задается последовательностью нуклеотидов в ДНК. Выпадение, вставка, замена нуклеотида приводит к изменению аминокислотно- го состава и, следовательно, структуры синтезируемого белка. Если изменение последовательности аминокислот носит не летальный харак- тер, а приспособительный или хотя бы нейтральный, то такой белок может пере- даться по наследству и остаться в популяции. В результате возникают новые белки и новые качества организма. такое явление называется полиморфизм. Последовательность и соотношение аминокислот в первичной структуре опре- деляет формирование вторичной, третичной и четвертичной структур. В ТОР И ЧН АЯ СТ РУК Т У Р А Это способ укладки полипептидной цепи в упорядоченную структуру, при кото- рой взаимодействуют близко расположенные вдоль цепи аминокислоты. Формиро- вание вторичной структуры вызвано стремлением пептида принять конформацию с наибольшим количеством водородных связей между группами. Вторичную структуру определяет: устойчивость пептидной связи подвижность С-С связи размер радикала. Они вкупе с аминокислотной последовательностью приводят к строго опреде- ленной конфигурации белка. Можно выделять два возможных варианта вторичной структуры: a-спираль и b- складчатый слой. а-спиральПравозакрученная спираль, образуется при помощи водород- ных связей между пептидными группами каждого 1 и 4 аминокис- лотных остатков. Формированию спирали препятствуют пролин и гидрооксипролин, которые обуславливают “перелом” цепи, ее резкий .изгиб Высота витка составляет 0,54 нм и соответствует 3,6 аминокислотных остатков, 5 витков соответствуют 18 аминокислотам и занимают 2,7 нм. b-структураВ этом способе укладки белка полипептидная цепь вытянута, ее пептидная группа взаимодействует с отдаленными участками той же цепи, или же с другими цепями (числом от 2 до 5). Т РЕ ТИЧН АЯ СТ РУК Т У Р А Это взаимная укладка областей и отдельных аминокислотных остатков полипептидной цепи. Четкой границы между вторичной и третичной структурами про- вести нельзя, однако под третичной структурой понимают стерические взаимосвязи между аминокислотами, отстоящими далеко друг от друга в цепи. Благодаря третичной структуре происходит еще более компактное формирование цепи. Наряду с -спиралью и -структурой в третичной структуре обнаруживается так называемая неупорядоченная кон- формация, которая может занимать зна- чительную часть молекулы. В разных белках наблюдается разное соотношение типов структур. Например, инсулин содержит 52% a-спирали и 6% b- структуры. В формировании третичной структуры принимают участие различные связи: В основном: водородные Как дополнительные, но не менее значимые: дисульфидные псевдопептидные ионные Ч ЕТВЕРТИЧНА Я СТ РУ КТ УР А Если белки состоят из двух и более полипептидных цепей, связанных между собой нековалентными (не пептидными и не дисульфидными) связями, то говорят, что они обладают четвертичной структурой. Такие агрегаты стабилизируются водородными связями и электростатическими взаимодействиями между остатками ами-нокислот, находящихся на поверхности глобулы. Подобные белки называются олигомерами, а их индивидуальные цепи – протомерами (мономерами, субъединицами). Если белки содержат 2 протомера, то они называются димерами, если 4, то тетрамерами и т.д. Например Гемоглобин - белок эритроцитов, переносящий кислород, состоит из 4 субъединиц - 2 альфа и 2 бета в гемоглобине взрослых, 2 аль- фа и 2 гамма в фетальном гемоглобине.. Олигомерные белки проявляют свойства, отсутствующие у мономерных белков. Влияние четвертичной структуры на функциональные свойства белка можно рассмотреть, сравнивая строение и функции двух родственных гемсодержащих белков: миоглобина и гемоглобина. Оба белка имеют общее эволюционное происхождение, сходную конформацию отдельных полипептидных цепей и сходную функцию (участвуют в транспорте кислорода), но миоглобин — мономерный белок, а гемоглобин — тетрамер. А. Структура и функции миоглобина Миоглобин относят к классу гемсодержащих белков, т. е. он содержит простетическую группу — гем, довольно прочно связанную с белковой частью. Миоглобин относят к глобулярным белкам; он имеет только одну полипептидную цепь. 1. Клеточная локализация и функция Миоглобин содержится в красных мышцах и участвует в запасании кислорода. В условиях интенсивной мышечной работы, когда парциальное давление кислорода в ткани падает, O2 освобождается из комплекса с миоглобином и используется в митохондриях клеток для получения необходимой для работы мышц энергии. 2. Строение миоглобина Миоглобин содержит небелковую часть (гем) и белковую часть (апомиоглобин). Гем — молекула, имеющая структуру циклического тетрапиррола, где 4 пиррольных кольца соединены метиленовыми мостиками и содержат 4 метальные, 2 винильные и 2 пропионатные боковые цепи. Апомиоглобин — белковая часть миоглобина; первичная структура представлена последовательностью из 153 аминокислот, которые во вторичной структуре уложены в 8 α-спиралей. α-Спирали обозначают латинскими буквами от А до Н, начиная с N-конца полипептидной цепи, и содержат от 7 до 23 аминокислот. Для обозначения индивидуальных аминокислот в первичной структуре апомиоглобина используют либо написание их порядкового номера от N-конца (например, Гис64, Фен138), либо букву α-спирали и порядковый номер данной аминокислоты в этой спирали, начиная с N-конца (например, Гис F8). Третичная структура имеет вид компактной глобулы (внутри практически нет свободного места), образованной за счёт петель и поворотов в области неспирализованных участков белка. Внутренняя часть молекулы почти целиком состоит из гидрофобных радикалов, за исключением двух остатков Гис, располагающихся в активном центре. 3. Связывание гема с апомиоглобином Гем — специфический лиганд апомиоглобина, присоединяющийся к белковой части в углублении между двумя α-спиралями F и Е. Центр связывания с гемом образован преимущественно гидрофобными остатками аминокислот, окружающими гидрофобные пиррольные кольца гема. Две боковые группы пропионовых кислот, ионизированные при физиологических значениях pH, выступают на поверхности молекулы. 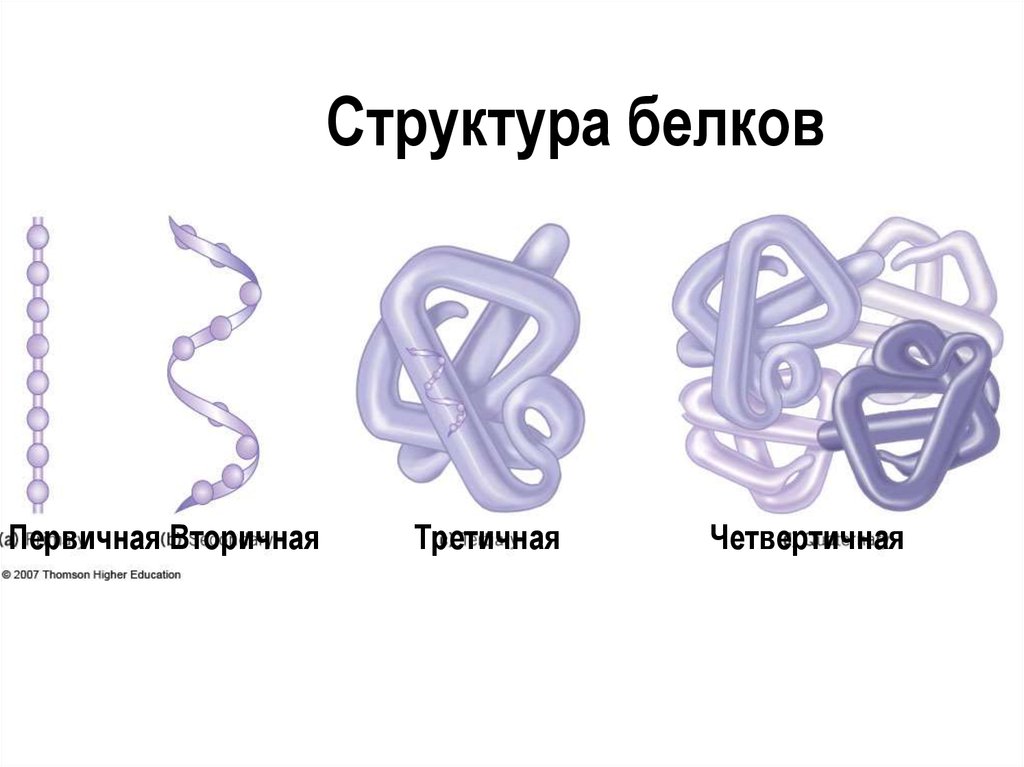 КЛАССИФИКАЦИЯ БЕЛКОВА . ПО ФУНКЦИИ См выше "Функции белков" Б . ПО СТРОЕНИЮ По форме молекулы:Глобулярные – соотношение продольной и поперечной осей составляет <10 и в большинстве случаев не более 3-4. Они характеризуются компактной укладкой полипептидных цепей. Например, инсулин, альбумин, глобулины плазмы крови. Фибриллярные – соотношение осей >10. Они состоят из пучков полипептидных цепей, спиралью навитых друг на друга и связанные между собой поперечными ковалентными и водородными связями. Выполняют защитную и структурную функции. Например: кератин, миозин, коллаген, фибрин. По количеству белковых цепей в одной молекулемономерные – имеют одну субъединицу (протомер)  полимерные – имеют несколько субъединиц. Например, гемоглобин (4 субъединицы), лактатде- гидрогеназа (4 субъединицы), креатинфосфокиназа (2 субъединицы), РНК-полимераза (5 цепей), По химическому составу:Простые – содержат в составе только аминокислоты Сложные – кроме аминокислот имеются небелковые компоненты П РО СТЫ Е БЕЛКИ Структура представлена только полипептидной цепью (альбумин, инсулин). Однако необходимо понимать, что многие простые белки (например, альбумин) не существуют в „чистом" виде, просто связи с небелковой группой слабые. АльбуминыБелки массой ММ=40кД, имеют кислые свойства и отрицательный заряд при физиологических рН, т.к. содержат много глутаминовой кислоты. Легко адсорбируют полярные и неполярные молекулы, является в крови переносчиком многих веществ Глобулины – ММ>100 кД, слабокислые или нейтральные, поэтому они слабо гидратированы, менее устойчивы и легче осаждаются, что используется в клиниче- ской диагностике в „осадочных" пробах (тимоловая, Вельтмана). Часто содержат уг- леводные компоненты. Некоторые способны к связыванию определенных веществ: трансферрин (переносчик Fe), церулоплазмин (переносчик Си), гаптоглобин (пере- носчик гемоглобина), гемопексин (переносчик тема). При электрофорезе разделяют- ся, как минимум, на 4 фракции а1, а2, в и у. ГистоныБелки массой ММ=24 кД. Обладают выраженными основными свойствами, т.е. при физиологических рН заряжены положительно и, поэтому связываются с ДНК. Существуют 5 типов гистонов: Н1 – очень богат Лиз (29%), Н2а – умеренно богат Лиз (11%) и Apr (9,5%), H2b – умеренно богат Лиз (16%) и Apr (6,5%), НЗ – умеренно богат Лиз (10%) и Apr (13,5%), Н4 – умеренно богат Лиз (11%) и Apr (14%). Радикалы аминокислот в составе гистонов могут быть ферментативно ме- тилированы, ацетилированы или фосфо- рилированы. Это изменяет суммарный заряд и другие свойства белков. Функция: Регулируют активность генома, а именно – препятствуют транскрипции, Структурная – стабилизируют простран- ственную структуру ДНК. Гистоны образуют нуклеосомы (укороче- ние в 7 раз), далее суперспираль и „суперсу- перспираль". Тем самым они участвуют в плотной упаковке ДНК при формировании хромосом. Благодаря гистонам размеры ДНК уменьшаются в тысячи раз: ведь длина ДНК достигает 6-9 см (10-1), а размеры хромосом – всего несколько микрометров (10-6) ПротаминыЭто белки массой ММ=4-12 кД, у ряда организмов они являются заменителями гистонов, есть в спермиях. Отличаются резко увеличенным содержанием аргинина (до 80%). Функция – структурная. КоллагенФибриллярный белок с уникальной структурой. Обычно содержит моносаха- ридные (галактоза) и дисахаридные (галактоза-глюкоза) остатки, соединенные с ОН- группами некоторых остатков гидроксилизина. Составляет основу межклеточного вещества соединительной ткани сухожилий, кости, хряща, кожи, но имеется, конеч- но, и в других тканях. Полипептидная цепь коллагена включает 1000 аминокислот и состоит из повторяющегося триплета [Гли-А-В], где А и В – любые, кроме глицина аминокислоты. В основном это аланин, его доля составляет 11%, доля пролина и гидроксипролина – 21%. Таким образом, на оставшиеся аминокислоты приходится всего 33%. ЭластинВ общих чертах схож с коллагеном. Находится в связках, эластичном слое сосудов. Структурной едини- цей является тропоэластин с ММ=72000 и длиной 800 аминокислотных остатков. В нем гораздо больше лизи- на, валина, аланина и меньше гидроксипролина. Отсут- ствие пролина обуславливает наличие спиральных эластичных участков. Характерной особенностью эластина является наличие своеобразной структуры – десмозина, который объединяет белковые цепи в системы, способные растягиваться во всех направлениях. С ЛОЖ Н ЫЕ БЕЛКИ У белков, кроме белковой цепи, может иметься и дополнительная небелко- вая группа. Она называется лиганд, то есть молекула, связанная с белком. В качестве лиганда может выступать все, что угодно: молекулы выполняющие в белке структурную функцию – липиды, углеводы, нуклеиновые кислоты, минеральные элементы, какие-либо другие органиче- ские соединения: гем в гемоглобине, углеводы в гликопротеинах, ДНК и РНК в нуклеопротеинах, медь в церулоплазмине; переносимые белками молекулы: железо в трансферрине, гемоглобин в гап- тоглобине, гем в гемопексине; субстраты для ферментов – любые молекулы и даже другие белки. Узнавание лиганда обеспечивается: комплементарностью структуры центра связывания белка структуре лиган- да, проще говоря, пространственным и химическим соответствием белка и лиганда – как ключ и замок, которые, не являясь одинаковыми, прекрасно подходят друг к другу. Например, соответствие фермента и субстрата; иногда узнавание может зависеть от реакционной способности атома, к которому присоединяется лиганд: связывание кислорода железом гемоглоби- на. В случае, если лиганд несет структурную и/или функциональную нагрузку, он называется простетической группой, а белок – сложным. Фосфопротеины Это белки, в которых присутствует фос- фатная группа, она связывается с пептидной цепью через остатки тирозина, серина, треони- на (т.е. тех аминокислот, которые содержат ОН-группу). Фосфорная кислота может выполнять: Структурную роль, например, казеин, овоальбумин. Функциональную роль. В клетке присут- ствует много белков, которые связаны с фосфатом не постоянно, а в зависимости от активности метаболизма. Белок может многократно переходить в фосфорилиро- ванную или в дефосфорилированную форму. Фосфатные группы играют регу- лирующую роль в работе ферментов. Например, 1) гликогенсинтаза и гликогенфосфорилаза, 2) гистоны в фосфорилированном состоянии менее прочно связываются с ДНК и активность геномавозрастает. ЛипопротеиныК липопротеинам, строго говоря, принадлежат только белки, содержащие ковалентно связанные липиды. Однако, традиционно, к липопротеинам относят и надмолекулярные образования, выполняющие транспортную функцию и состоящие из множества молекул всех классов липидов и белков. Структуру липопротеинов можно сравнить с орехом, в них имеется скорлупа и ядро. Скорлупа является гидрофильной, ядро – гидрофобное. Ядро формируют непо- лярные эфиры холестерина и триацилглицерины. В поверхностном слое находятся фосфолипиды, холестерин, белки. Выделяют четыре класса липопротеиyов: хиломикроны (ХМ); липопротеины высокой плотности липопротеины низкой плотности липопротеины очень низкой плотности Белки в липопротеинах называются апобелками, их выделяют несколько видов: А, В, С, D. В каждом типе липопротеинов преобладают соответствующие ему апо- белки. ХромопротеиныСодержат окрашенные простетические группы. Сюда относят гемопротеины (содержат гем), ретинальпротеины (содержат витамин А), флавопротеины (содержат витамин В2), кобамидпротеины (содержат витамин В12) Гемопротеины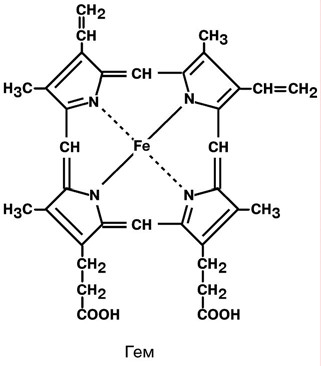 Подразделяются на неферментативные (гемо- глобин, миоглобин) и ферменты (цитохромы, ката- лаза, пероксидаза). Небелковой частью их является гем – структура, включающая в себя порфириновое кольцо (состоящее из 4 пиррольных колец) и иона Fe2+. Железо связывается с порфириновым кольцом двумя координационными и двумя ковалентными связями, одна ковалентная связь. Подразделяются на неферментативные (гемо- глобин, миоглобин) и ферменты (цитохромы, ката- лаза, пероксидаза). Небелковой частью их является гем – структура, включающая в себя порфириновое кольцо (состоящее из 4 пиррольных колец) и иона Fe2+. Железо связывается с порфириновым кольцом двумя координационными и двумя ковалентными связями, одна ковалентная связь.Цитохромы Разделяются на типы а, Ь, с, d. Кроме того, они отличаются аминокислотным составом пептидных цепей и числом цепей. Все они неспособны связы- вать кислород, кроме цитохрома аз, который содер- жит ионы меди. Цитохромы находятся в составе ды- хательной цепи митохондрий и цепи микросомаль- ного окисления. Разделяются на типы а, Ь, с, d. Кроме того, они отличаются аминокислотным составом пептидных цепей и числом цепей. Все они неспособны связы- вать кислород, кроме цитохрома аз, который содер- жит ионы меди. Цитохромы находятся в составе ды- хательной цепи митохондрий и цепи микросомаль- ного окисления.Флавопротеины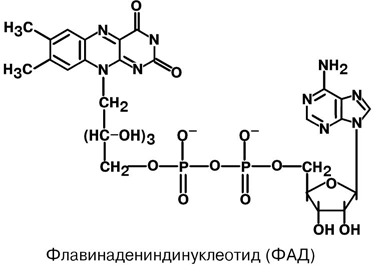 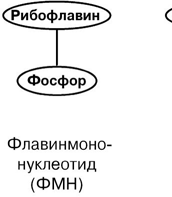 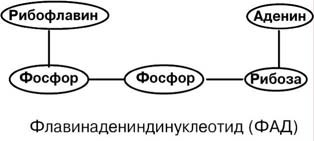 Являются ферментами окислительно-восстано- вительных реакций, содержат производные витамина В2 – флавинмононуклеотид (ФМН) и флавинадениндинуклеотид (ФАД). Являются ферментами окислительно-восстано- вительных реакций, содержат производные витамина В2 – флавинмононуклеотид (ФМН) и флавинадениндинуклеотид (ФАД).ГликопротеиныЭто белки, содержащие углеводный компонент, ковалентно присоединенный к полипептидной основе. Содержание углеводов варьирует от 1 до 85%. по массе. Сахаридный остаток: изменяет свойства белков защищает белок от протеолиза вне и внутри клетки придает биологическую активность влияет на проникновение через мембраны, внутриклеточную миграцию, сортировку и секрецию белков определяет межклеточное взаимо- действие Выделяют два подкласса белков, содержащих углеводы: протеогликаны и гликопротеины. Между эти подклассами имеются существенные отличия: ГликопротеиныДоля углеводов 15-20% Не содержат уроновых кислот Углеводные цепи содержат не более 15 звеньев Углевод имеет нерегулярное строение  ПротеогликаныДоля углеводов 80-85% Имеются уроновые кислоты Углеводные цепи крайне велики Углевод имеет регулярное строе- ние Функции гликопротеинов Структурная – клеточная стенка бактерий, костный матрикс. Защитная антитела, интерферон факторы свертывания крови – протромбин, фибриноген Транспорт веществ в крови и через мембраны – трансферрин, транкортин, аль- бумин, Na+,К+-АТФаза Гормональная – гонадотропин, адренокортикотропный гормон, тиреотропин. Ферментативная – холинэстераза, нуклеаза. Рецепторная – присоединение эффектора приводит к изменению конформации белка-рецептора, что вызывает внутриклеточный ответ. К гликопротеинам относятся тиреотропный и адренокортикотропный гормоны, трансферрин, коллаген, эластин, фибриноген, многие рецепторы являются гликопротеинами. Группы крови АВ0 определяются наличием в определенных молекулах N-ацетилгалактозамина (группа А), галактозы (группа В), или полным отсутствием производных этого сахара (группа 0). ПРОТЕОГЛИКАНЫ характеризуются наличием полисахаридов, состоящих из по- вторяющихся дисахаридных остатков. Дисахариды включают в себя уроновую кислоту и аминосахар. Дублируясь, ди- сахариды образуют олиго- и полисахаридные цепи – гликаны. Можно встретить раз- ные названия – кислые гетерополисахариды (имеют много кислотных групп), глико- заминогликаны (содержат аминогруппы), мукополисахариды. Эти молекулы вхо- дят в состав протеогликанов – сложных белков, функцией которых является запол- нение межклеточного пространства и удержание здесь воды, также они выступают как смазочный и структурный компонент суставов и других тканевых структур. Углеводная часть, аналогично с гликопротеинами, связывается с белком через остатки серина и аспарагина. Основными представителями гликозаминогликанов является гиалуроновая кислота, хондроитинсульфаты, кератансульфаты и дерматансульфаты, гепарин. Функции протеогликанов Протеогликаны особенно значимы для межклеточного пространства, осо- бенно соединительной ткани, в которое погружены коллагеновые волокна. При помощи электронной микроскопии выяс- нено, что они имеют древовидную структуру. Молекулы гликанов весьма гидро- фильны, создают сетчатую желеподоб- ную структуру и заполняют пространство между клетками, являясь преградой для крупных молекул и микроорганизмов. Нуклеопротеины Содержатся в рибосомах, хромосомах, вирусах. Небелковым компонентом является нуклеиновая ки- слота. В хромосомах нуклеиновая кислота представ- лена дезоксирибонуклеиновой кислотой (ДНК) и со- единяется с гистонами, формируя хроматин. В рибо- сомах рибонуклеиновая кислота (РНК) связывается со специфическими рибосомальными белками. В вирусах нуклеиновая кислота обеспечивает воспроизведение вируса в поражаемой клетке, а белковая часть позволяет взаимодействовать с мембраной клетки-хозяина, сохранять вирусную ДНК или РНК, осуществлять некоторые специфические ферментативные реакции. Нуклеиновые кислоты являются полимерными молекулами и состоят из мономеров, называемых нуклеотидами. Нуклеотид содержит фосфорную кислоту (один, два или три остатка), сахар (рибозу или дезоксирибозу), азотистое основание (аденин, гуанин, цито- зин, урацил либо тимин). Связываясь через фосфатные остатки, нуклеотиды образуют длинные цепочки нуклеиновые кислоты. Сахарофосфатный остов в ДНК и РНК заряжен отрицательно благодаря заряду фосфатных групп. В то же время пуриновые и пиримидиновые основания гидрофобны. Цепи ДНК и РНК обладают направленностью, т.е. имеют З'-конец и 5'-конец. В ДНК цепи антипараллельны, т.е. направлены в разные стороны и комплементарны (соответствие А=Т, Г=Ц) ФИЗИКО - ХИМИЧЕСКИЕ СВОЙСТВА БЕЛКОВК свойствам белков относят амфотерность, растворимость, способность к денатурации, коллоидные свойства. А МФОТЕРНОСТЬ Белки содержат кислые (СООН) и основные (NH2) группы. Благодаря этому они обладают буферными свойствами. Однако при физиологических рН их буферная емкость ограничена. Только гемоглобин, который содержит до 8% гистидина обладает существенной буферной емкостью, т.к. рI гистидина 7,6. Амфотерность позволяет разделить белки по заряду. Аналогично аминокислотам, они заряжаются положительно при уменьшении рН, и отрицательно при его увеличении. При нейтральных рН заряд белка зависит от соотношения кислых и основных аминокислот. Если преобладают кислые – то и заряд отрицательный, если основные – положительный, при рI заряд равен 0. Р АС ТВ ОРИ М ОС Т Ь Так как белки несут много заряженных групп, то они водорастворимы. Растворимость связана: со взаимоотталкиванием молекул с гидратацией белков – чем больше полярных аминокислот, тем больше гидратная оболочка (на 100 г белка может быть 30-50 г воды) Таким образом, растворимость белков зависит от заряда и наличия гидратной оболочки. Исчезновение одного или обоих этих факторов ведет к осаждению бел-ков. Методы осаждения белковВысаливание — добавление солевых растворов (Na2SO4, (NH4)2SO4). Анионы и катионы соли взаимодействуют с зарядами белка и, в результате, за ряд исчезает, и соответственно, исчезает взаимоотталкивание молекул. Одновременно пропадает гидратная оболочка. Это ведет к «слипанию» молекул и осаждению. Так как белки плазмы крови отличаются по размерам, заряду, строению, то можно подобрать такие количества соли, которые вызовут осаждение менее устойчивых белков, пока другие еще будут растворены. Однако, не следует забывать, что при низких концентрациях соли способны взаимодействовать с ионными группами белков, отвечающих за внутримолекулярные взаимодействия, приводить к их раскрытию и повышать растворимость. Осаждение водоотнимающими средствами (ацетон, этанол) При этом происходит лишение белка гидратной оболочки, но не заряда, растворимость несколько снижается, но денатурации не наступает Изменение рН ведет к исчезновению заряда в изоэлектрической точке, исчезновению гидратной оболочки и снижению растворимости белков. Д ЕНА Т УР АЦИЯ Это разрыв связей, стабилизирующих четвертичную, третичную, вторичную структуры. Физическая: повышение температуры, ультрафиолетовое и микроволновое излучение, механические воздействия, ионизация заряженными частицами. Химическая:Кислоты и щелочи образуют водородные связи с пептидными группами Органические растворители образуют водородные связи и вызывают дегидратацию Алкалоиды и тяжелые металлы образуют связи с полярными группами и разрывают систему водородных и ионных связей. К ОЛЛО ИДНЫЕ СВОЙСТВА : Рассеивание луча света, проходящего через белковый раствор – эффект Тиндаля (светящийся конус) Малая скорость диффузии Неспособность проникать через полунепроницаемые мембраны Например, работа искусственной почки, диализ. Создание онкотического давления, то есть перемещение воды в сторону более высокой концентрации белка. Например, формирование отеков. Высокая вязкость – силы сцепления между молекулами. Например, образование гелей и студней. Биуретовая реакция на пептидные связиПринцип реакции: аминокислоты, способные образовывать не менее двух пептидных связей (—СО—NH—), в щелочном растворе в присутствии сульфата меди (II) образуют комплексы с атомами меди, окрашенные в фиолетовый цвет. Впервые реакция образования таких комплексных соединений меди была проведена для биурета, поэтому она и названа биуретовой. Биурет, который может быть получен при нагревании мочевины до температуры180 °С, не является аминокислотой, но имеет две пептидные связи: В щелочной среде биурет претерпевает енолизацию по схеме: Две молекулы енольной формы биурета взаимодействуют с гидроксидом меди (II) и образуют комплекс, в котором координационные связи образованы за счёт электронных пар атомов азота иминных групп. Гидроксид меди (II) для проведения биуретовой реакции получают, как правило, в результате реакции взаимодействия сульфата меди (II) с гидроксидом натрия (или калия): Образование комплекса биурета с медью происходит по следующей схеме: 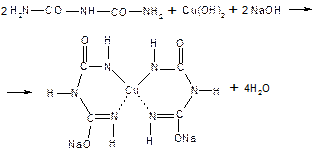 Подобный комплекс с медью могут создавать некоторые аминокислоты, у которых пептидные связи возникают за счёт карбоксильной и аминогрупп. Примером такой аминокислоты может быть аспарагин. Материалы и реактивы: водный 0,01%-ный раствор аспарагина, 10%-ный раствор гидроксида натрия (или калия), 10%-ный раствор сульфата меди. Оборудование: стеклянные палочки, штатив с пробирками, пипетки, капельница. Порядок выполнения работы:в пробирке к 3 см3 раствора аспарагина (исследуемого вещества) добавляют 1 см3 раствора гидроксида натрия (или калия), 1…2 капли раствора сульфата меди и перемешивают. Содержимое пробирки окрашивается в сине-фиолетовый цвет. Гидролиз белкаКислотный гидролизСуть данного процесса в обработке исходного сырья определенными кислотами. Белок обрабатывают соляной кислотой и нагревают примерно до 105-110 °С. В таком состоянии его выдерживают в течение суток. В результате молекулярные связи рвутся и белки распадаются на отдельные аминокислоты. Кислотный гидролиз наиболее простой и дешевый в осуществлении. Однако он предъявляет крайне высокие требования к соблюдению технологии и главное - качеству и точности дозировок реагентов. Используя не те кислоты или неправильные дозировки вместе с молекулярными связями можно разрушить и сами аминокислоты. Как следствие, конечный продукт будет иметь неполный аминокислотный спектр. А остатки солей и кислот вряд ли положительно скажутся на пищеварении. Энзимный (ферментативный) гидролиз белкаЭнзимный гидролиз белков в чем-то повторяет естественный процесс пищеварения. Исходное сырье (как правило - казеин) смешивают с ферментами, которые осуществляют «пищеварение» белка и обеспечивают его распад до аминокислот. И именно этот метод чаще всего используют в спортивной индустрии. Энзимный (ферментативный) гидролиз белков менее требователен к соблюдению технологий. Излишки ферментов удалить проще и они не несут такого вреда как кислоты. На первом этапе ферментного гидролиза сырье подвергают легкой температурной обработке. В итоге белок частично денатурирует (разрушается). После чего полученную фракцию смешивают с ферментами, которые завершают процесс гидролиза. Гидролиз белков осуществляют протеолитические ферменты. Большое разнообразие протеолитических ферментов связано со специфичностью их воздействия на белок. Место приложения или действия протеолитического фермента связано со структурой радикалов, находящихся рядом с пептидной связью. Пепсин расщепляет связь между фенилаланином и тирозином, глутаминовой кислотой и цистином (метионином, глицином), между валином и лейцином. Трипсинрасщепляет связь между аргинином (лизином) и другими аминокислотами. Химотрипсин - между ароматическими аминокислотами (триптофан, тирозин, фенилаланин) и метионином. Аминопептидазы действуют со стороны N - концевой аминокислоты, карбоксипептидазысо стороны С - концевой аминокислоты. Эндопептидазы разрушают белок внутри молекулы, экзопептидазы - действуют с конца молекулы. Для полного гидролиза белковой молекулы необходим набор большого количества различных протеолитических ферментов. Щелочной гидролиз белкаПри щелочном гидролизе происходит рацемизация большинства аминокислот и полное разрушение аргинина, лизина, цистина и цистеина. В результате такого гидролиза образуется комплекс дефектных, чуждых организму компонентов. Щелочной и кислотный гидролиз например белков проводят с целью установления аминокислотного состава того или иного белка. Просто при кислотном гидролизе разрушается важнейшая аминокислота - триптофан, а при щелочном она сохраняется но разваливаются другие. Вот сочетая два вида гидролиза можно сделать полный аминокислотный анализ. А насчет применения гидролиза в органике, то чаще это связано с получением тех или иных соединений, активные группы которых защищают для того, чтобы на этапе синтеза они не вступали в ненужные реакции. А затем путем гидролиза блокировку групп снимают. Очень часто гидролиз применяют в пептидном синтезе. Например, щелочным гидролизом (омылением) кокосового жира получают основу для производства мыла. Триглицериды кокосового жира при этом распадаются на натриевые (калиевые) соли жирных кислот и глицерин. 6. Семейство сериновых протеазК семейству родственных белков относят сериновые протеазы. Это семейство ферментов, которые используют уникально активированный остаток серина, расположенный в активном центре, для связывания и каталитического гидролиза пептидных связей в белковых субстратах. Мишени для сериновых протеаз - специфические пептидные связи в белках (часто в других сериновых протеазах). Для всех белков этого семейства характерно наличие в активном центре остатков Сер195, Гис57, Асп102 (эту нумерацию используют независимо от их точного расположения в первичной структуре определённых сериновых протеаз). Выявлена также высокая схожесть их пространственных структур, несмотря на то, что только в 40% положений они содержат идентичные аминокислоты (рис. 1-44). Каталитический участок сериновых протеаз расположен в расщелине между двумя доменами. Некоторые аминокислотные замены привели к изменению субстратной специфичности этих белков и к возникновению функционального многообразия внутри этого семейства. Так, пищеварительные сериновые протеазы участвуют в переваривании (гидролитическом расщеплении пептидных связей) денатурированных пищевых белков. К ним относят трипсин, химотрипсин, эластазу, но каждый из этих ферментов предпочитает разрывать пептидные связи, образованные определёнными аминокислотами. Ещё большей субстратной специфичностью обладают сериновые протеазы, участвующие в тщательно контролируемых физиологических процессах, таких как активация каскада белков свёртывания крови, фибринолиза, активация белков системы комплемента, образования белковых гормонов. В процессе активации нативных белков сериновые протеазы гидролизуют одну или две особенные пептидные связи из сотен связей, имеющихся в белковом субстрате. Это связано с тем, что в нативном белке фермент узнаёт не только аминокислоты, непосредственно формирующие пептидную связь, но и некоторые аминокислотные остатки, окружающие связь, подвергающуюся ферментативному гидролизу. Суперсемейство иммуноглобулинов+В работе иммунной системы огромную роль играют белки, относящиеся к суперсемейству иммуноглобулинов. Это суперсемейство включает по крайней мере три больших семейства белков, участвующих в иммунной защите организма: семейство иммуноглобулинов, семейство Т-клеточных антигенраспознающих рецепторов и белки главного комплекса гистосовместимости I и II классов, которые в литературе обозначают МНС . Это суперсемейство включено также семейство адгезивных белков, участвующих в узнавании определённых типов клеток и их межклеточных взаимодействиях. Основной критерий включения белков в суперсемейство иммуноглобулинов - их доменная организация, достоверная гомология аминокислотных последовательностей и пространственных структур отдельных доменов. Кроме того, белки этого суперсемейства имеют схожие функции: иммуноглобулины взаимодействуют с чужеродными структурами, находящимися в крови, лимфе, межклеточной жидкости или секретах желёз, а рецепторы Т-лимфоцитов и белки главного комплекса гистосовместимости - с антигенами, находящимися на поверхности клеток данного организма. |
