202 Шелухин Н.. Контрольная работа 1 2 курс до вариант Ш,Щ. Студент 202 группы Факультета ловс заочного обучения
 Скачать 47.57 Kb. Скачать 47.57 Kb.
|
|
Федеральное государственное образовательное учреждение высшего профессионального образования «Национальный государственный Университет физической культуры, спорта и здоровья имени П.Ф.Лесгафта, Санкт-Петербург» Кафедра Биохимии КОНТРОЛЬНАЯ РАБОТА № 1 2 курс ДО Вариант Ш,Щ. ВЫПОЛНИЛ: Студент 202 группы Факультета ЛОВС заочного обучения Шелухин Никита Александрович Проверил : Дорофейков В.В Санкт-Петербург 2020 Задания контрольной работы: 1.Охарактеризовать амфотерность белков. Использование значения изоэлектрической точки белка для оценки его строения и свойств. 2.Дать характеристику строению ферментов. Описать активный и аллостерический центры. 3. Описать распад гликогена в печени до глюкозы и указать гормоны, ускоряющие этот процесс. 4. Составить схему образования и использования АТФ 5.Описать строение и биологическую роль гормонов мозгового слоя надпочечников. 1. Амфотерность белков заключается в наличии у молекул кислотных и основных свойств. Это обусловлено присутствием в их молекулах свободных карбоксильных групп (кислотные группы) и аминогрупп (основные группы). Эти группы входят в состав радикалов аминокислот и не участвуют в образовании пептидных связей. Проявление белками кислотных или основных свойств зависит от кислотности среды. В кислой среде вследствие избытка ионов водорода (протонов) диссоциация карбоксильных групп подавлена. Свободные аминогруппы легко присоединяют к себе имеющиеся в избытке протоны и переходят в протонированную форму:  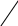 СООН СООН СООН СООН СООН СООН СООН СООН   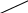 Белок Белок +  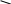 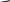 NH2 + H+ NH3 NH2 + H+ NH3    NH3+ COOH NH3+ COOH NH2 Следуя из вышеуказанной схемы, можно сделать вывод, что белки в кислой среде проявляют основные (щелочные) свойстваи находятся в катионной форме(молекулы заряжены положительно). щелочной среде (рН 7) преобладают ионы гидроксила, ионов водорода мало. В этих условиях легко протекает диссоциация карбоксильных групп, протонирование аминогрупп практически не происходит:
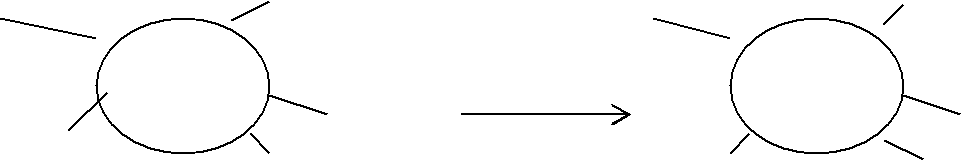 Поэтому в щелочной среде белки обладают кислотными свойствами и находятся в анионной форме ( молекулы заряжены отрицательно). Значение рН, при котором молекулы белка нейтральны, называется изоэлектрической точкойбелка и обозначаетсярIилирНиэт.Значение рI зависит от соотношения в молекуле белка между аминокислотами, содержащими в радикале карбоксильную группу,и аминокислотами,содержащими в радикале аминогруппу. Если в белке преобладают аминокислоты с дополнительной карбоксильной группой, то значение изоэлектрической точки находится в кислой среде (рI<7). Если аминокислоты преобладают со свободными аминогруппами, изоэлектрическая точка имеет величину больше 7, то есть находится в щелочной среде. Следовательно при повышении или понижении кислотности изменяется заряд молекул, что влияет на свойствах белка. 2. Ферменты- это особые белки, которые выполняют функцию катализаторов в химических реакциях. По химической природе являются белками и подразделяются на простые и сложные. Простые ферменты состоят только из аминокислот. Сложные ферменты имеют в своем составе белковую часть, состоящую из аминокислот (апофермент), и небелковую часть (кофактор). Участок молекулы фермента, на котором проходит катализ, называется активным центром. Активный центр образуется на уровне третичной структуры белка-фермента. У ферментов сложных белков в состав активного центра часто входит их простетическая группа. В активном центре выделяют два участка – адсорбционный и каталитический. Аллостерический центр – центр регуляции активности фермента, который отделен от активного центра и имеется не у всех ферментов. Связывание с аллостерическим центром какой-либо молекулы вызывает изменение пространственной конфигурации белка-фермента (активного центра) и скорости ферментативной реакции. Аллостерические ферменты являются белками с четвертичной структурой. 3. Распад гликогена до глюкозы в печени обозначается термином глюкогенезом. Этот процесс проходит с участием фосфорной кислоты и называется фосфоролизом. Под действием фосфорной кислоты от наружных цепей гликогена отщепляются остатки глюкозы, но полностью гликоген не расщепляется. Фосфоролиз гликогена протекает по следующему уравнению:  (С6Н10О5)n + m Н3РО4 (С6Н10О5)n-m + m Гл-1-ф (С6Н10О5)n + m Н3РО4 (С6Н10О5)n-m + m Гл-1-фПоследующее превращение глюкозо-1-фосфата в свободную глюкозу осуществляется в две стадии. На первой стадии глюкозо-1-фосфат переходит в глюкозо-6-фосфат; на второй стадии происходит гидролиз глюкозо-6-фосфата и образуется свободная глюкоза и фосфорная кислота:   Гл-1-ф Гл-6-ф Глюкоза + Н3РО4 Гл-1-ф Гл-6-ф Глюкоза + Н3РО4Распад гликогена в печени до глюкозы ускоряется гормонами глюкагоном и адреналином. 4. Тканевое дыхание - это основной способ получения АТФ, используемый всеми клетками организма. В процессе тканевого дыхания от окисляемого вещества отнимаются два атома водорода и по дыхательной цепи, состоящей из ферментов и коферментов, передаются на молекулярный кислород, доставляемый кровью из воздуха во все ткани организма. В результате присоединения атомов водорода к кислороду образуется вода. За счет энергии, выделяющейся при движении электронов по дыхательной цепи, в митохондриях осуществляется синтез АТФ из АДФ и фосфорной кислоты. В упрощенном виде тканевое дыхание может быть представлено следующими уравнениями:  AH2+0,5O2 A+ H2o AH2+0,5O2 A+ H2o 3 АДФ + 3 H3PO4 3 АТФ 3 АДФ + 3 H3PO4 3 АТФ В качестве субстратов окисления в тканевом дыхании используются разнообразные промежуточные продукты распада белков, углеводов и жиров. Наиболее часто окислению подвергаются промежуточные продукты цикла трикарбоновых кислот. Цикл Кребса - это завершающий этап катаболизма, в ходе которого происходит окисление остатка уксусной кислоты, входящей в ацетилкофермент А, до СО2 и Н2О. 5. В мозговом слое надпочечников образуется катехоламины (главный гормон адреналин). Ускоряют распад гликогена в печени и в мышцах, вызывают мобилизацию жира, повышают частоту дыхания и сердечных сокращений. |
