1. Синтез кетоновых тел Кетоновые тела это способ транспорта ацетильной группы
 Скачать 1.04 Mb. Скачать 1.04 Mb.
|
|
1. Синтез кетоновых тел Кетоновые тела - это способ транспорта ацетильной группы При состояниях, сопровождающихся снижением глюкозы крови, клетки органов и тканей испытывают энергетический голод. Так как окисление жирных кислот процесс "трудоемкий", анервная ткань вообще неспособна окислять жирные кислоты, то печень облегчает использование этих кислот тканями, заранее окисляя их до уксусной кислоты и переводя последнюю в транспортную форму – кетоновые тела. К кетоновым телам относят три соединения близкой структуры – ацетоацетат, 3-гидроксибутират и ацетон. 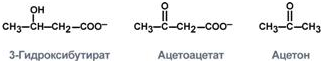 Строение кетоновых тел Стимулом для образования кетоновых тел служит поступление большого количества жирных кислот в печень. Как уже указывалось, при состояниях, активирующих липолиз в жировой ткани, не менее 30% образованных жирных кислот задерживаются печенью. К таким состояниям относится голодание, сахарный диабет I типа, длительные физические нагрузки. Так как синтез ТАГ в этих условиях невозможен, то жирные кислоты из цитозоля попадают в митохондрии и окисляются с образованием кетонов. Кроме отмеченных ситуаций, количество кетоновых тел в крови возрастает при алкогольном отравлении и потреблении жирной пищи. При богатой жирами диете, особенно у детей, жирные кислоты не успевают включиться в состав ТАГ и ЛПОНП и частично переходят в митохондрии, что увеличивает синтез кетоновых тел. При алкогольном отравлении субстратом для синтеза кетонов является ацетил-SКоА, синтезируемый при обезвреживании этанола. В обычных условиях синтез кетоновых тел также идет, хотя в гораздо меньшем количестве. Для этого используются как жирные кислоты, так и безазотистые остатки кетогенных и смешанных аминокислот. Синтез кетоновых тел (кетогенез) Синтез ацетоацетата происходит только в митохондриях печени, далее он либо восстанавливается до 3-гидроксибутирата, либо спонтанно декарбоксилируется до ацетона. Далее все три соединения поступают в кровь и разносятся по тканям. Ацетон, как летучее вещество, легко удаляется с выдыхаемым воздухом и потом. Все кетоновые тела могут выделяться с мочой. 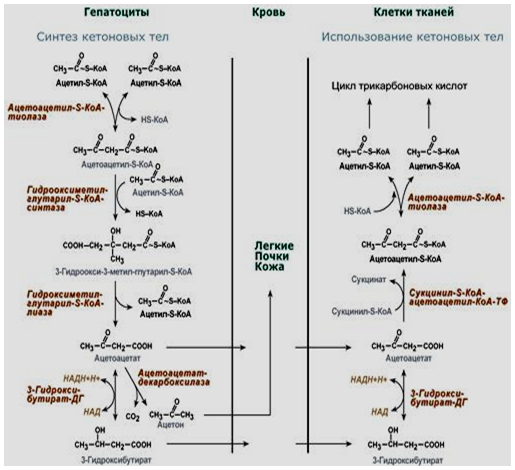 Реакции синтеза и утилизации кетоновых тел Используются кетоновые тела клетками всех тканей, кроме печени и эритроцитов. Особенно активно, даже в норме, они потребляются миокардом и корковым слоем надпочечников. Реакции утилизации кетоновых тел примерно совпадают с обратным направлением реакций синтеза. В цитозоле 3-гидроксибутират окисляется, образующийся ацетоацетат проникает в митохондрии, активируется за счет сукцинил-SКоА и превращается в ацетил-SКоА, который сгорает в ЦТК. 2. Синтез холестеринаСинтез холестерола в организме составляет примерно 0,5-0,8 г/сут, примерно 50% образуется в печени, около 15% в кишечнике. Все клетки организма способны синтезировать холестерол. Поступление с пищей составляет около 0,4 г/сут. Единственным реальным способом выведения холестерола является желчь – до 1 г/сут. Биосинтез холестеролаБиосинтез холестерола происходит в эндоплазматическом ретикулуме. Источником всех атомов углерода в молекуле является ацетил-SКоА, поступающий сюда из митохондрий в составе цитрата, также как при синтезе жирных кислот. При биосинтезе холестерола затрачивается 18 молекул АТФ и 13 молекул НАДФН. Образование холестерола идет более чем в 30 реакциях, которые можно сгруппировать в несколько этапов. 1. Синтез мевалоновой кислоты. Первые две реакции синтеза совпадают с реакциями кетогенеза, но после синтеза 3-гидрокси-3-метилглутарил-SКоА вступает в действие фермент гидроксиметил-глутарил-SКоА-редуктаза(ГМГ-SКоА-редуктаза), образующая мевалоновую кислоту.  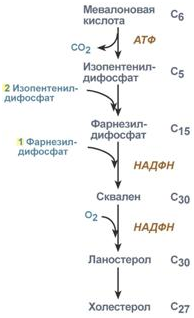 2. Синтез изопентенилдифосфата. На этом этапе три остатка фосфат присоединяются к мевалоновой кислоте, затем она декарбоксилируется и дегидрируется. 3. После объединения трех молекул изопентенилдифосфата синтезируетсяфарнезилдифосфат. 4. Синтез сквалена происходит при связывания двух остатков фарнезилдифосфата. 5. После сложных реакций линейный сквален циклизуется в ланостерол. 6. Удаление лишних метильных групп, восстановление и изомеризация молекулы приводит к появлению холестерола. Регуляция синтезаРегуляторным ферментом является гидроксиметилглутарил-SКоА-редуктаза, активность которой может изменяться в 100 и более раз. 1. Метаболическая регуляция– по принципу обратной отрицательной связи ферменталлостерически ингибируется конечным продуктом реакции – холестеролом. Это помогает поддерживать внутриклеточное содержание холестерола постоянным. 2.Ковалентная модификация при гормональной регуляции: · Инсулин, активируя протеин-фосфатазу, способствует переходу фермента в активное состояние. Важным следствием такой регуляции является активация кетогенеза при отсутствии инсулина. · Глюкагони адреналинпосредством аденилатциклазного механизма активируют протеинкиназу А, которая фосфорилирует фермент и переводит его в неактивную форму. АтеросклерозАтеросклероз– это отложение холестерина и его эфиров в соединительной ткани стенок артерий, в которых выражена механическая нагрузка на стенку (по убыванию воздействия): абдоминальная аорта, коронарная артерия, подколенная артерия, бедренная артерия, тибиальная артерия, грудная аорта, дуга грудной аорты, сонные артерии. Основы леченияВ лечении атеросклероза обязательно должны быть две составляющие: диета и медикаменты. Целью лечения является снижение концентрации общего ХС плазмы, ХС ЛПНП и ЛПОНП, повышение концентрации ЛПВП. Диета1. Обеспечение организма витаминами: аскорбиновой кислотой, пантотеновой (коэнзим А) и никотиновой (НАДФ) кислотами, что способствует превращению холестерола печени в желчные кислоты (см синтез желчных кислот). Для снижения окислительной модификации ЛПНП необходим витамин Е. 2. Снижение калорийности пищи за счет углеводов и жиров. Жиры пищи должны включать равные доли насыщенных, мононенасыщенных и полиненасыщенных жиров. Доля жидких жиров, содержащих полиненасыщенные жирные кислоты (ПНЖК), должна быть около30% от всех жиров, но не меньше 15 г/сут. Роль ПНЖК в лечении гиперхолестеролемии и атеросклероза сводится к: · ограничению всасывания ХС в тонком кишечнике, · активации синтеза фосфатидилхолина, что снижает вязкость желчи и облегчает ее отток в кишечник, · усилению желчеотделения, · снижению синтеза ЛПНП в печени и секреции их в кровь, · увеличению синтеза ЛПВП и концентрации их в крови, что способствует удалению холестерина из тканей в печень. 3. Обеспечение организма чистой водой до физиологических норм (1,0-1.5 л/сут), что препятствует сгущению желчи. 4. Потребление высоких количеств овощей, содержащих целлюлозу (капуста, морковь, свекла) для усиления перистальтики кишечника, стимуляции желчеотделения и снижения всасывания ХС. 5. Умеренная физическая нагрузка – способствует синтезу ЛПВП и, значит, оттоку холестерина от тканей в печень. Медикаменты1. Препараты ω6 и ω3 жирных кислот (Линетол, Эссенциале, Омеганол и т.п.) повышают концентрацию ЛПВП в плазме, ускоряют отток ЛПНП в печень, стимулируют желчеотделение. 2. Подавление всасывания ХС в желудочно-кишечном тракте – анионообменные смолы(Холестирамин, Холестид, Questran). 3. Препараты никотиновой кислоты подавляют мобилизацию жирных кислот из депо и снижают синтез ЛПОНП в печени, а, следовательно, и образование из них ЛПНП в крови. 4. Фибраты (клофибрат и т.п.) увеличивают активность липопротеинлипазы, ускоряют катаболизм ЛПОНП и хиломикронов, что повышает переход холестерола из них в ЛПВП и его эвакуацию в печень. 5. Статины (ловастатин, флувастатин) ингибируют ГМГ-S‑КоА-редуктазу, что снижает в 2 раза синтез ХС в печени и ускоряют его отток из ЛПВП в гепатоциты. 5. Подавление функции энтероцитовс помощью антибиотика неомицина, что снижает всасывание жиров. 6. Хирургическое удаление подвздошной кишки и прекращение реабсорбции желчных кислот. 3. Синтез жирных кислотРеакции биосинтеза липидов могут идти в гладкой эндоплазматической сети клеток всех органов. Субстратом для синтеза жиров de novo является глюкоза. Как известно, попадая в клетку, глюкоза превращается в гликоген, пентозы и окисляется до пировиноградной кислоты. При высоком поступлении глюкоза используется для синтеза гликогена, но этот вариант ограничивается объемом клетки. Поэтому глюкоза "проваливается" в гликолиз и превращается в пируват либо напрямую, либо через пентозофосфатный шунт. Во втором случае образуется НАДФН, который понадобится впоследствии для синтеза жирных кислот. Пируват переходит в митохондрии и декарбоксилируется в ацетил-SКоА и вступает в ЦТК. Однако в состоянии покоя, при отдыхе, при наличии избыточного количества энергиив клетке реакции ЦТК (в частности, изоцитратдегидрогеназная реакция) блокируются избытком АТФ и НАДН. В результате накапливается первый метаболит ЦТК – цитрат. По градиенту концентрации он перемещается в цитозоль, расщепляется с образованием ацетил-SКоА, который далее используется в биосинтезе холестерола, жирных кислот и триацилглицеролов. Оксалоацетат, также образуемый из цитрата, восстанавливается до яблочной кислоты и возвращается в митохондрии · посредством малат-аспартатного челнока (на рисунке), · после декарбоксилирования малата до пирувата НАДФ-зависимым малик-ферментом. Образованный НАДФН будет использован при синтезе жирных кислот. 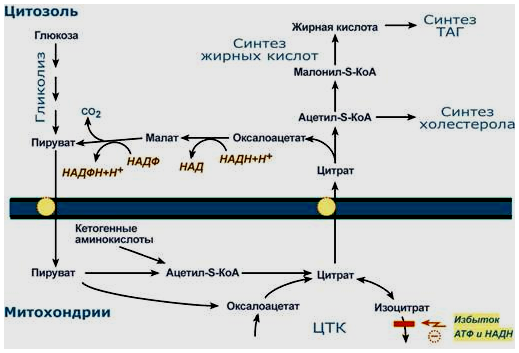 Гормональная регуляцияСинтез и окисление жирных кислот зависит от соотношения инсулин /глюкагон. 1. Изменение количества ферментовФерменты комплекса пальмитатсинтазы и ацетил-SКоА-карбоксилазы являются адаптивными ферментами, количество их возрастает при усиленном питании и уменьшается при голодании и потреблении жира. Индуктором биосинтеза этих ферментов является инсулин. 2. Ковалентная модификацияБлагодаря инсулину, глюкагону, адреналину, тиреотропному и адренокортикотропному гормонам происходит ковалентная модификация ферментов ацетил-SКоА-карбоксилазы путем фосфорилирования-дефосфорилирования. Регуляция активности ацетил-SКоА-карбоксилазыИнсулин активирует протеинфосфатазу и способствует дефосфорилированию и активации ацетил-SКоА-карбоксилазы. Одновременно в клетке дефосфорилируется и инактивируется ТАГ-липаза. Глюкагон, адреналинили другие гормоны, действуя по аденилатциклазному механизму с участием цАМФ-зависимой протеинкиназы, вызывают фосфорилирование и ингибированиеацетил-SКоА-карбоксилазы и, следовательно, останавливают липогенез. Одновременно они активируют ТАГ-липазу. При уменьшении количества инсулинаи возрастании глюкагонаусиливаются липолиз в жировой ткани, поступление жирных кислот в печень и другие ткани и реакции их β-окисления. Такое состояние наблюдается при гипогликемии любого происхождения. При обратном соотношении гормонов начинаются реакции синтеза жиров. Процесс синтеза жирных кислотБиосинтез жирных кислот наиболее активно происходит в цитозоле клеток печени, кишечника, жировой ткани в состоянии покояили после еды. Условно можно выделить 4 этапа биосинтеза: 1. Образование ацетил-SКоА из глюкозы, других моносахаров или кетогенных аминокислот. 2. Перенос ацетил-SКоА из митохондрий в цитозоль: · обычно в составе лимонной кислоты, образующейся в первой реакции ЦТК. Поступающий из митохондрий цитрат в цитозоле расщепляется АТФ-цитрат-лиазой до оксалоацетата и ацетил-SКоА. Оксалоацетат в дальнейшем восстанавливается до малата, и последний либо переходит в митохондрии (малат-аспартатный челнок), либо декарбоксилируется в пируват малик-ферментом ("яблочный" фермент). 3. Образование малонил-SКоА из ацетил-SКоА. Карбоксилирование ацетил-SКоА катализируется ацетил-SКоА-карбоксилазой, мульферментным комплексом из трех ферментов 4. Синтез пальмитиновой кислоты. Осуществляется мультиферментнымкомплексом "синтаза жирных кислот" (синоним пальмитатсинтаза) в состав которого входит 6 ферментов и ацил-переносящий белок (АПБ). 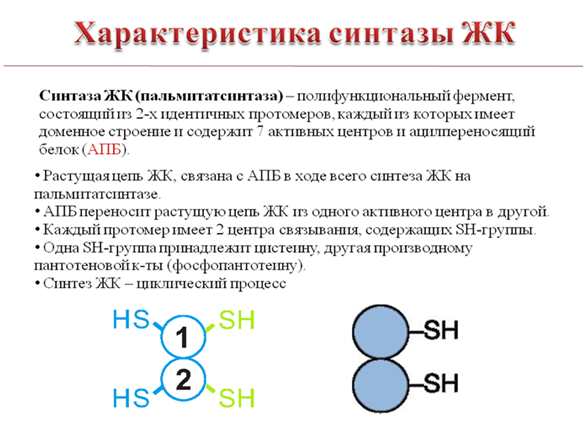 Ацил-переносящий белок включает производное пантотеновой кислоты – 6-фосфопантетеин(ФП), имеющий HS-группу, подобно HS-КоА. Один их ферментов комплекса, 3-кетоацил-синтаза, также имеет HS-группу в составе цистеина. Взаимодействие этих групп обусловливает начало и продолжение биосинтеза жирной кислоты, а именно пальмитиновой кислоты. Для реакций синтеза необходим НАДФН. В первых двух реакциях последовательно присоединяются малонил-SКоА к фосфопантетеину ацил-переносящего белка и ацетил-SКоА к цистеину 3-кетоацилсинтазы. 3-Кетоацилсинтаза катализирует третью реакцию – перенос ацетильной группы на С2 малонила с отщеплением карбоксильной группы. Далее кетогруппа в реакциях восстановления (3-кетоацил-редуктаза), дегидратации (дегидратаза) и опять восстановления (еноил-редуктаза) превращается в метиленовую с образованием насыщенного ацила, связанного с фосфопантетеином. Ацилтрансфераза переносит полученный ацил на цистеин 3-кетоацил-синтазы, к фосфопантетеину присоединяется малонил-SКоА и цикл повторяется 7 раз до образования остатка пальмитиновой кислоты. После этого пальмитиновая кислота отщепляется шестым ферментом комплекса тиоэстеразой.  Удлинение цепи жирных кислотСинтезированная пальмитиновая кислота при необходимости поступает в эндоплазматический ретикулум или в митохондрии. Здесь с участием малонил-S-КоА и НАДФН цепь удлиняется до С18 или С20. 4. Синтез триглицеридов и фосфолипидовСинтез ФЛ и ТАГКлетки большинства тканей, особенно печени и жировой ткани, обладают способностью накапливать ТАГ. Жировая ткань функционально специализируется на хранении и мобилизации ТАГ. Вслед за перевариванием пищи в плазме крови увеличивается концентрация глюкозы, инсулина, липопротеинов, богатых ТАГ. Стимулируется активность липопротеинлипазы для гидролиза ТАГ в составе липопротеинов, но снижается активность жиромобилизующей липазы в жировой ткани. Наряду с этим стимулируется образование ТАГ в жировой ткани. Натощак или при повышенной потребности в энергии во время физической работы, повышении уровня катехоламинов, гормона роста, АКТГ и глюкагона в плазме крови, снижении секреции инсулина эти процессы меняются на противоположные - увеличивается липолиз в жировой ткани и высвобождаются жирные кислоты. Они используются в качестве источника энергии. Глицерол используется для глюконеогенеза. Схема депонирования и расщепления нейтрального жира в адипоцитах: 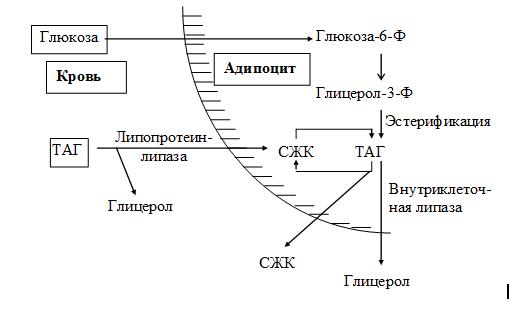 Предшественниками для синтеза ТАГ являются активная форма глицерола -глицерол-3-фосфат и активированные жирные кислоты – ацил-КоА. В печени глицерол-3-фосфат может образовываться или в результате фосфорилирования глицерола, или из глюкозы как промежуточный продукт гликолиза. В жировой ткани единственным источником образования глицерол-3-фосфата является гликолиз. Глицерол + АТФ ® Глицерол–3-фосфат + АДФ (глицеролкиназа) Диоксиацетонфосфат + НАДН+Н+ ® Глицерол-3-фосфат + НАД+ Следующим этапом биосинтеза ТАГ является последовательное взаимодействие глицерол-3-фосфата с 2 молекулами ацил-КоА, в результате которого образуется фосфатидная кислота. Реакцию катализирует глицерофосфат-ацилтрансфераза. Глицерол–3-фосфат + 2 ацил-КоА ® Фосфатидная кислота + 2 КоА 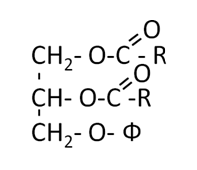 Фосфатидная кислота Фосфатидная кислотаДалее при участии фосфатидат фосфатазы происходит гидролиз фосфатидной кислоты с образованием 1,2-диацилглицерола (1,2-ДАГ): Фосфатидная кислота + Н2О ® 1,2-ДАГ+ Н3РО4 На заключительном этапе к 1,2-ДАГ присоединяется третья молекула ацил-КоА с образованием ТАГ. Реакцию катализирует диацилглицерол-ацилтрансфераза: 1,2-ДАГ + ацил-КоА ® ТАГ + КоА Синтез фосфоглицеридовБиосинтез фосфатидилэтаноламинов (кефалинов) Этаноламин + АТФ ® Фосфоэтаноламин + АДФ (этаноламинкиназа) Фосфоэтаноламин + ЦТФ® ЦДФ-этаноламин + пирофосфат ЦДФ-этаноламин + 1,2-ДАГ ® Фосфатидилэтаноламин (ФЭА) + ЦМФ Биосинтез фосфатидилхолинов (лецитинов) Первый путь ФЭА + 3 S-Аденозилметионин (последовательное присоединение) ® ® Фосфатидилхолин + 3 S-Аденозилгомоцистеин (метилтрансфераза) Второй путьХолин + АТФ ® Фосфохолин + АДФ (холинкиназа) Фосфохолин + ЦТФ® ЦДФ-холин + пирофосфат ЦДФ-холин + 1,2-ДАГ ® Фосфатидилхолин + ЦМФ Биосинтез фосфатидилсериновПервый путьФЭА + Серин ® Фосфатидилсерин + Этаноламин Второй путь Фосфатидная кислота + ЦТФ ® ЦДФ-диацилглицерол + пирофосфат ЦДФ-ДАГ + Серин ® Фосфатидилсерин + ЦМФ 5. Метаболизм липопротеиновМетаболизм липопротеинов очень низкой плотности (ЛПОНП), липопротеинов промежуточной плотности (ЛППП) и липопротеинов низкой плотности (ЛПНП) Основной функцией этих липопротеинов является транспорт жирных кислот в составе ТАГ из печени к периферическим тканям, особенно в жировую и мышечную. Для синтеза ЛПОНП в гепатоцитах требуется белок апо В-100 и липиды: эфиры холестерола (ЭХС), ТАГ и фосфолипиды (ФЛ). Триацилглицеролы для ЛПОНП синтезируются путем этерификации жирных кислот. Они поступают в гепатоциты из плазмы крови. Источниками жирных кислот являются жирные кислоты, образовавшиеся в результате гидролиза ТАГ жировой ткани, либо синтезированные в печени жирные кислоты. Образование ЛПОНП регулируется после трансляции за счет контроля синтеза апо В-100. Новосинтезированная частица ЛПОНП содержит одну молекулу белка - апо В-100. Другие белковые компоненты, апо С-II, апо С-III и апо Е, поступают на неё от ЛПВП после того, как ЛПОНП попадают в плазму крови. Они требуются для ускорения метаболизма ЛПОНП. Метаболизм ЛПОНП. На эндотелии сосудистой стенки ТАГ в составе ЛПОНП подвергаются действию фермента липопротеинлипазы (ЛПЛ). Необходимым кофактором для проявления активности ЛПЛ является апо С-II. ЛПЛ образуется в клетках многих тканей, среди которых наибольшее значение имеют жировая ткань, скелетная и сердечная мышцы, молочная железа во время лактации. ЛПЛ катализирует гидролиз ТАГ в составе ХМ и ЛПОНП до жирных кислот, моноацилглицеролов (МАГ), в результате ЛПОНП превращаются в кровотоке в ЛППП. Фермент проявляет низкую активность по отношению к МАГ и ФЛ. В жировой ткани синтез ЛПЛ стимулирует инсулин. Тем самым обеспечивается поступление жирных кислот в адипоциты для синтеза и хранения в виде ТАГ. В мышцах ЛПЛ позволяет использовать жирные кислоты для окисления в периоды между приемами пищи, а инсулин подавляет образование этого фермента. Липопротеины промежуточной плотности (ЛППП). Образование ЛППП происходит из ЛПОНП. Около 75 % ЛППП попадает в печень после связывания апо Е с рецепторами для ЛПНП или рецепторами для апо В/апо Е. В печени они полностью разрушаются. Около 25 % ЛППП в кровотоке подвергается действию другого липолитического фермента - печеночной липазы (ПЛ). Этот фермент катализирует дальнейшее расщепление ТАГ в составе ЛППП. В результате ЛППП превращаются в ЛПНП. Липопротеины низкой плотности (ЛПНП). ЛПНП удаляются из кровотока путем взаимодействия с рецепторами для ЛПНП (другое их название апо В/Е рецепторы). Доля этого процесса в удалении всех ЛПНП составляет 75 %. Остальная часть удаляется с помощью «мусорных» рецепторов (скэвенджер (scavenger)-рецепторов), имеющих низкую способность связывания. Этот путь получил образное название «путь уборки мусора». Поступление ЛПНП в клетки и их внутриклеточный катаболизм: 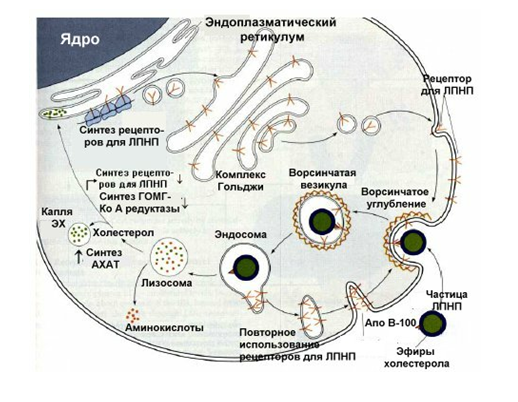 После связывания ЛПНП комплекс «рецептор—ЛПНП» переносится в клетку посредством эндоцитоза. Затем он сливается с лизосомами и разрушается. Внутриклеточное высвобождение холестерола, происходящее таким путем, вызывает следующие эффекты: а) снижает синтез ключевого фермента образования своего, клеточного, холестерола — ГОМГ-КоА редуктазы; б) снижает синтез рецепторов для ЛПНП; в) активирует ацил-холестеролацилтрансферазу (АХАТ), которая катализирует образование из метаболически активной формы неэтерифицированного холестерола его метаболически неактивную форму – эфир холестерола ЭХС. Схема реакции, катализируемой АХАТ: 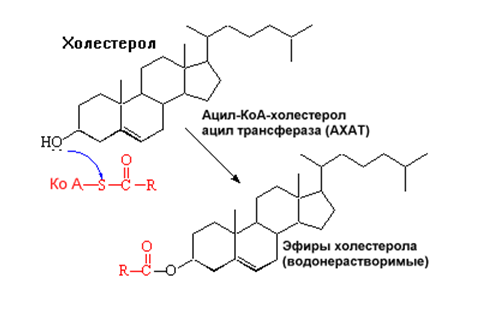 В отличие от регуляторного действия рецепторов к ЛПНП на обмен холестерола в клетках, скэвенджер-рецепторы продолжают транспортировать ХС в клетку без торможения по принципу обратной связи. Тем самым макрофаги превращаются в пенистые клетки. Их образование рассматривается как начальный этап атеросклероза. Метаболизм липопротеинов высокой плотности (ЛПВП). ЛПВП синтезируются в клетках печени и кишечника. Сразу после секреции ЛПВП имеют вид плоских дисков, содержащих ФЛ. Белковым компонентом их является апо-А. Из тканей и клеточных мембран на них поступает холестерол. Под действием фермента лецитин-холестерол ацилтрансферазы (ЛХАТ) из неэтерифицированного холестерола и жирной кислоты фосфатидилхолина образуются ЭХС. В результате частицы ЛПВП созревают, принимая форму глобулы. Затем ЭХС переносятся на ЛППП, ЛПНП, обломки ХМ с помощью липидтранспортирующего белка (ЛПБ) или апо D. Жировое перерождение печени Жировое перерождение печени – это накопление в гепатоцитах триацилглицеролов, которые не окисляются и не выводятся из печени. Причины: действие гепатотоксических ядов (алкоголь, четыреххлористый углерод и другие), хронические заболевания печени, опухоли печени, а также дефицит белков, холина в продуктах питания. При недостатке холина, аминокислот, особенно метионина, снижается синтез лецитинов, но повышается синтез ТАГ, так как у этих соединений есть общий предшественник в процессе синтеза – фосфатидная кислота. Кроме того, при белковом голодании в печени нарушается синтез ЛПОНП, необходимых для выведения синтезированных в ней ТАГ. Вещества, предупреждающие жировое перерождение печени, называются липотропными факторами. К ним относятся холин, метионин, серин. Кроме того, для предупреждения жирового перерождения печени очень важно наличие в продуктах питания витаминов-синтергистов – В12 и фолиевой кислоты, необходимых для реакций метилирования в синтезе холина и лецитинов. |
