|
Аффинная хроматография. Антитела, строение моноклональных антител
Оглавление
Введение 2
1. Антитела, строение моноклональных антител 4
2. IgG 1 антитело – функции и применение в биотехнологических препаратах 9
3. Хроматографическая очистка белка – аффинная хроматография 11
4. Описание аффинного сорбента MabSelect Sure 15
5. Изучение методики очистки рекомбинантных белков клеточной линии CHO – хроматография на аффинном сорбенте 16
Заключение 20
Список использованной литературы 22
Введение
Аффинная хроматография (AC) разделяет белки на основе обратимого взаимодействия между целевым белком и специфическим лигандом, прикрепленным к хроматографической базовой матрице.
Взаимодействие может быть биоспецифичным, например, антитела, связывающие белок А, или рецептор, связывающий гормон; или небиоспецифичным, например, белок, связывающий красящее вещество, или гистидинсодержащие белки, связывающие ионы металлов, как в иммобилизованной ионной аффинной хроматографии металлов.
В аффинной хроматографии (целевой белок специфически и обратимо связан комплементарным связующим веществом (лигандом). Образец наносят в условиях, благоприятствующих специфическому связыванию с лигандом. Несвязанный материал вымывается из колонки.
Связанный целевой белок восстанавливается путем изменения условий на те, которые благоприятствуют элюированию. Элюирование осуществляют специфически, с использованием конкурентного лиганда, или неспецифически, путем изменения, например, рН, ионной силы или полярности. Целевой белок элюируют в очищенном и концентрированном виде.
Благодаря своей высокой селективности, аффинная хроматография может использоваться для одностадийной очистки. Чаще всего, однако, AC используется в качестве первой стадии захвата, за которой следует одна или несколько стадий полировки для удаления оставшихся примесей.
Например, лиганды белка A или белка G, связанные с агарозной базовой матрицей, используются для рутинной очистки антител.
Сегодня большинство лабораторных очисток выполняются с помощью аффинно-меченых белков. Гистидин-меченые белки очищают с помощью IMAC, а глутатион-S-трансфераза (GST)-меченые белки очищают с помощью хроматографической смолы с иммобилизованным глутатионом.
Аффинная хроматография также используется для удаления специфических примесей.
Цель работы: Изучить особенности процесса хроматографической очистки белка посредством аффинной хроматографии.
Для достижения поставленной цели необходимо решить ряд задач:
1. Изучить антитела, строение моноклональных антител; IgG 1 антитело – функции и применение в биотехнологических препаратах.
2. Рассмотреть хроматографическую очистку белка – аффинная хроматография.
3. Изучить аффинный сорбент MabSelect Sure.
4. Изучить методики очистки рекомбинантных белков клеточной линии CHO. – хроматография на аффинном сорбенте.
1. Антитела, строение моноклональных антител
Моноклональные антитела широко распространены в биомедицинских исследованиях и медицине. Они используются для борьбы, диагностики и исследования заболеваний, а также для разработки и тестирования новых лекарств. Антитела делятся на 5 классов или изотипов, несколько подтипов и форм и могут генерироваться in vivo или in vitro.
Антитела (Abs) - это гликопротеины крови, принадлежащие к суперсемейству иммуноглобулинов и составляющие большую часть гамма-глобулиновой фракции белка крови. Тем не менее, они также могут быть найдены в других жидкостях организма. Они секретируются В-клетками или мембраной, связанной с В-клетками, через их Fc-область к рецептору В-клеток (BCR) в ответ на присутствие чужеродных организмов или антигена (бактерии, вирусы ...). Каждое антитело содержит вариабельную область Fab, содержащую на своем конце паратоп, специфичный для одного конкретного эпитопа на антигене. Когда эти 2 структуры связаны вместе, Ab может пометить чужеродный организм или инфицированные клетки для их прямой нейтрализации или позволить другим клеткам иммунной системы атаковать их. Производство Abs является основной функцией гуморальной иммунной системы.
Рис. 1. Антитела (Abs)
Существует 5 классов антител с различными функциями: IgG, IgM, IgA, IgE и IgD (см. рис. 2).
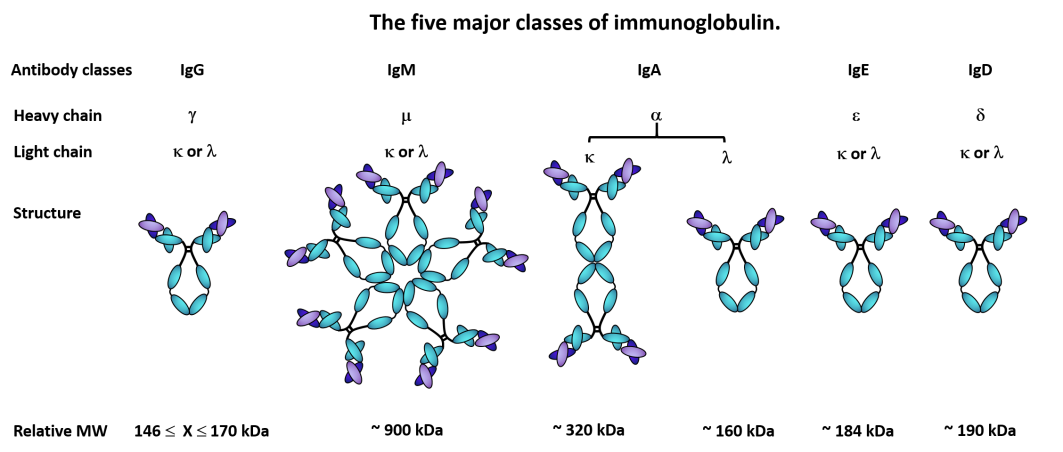
Рис. 2. Пять основных классов иммуноглобулинов
Антитела IgG являются наиболее распространенными и наиболее важными. Они циркулируют в крови и других жидкостях организма, защищаясь от вторжения бактерий и вирусов. Связывание антител IgG с бактериальными или вирусными антигенами активирует другие иммунные клетки, которые поглощают и разрушают антигены. Как самое маленькое из антител, IgG легко перемещается через клеточные мембраны.
Например, IgG соответствует 70-85% от общего пула иммуноглобулинов антител в нормальной сыворотке человека. IgG состоит из 4 подклассов человека (IgG1, IgG2, IgG3 и IgG4), каждый из которых содержит различную тяжелую цепь. Они очень гомологичны и отличаются в основном областью шарнира и степенью, в которой они активируют иммунную систему хозяина. IgG1 и IgG4 содержат две межцепочечные дисульфидные связи в области шарнира, IgG2 имеет 4, а IgG3 - 11. У мышей класс IgG делится на 5 подклассов (IgG1, IgG2a, IgG2b, IgG2C и IgG3), а у крыс - на 4 (IgG1, IgG2a, IgG2b, IgG2C). Номенклатура подклассов возникла независимо для каждого вида, и поэтому нет никакой общей связи между подклассами каждого вида.
Поликлональные антитела (PAB), моноклональные антитела (mAb) и рекомбинантные антитела (RAB) представляют собой коллекцию бесценных инструментов для исследований в области естественных наук и многочисленных приложений.
Кроме того, каждая форма имеет преимущества и недостатки по сравнению со своими аналогами.
a. Поликлональные антитела (PAB)
PAB демонстрируют мультиэпитопные связывающие свойства, которые делают эти реагенты идеально подходящими для многих применений. Их клональное и биофизическое разнообразие обеспечивает большую чувствительность и полезность в определенных типах приложений и в исследованиях наук о жизни. Тем не менее, конечный запас PAB ограничивает их привлекательность, и использование контроля и стандартов в экспериментах необходимо для обеспечения воспроизводимости.
b. Гибридомные моноклональные антитела (MAB)
mAbs являются продуктом слияния клеток спеноцитов и миеломы, которые производятся с использованием стандартных протоколов. Этот процесс начинается с введения мыши или другого млекопитающего антигена, который вызывает иммунный ответ. Тип белых кровяных телец, В-клетка, производит антитела, которые связываются с введенным антигеном. Полученные антитела затем собирают у мыши. Эти изолированные В-клетки, в свою очередь, сливаются с бессмертными В-клеточными раковыми клетками для получения гибридной клеточной линии, называемой гибридомой. Эта гибридома обладает как способностью продуцировать антитела В-клетки, так и высокой долговечностью миеломы. Гибридомы можно выращивать в культуре, каждая культура начинается с одной клетки гибридомы, которая производит одно антитело на культуру (моноклональную). Моноклональные антитела, вырабатываемые каждой гибридомной линией, химически идентичны. Тем не менее, для производства, скрининга и банка MAB требуется значительное время, деньги и опыт.
c. Рекомбинантные моноклональные антитела (rAbs)
RAB строятся in vitro, вне ограничений иммунной системы, с использованием технологий рекомбинантной ДНК. Гены антител выделяются и затем включаются в векторы плазмидной ДНК, а полученные плазмиды трансформируются или трансфицируются в экспрессионные хозяева, такие как бактерии, дрожжи или клеточные линии млекопитающих (аналогичный процесс классического производства рекомбинантного белка). RAB предлагают специфичность и воспроизводимость MAB с преимуществом рекомбинантных модификаций, легко доступных. Таким образом, они могут использоваться во всех приложениях, где используются классические MAB. Они существуют в различных формах от IgG до dAb, минуя формы scFv, Fab, Diabody, а также моно,-, би- и три-варианты (см. рис. 2). Роль и разработка rAbs будут расширяться по мере развития этой технологии.
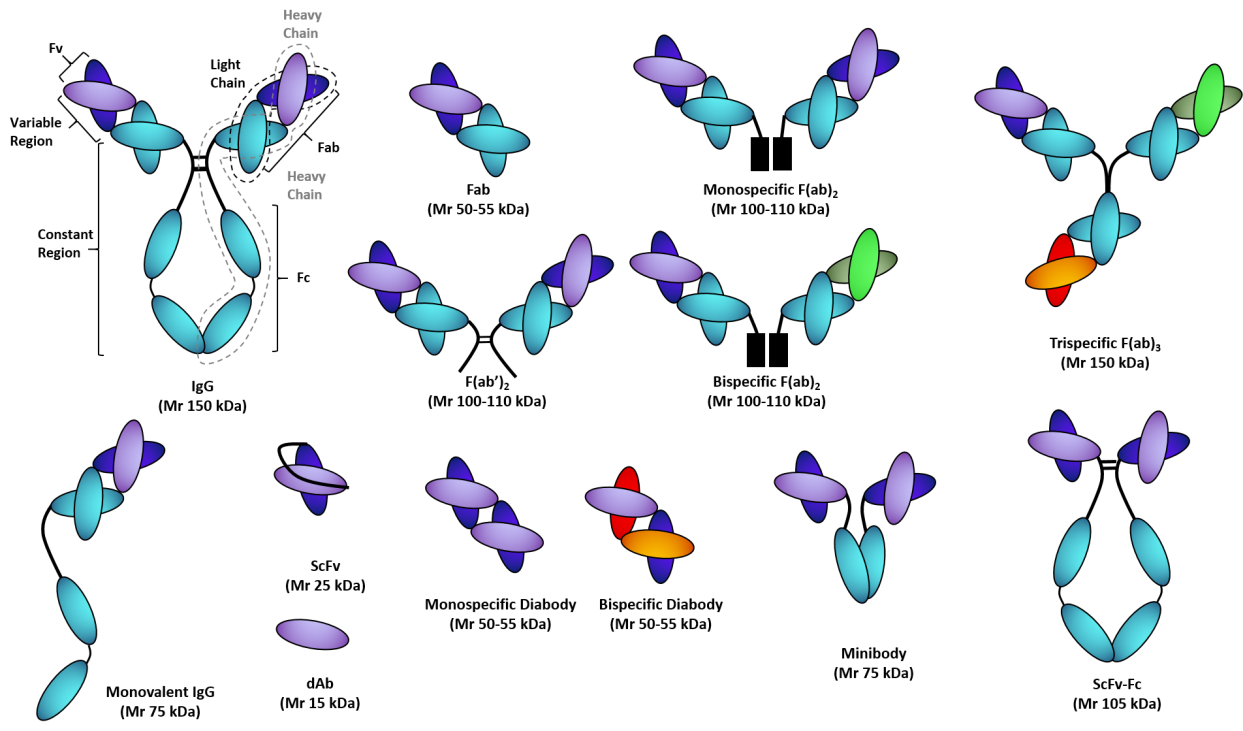
Рис. 3. Фрагменты рекомбинантных антител
Моноклональные антитела (МАБ) представляют собой универсальные биомакромолекулы, способные с высокой специфичностью связываться с широким спектром белковых и небелковых мишеней. Эти MAB могут быть спроектированы и изготовлены в различных форматах для расширения их функциональности и использования (рис. 3). На сегодняшний день более 80 MAB были одобрены для клинических применений, а многие другие находятся в доклинической и клинической разработке. Они представляют шесть из десяти самых продаваемых лекарств с годовым объемом продаж более 120 миллиардов долларов в 2017 году и, как ожидается, достигнут 130-200 миллиардов долларов к 2022 году. Они также имеют высокий уровень успеха в клинической разработке; например, сообщалось, что вероятность одобрения FDA для MAB в фазе I разработки составляет 14,1%, что почти в два раза превышает уровень одобрения низкомолекулярных препаратов. (7.6%). Такие факторы делают биофармацевтические компании более мотивированными и готовыми спонсировать разработку этих фармацевтических продуктов.
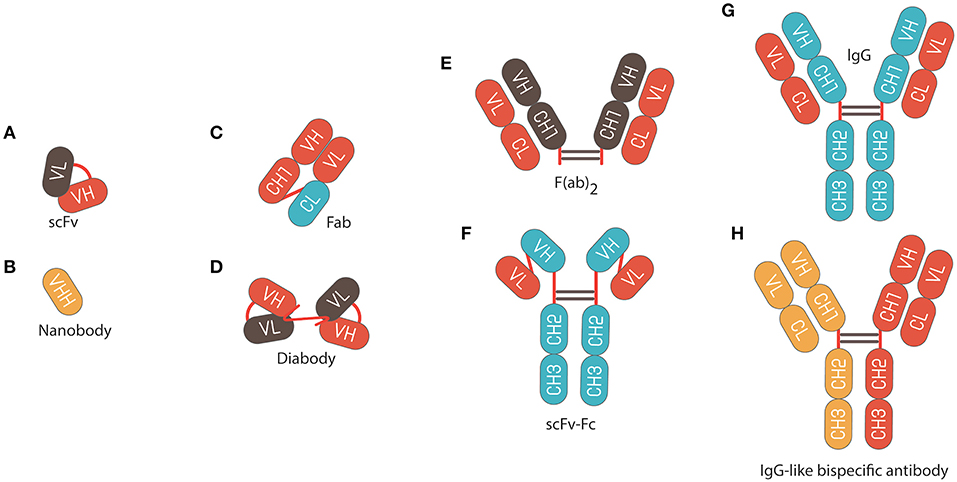
Рис. 4. Схематическое представление различных форматов антител. (А) Вариабельный фрагмент одной цепи (scFv), состоящий из вариабельных областей легкой цепи (VL), связанных с вариабельными областями тяжелой цепи (VH) гибким глицин-сериновым линкером (Gly4Ser)3. B) Фрагменты наночастиц. (В) Фрагмент связывания антигена (Fab), состоящий из Vl и постоянного домена легкой цепи (CL), связанного сVh и постоянным доменом 1 тяжелой цепи (CH1) дисульфидной связью между доменами CL и CH1. (D) Диабодия, состоящая из VL, связанного с переменным тяжелым VH пентамером (Gly4Ser). (E) Фрагмент F(ab)2, состоящий из 2× Fab-фрагментов, соединенных шарнирной областью иммуноглобулина G (IgG). (F) слияние scFv с Fc IgG. (G) IgG состоит из постоянного фрагмента (Fc), который способен связывать и стимулировать иммунные эффекторные клетки, и Fab, который содержит переменные домены, содержащие области связывания антигена. (H) Биспецифическое антитело IgG
За последние 120 лет исследования и разработки технологий, связанных с антителами, были удостоены четырех Нобелевских премий. В 1901 году Эмиль фон Беринг получил первую Нобелевскую премию по физиологии и медицине за успешное терапевтическое использование гипериммунной сыворотки лошади, содержащей нейтрализующие поликлональные антитела против дифтерийных и столбнячных токсинов. Колер и Мильштейн получили Нобелевскую премию 1984 года по физиологии и медицине за разработку новаторской технологии гибридомы, которая облегчила изоляцию MAB и их последующее производство в лабораториях. В 2018 году Джордж П. Смит и сэр Грегори П. Уинтер были удостоены Нобелевской премии по химии за разработку фагового дисплея пептидов и антител. В том же году Джеймс П. Эллисон и Тасуку Хондзе были удостоены Нобелевской премии 2018 года по физиологии и медицине за открытие иммунотерапии рака с помощью блокады антителами ингибирующего рецептора Т-клеток (CTLA-4) и запрограммированного белка клеточной смерти 1 (PD1) для усиления противоопухолевой активности.
2. IgG 1 антитело – функции и применение в биотехнологических препаратах
В виду того что подавляющее большинство всех терапевтических антител использует изотип IgG1, оно было изотипом по умолчанию для многих кандидатов в лекарственные антитела. И, следовательно, о биологии и функциональности IgG1 известно больше, чем о любом другом изотипе. Человеческое IgG1 антитело генерируется как часть Th1-типа ответа на антиген. Ответ Th1 характеризуется продукцией IFN-γ, который активирует бактерицидную активность макрофагов и индуцирует В-клетки вырабатывать антитела, что, в свою очередь, приводит к клеточно-опосредованному иммунитету. Человеческое антитело IgG1 может вызывать фагоцитоз через несколько рецепторов на моноцитах, макрофагах и нейтрофилах. Функциональность IgG антитела можно широко классифицировать на две основные категории.
Активность вариабельного домена в связывании антигена
Биология Fc-фрагмента и его роль в осуществлении эффекторных функций
Рекомбинантные антитела сконструированы in vitro с использованием технологии рекомбинантной ДНК. Гены антител выделяют из соответствующего источника или синтезируют на основе информации о последовательности. Затем их клонируют в экспрессионные векторы для экспрессии в подходящей экспрессионной системе. Как правило, ученые используют систему экспрессии млекопитающих с использованием клеток HEK293 или CHO для экспрессии рекомбинантных антител. Эти клетки просты в обращении, обладают высокими темпами роста, отличной трансфектабельностью и высокой производительностью рекомбинантных антител и белков. После того как у нас появляется последовательность антител, трансфекция через выработку антител может быть осуществлена всего за 3 недели.
Ученые производственной группы GenScript могут произвести разнообразные форматы антитела включая IgG, IgA, IgM, Bispecific IgG, scFv, BiScFv и протеины сплавливания Fc. Ученые GenScript выполняют различные эксперименты по оптимизации. Общая схема производства IgG1 приведена ниже.
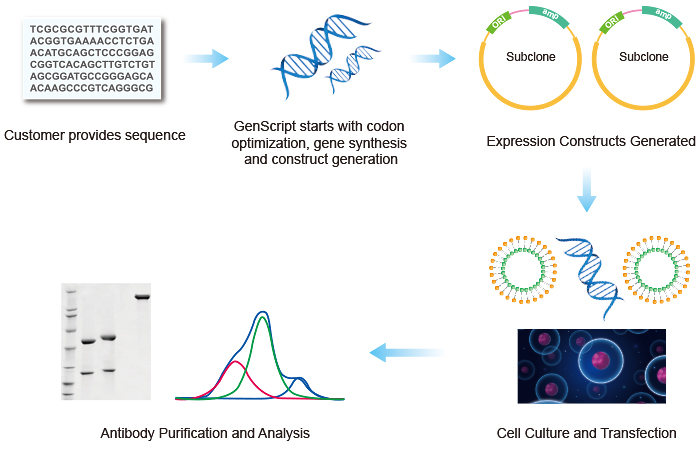
Рис. 5 Схема производства антител IgG с использованием транзиторной экспрессии в GenScript
3. Хроматографическая очистка белка – аффинная хроматография
Аффинная хроматография является предпочтительным методом биоселективной адсорбции и последующего извлечения соединения из иммобилизованного лиганда. Каждый из них предназначен для высокоспецифичной и эффективной очистки белков и родственных соединений.
Белки и другие макромолекулы, представляющие интерес, могут быть очищены от экстрактов или других сложных смесей различными методами. Селективное осаждение является, пожалуй, самым простым методом отделения одного типа макромолекул от другого.
Однако большинство методов очистки включают некоторую форму хроматографии, при которой молекулы в растворе (подвижная фаза) разделяются на основе различий в химическом или физическом взаимодействии со стационарным материалом (твердая фаза). Гель-фильтрация (также называемая размерно-эксклюзионной хроматографией или SEC) использует пористый полимерный материал для разделения молекул на основе размера (т.е. Физического исключения). В ионообменной хроматографии молекулы разделяются по силе их общего ионного взаимодействия с твердофазным материалом (т.е. неспецифических взаимодействий).
Напротив, аффинная хроматография (также называемая аффинной очисткой) использует специфические связующие взаимодействия между молекулами. Конкретный лиганд химически иммобилизован или “соединен” с твердым носителем так, что при пропускании сложной смеси через колонку связываются те молекулы, которые обладают специфическим сродством связывания с лигандом. После вымывания других компонентов образца связанная молекула удаляется с носителя, в результате чего происходит ее очистка от исходного образца.
Каждая конкретная аффинная система требует своего набора условий и представляет свои специфические проблемы для данной исследовательской цели.
Аффинная очистка обычно включает следующие этапы:
Инкубируют сырой образец (например, клеточный лизат, супернатант клеточной культуры или сыворотку) с аффинной поддержкой, чтобы позволить целевой молекуле в образце связываться с иммобилизованным лигандом.
Смыть несвязанные компоненты образца с носителя с помощью соответствующих буферов, поддерживающих связывающее взаимодействие между мишенью и лигандом.
Элюируют (диссоциируют и восстанавливают) молекулу-мишень из иммобилизованного лиганда путем изменения буферных условий таким образом, чтобы связывающее взаимодействие больше не происходило.
Хроматография состоит из трех основных компонентов: подвижной фазы или растворителя, содержащего белки, неподвижной или твердой фазы, также называемой средой или смолой (которая может быть агарозой или другой пористой смолой), и хроматографической колонки. Аффинная хроматография очень селективна и обеспечивает высокое разрешение при средней и высокой нагрузочной способности образца. Интересующий белок плотно связывается со смолой в условиях, благоприятствующих специфическому связыванию с лигандом, а несвязанные загрязнения смываются. Затем связанный белок извлекается в высокоочищенной форме путем изменения условий в пользу элюирования. Условия элюирования могут быть специфическими, такими как конкурентный лиганд, или неспецифическими, такими как изменение рН, ионной силы или полярности. Целевой белок элюируют в очищенном и концентрированном виде.
Однократный проход образца (клеточного лизата, супернатанта клеточной культуры или сыворотки) через аффинную колонку может обеспечить более чем 1000-кратную очистку специфического белка, так что после анализа гель-электрофорезом (например, SDS-PAGE) обнаруживается только одна полоса.
Чаще всего лиганды иммобилизуются или “соединяются” непосредственно с твердым материалом носителя путем образования ковалентных химических связей между определенными функциональными группами на лиганде (например, первичными аминами, сульфгидрилами, карбоновыми кислотами, альдегидами) и реакционноспособными группами на носителе.
Однако возможны и непрямые подходы к связыванию. Например, меченный глутатионом S-трансферазой (GST) слитый белок может быть сначала захвачен глутатионовым носителем через аффинное взаимодействие глутатион-GST, а затем вторично химически сшит для его иммобилизации.
Лиганды, которые связываются с общими классами белков (например, антителами) или обычно используемыми метками слитого белка (например, гистидиновой меткой или His-меткой), коммерчески доступны в предварительно иммобилизованных формах, готовых к использованию для аффинной очистки. Альтернативно, более специализированные лиганды, такие как специфические антитела или представляющие интерес антигены, могут быть иммобилизованы с использованием одного из нескольких коммерчески доступных активированных аффинных носителей; например, пептидный антиген может быть иммобилизован на носителе и использован для очистки антител, распознающих пептид.
Большинство процедур аффинной очистки, связанных с взаимодействием белок-лиганд, используют связывающие буферы при физиологическом рН и ионной силе, такие как фосфатный буферный физиологический раствор (PBS). Это особенно верно, когда антитело: антиген: белковые взаимодействия являются основой для аффинной очистки. Как только происходит связывающее взаимодействие, носитель промывают дополнительным буфером для удаления несвязанных компонентов образца. Неспецифические (например, простые ионные) связующие взаимодействия могут быть сведены к минимуму путем добавления низких уровней детергента или умеренной корректировки концентрации соли в связующем и /или промывочном буфере. Наконец, добавляется элюирующий буфер для разрыва связующего взаимодействия и высвобождения молекулы-мишени, которую затем собирают в очищенном виде.
Элюционные буферы диссоциируют связывающих партнеров экстремумами рН (низким или высоким), высокой солью (ионной силой), использованием детергентов или хаотропных агентов, денатурирующих одну или обе молекулы, удалением связывающего фактора или конкуренцией с лигандом. В большинстве случаев для обмена очищенного белка из элюирующего буфера на более подходящий буфер для хранения или последующего анализа требуется последующий диализ или обессоливание.
Наиболее широко используемым элюирующим буфером для аффинной очистки на основе белковых взаимодействий является 0,1 М глицин•HCl, рН 2,5-3,0. Этот буфер эффективно диссоциирует большинство взаимодействий белок: белок и антитело: антиген, не влияя на структуру белка. Однако некоторые антитела и белки повреждаются низким рН, поэтому элюированные белковые фракции лучше всего нейтрализовать немедленно добавлением 1/10 объема щелочного буфера, такого как 1 М Tris•HCl, рН 8,5.
4. Описание аффинного сорбента MabSelect Sure
MabSelect SuRe - это щелочестойкая белковая А-производная среда для захвата моноклональных антител из больших объемов корма методом хроматографии с упакованным слоем.
Среда ударной хроматографии Capto S (смола) является сильным катионообменником. Среда предназначена для полировки моноклональных антител (MAB) и широкого спектра других биомолекул. Для достижения эффективной очистки важна эффективная упаковка для любой хроматографической среды. Плохо упакованные колонки могут привести к дорогостоящим сбоям и потере ценного продукта. Надежные и проверенные методы упаковки и тестирования устранят такие проблемы и риски.
Capto S, Capto Q и Capto DEAE являются, соответственно, сильными катионными, сильными анионными и слабыми анионообменными хромарографическими средами (смолами), предназначенными для захвата с большой емкостью. Среды Capto обладают выдающимися свойствами потока под давлением, позволяющими как высокие высоты слоя, так и скорости потока в больших масштабах. Capto media хорошо подходит для быстрой и эффективной обработки больших объемов корма с целью оптимизации производительности и общей экономии процесса. Однако для достижения эффективной очистки важно, чтобы среды были эффективно упакованы. Плохо упакованные колонки могут привести к дорогостоящим сбоям и потере ценного продукта. Универсальные и надежные методы упаковки и тестирования могут устранить такие проблемы и риски. Платформа колонки AxiChrom была разработана с учетом этого, и проверенные методы упаковки доступны от пилота до технологического масштаба с помощью концепции интеллектуальной упаковки.
AKTA avant - препаративная хроматографическая система, предназначенная для разработки методов и процессов. Доступные в двух версиях, системы ÄKTA avant имеют разные спецификации расхода / давления, но имеют одинаковую аппаратную настройку. При скорости потока до 25 мл/мин система ÄKTA avant 25 предназначена для скрининга хроматографических сред (смол) и оптимизации методов. Система ÄKTA avant 150 со скоростью потока до 150 мл / мин предназначена для масштабирования до больших колонок. Программное обеспечение UNICORN используется для управления автоматизированными процессами на AKTA avant для повышения производительности и эффективности.
5. Изучение методики очистки рекомбинантных белков клеточной линии CHO – хроматография на аффинном сорбенте
Среди современных методов выделения и анализа рекомбинантных белков, хроматографические методы занимают лидирующее место, из них наиболее используемым является метод аффинной хроматографии.
Аффинная хроматография представляет собой метод разделения и очистки белков, основанный на их избирательном взаимодействии с лигандом, ко-валентно связанным с инертным носителем. Главная особенность, которая обусловливает высокую эффективность аффинной хроматографии, состоит в том, что разделение основано на различии не физико-химических признаков молекулы, а специфических функциональных свойствах, отличающих данный белок от множества других биополимеров. Метод используется в основном для выделения ферментов. Помимо этого, методом аффинной хроматографии можно выделять также токсины, рецепторы, ингибиторы, транспортные белки и другие биологически активные вещества. Высокой избирательностью отличается так называемая иммуносорбция (Ка = 1012-1014 М-1), при которой в качестве лиганда используются антитела, обладающие специфичностью к выделяемым белкам.
В последнее время широкое распространение получили методы аффинной хроматографии, в которых используются лиганды с так называемой групповой специфичностью. Аффинные сорбенты с групповой специфичностью в некоторых случаях не уступают по избирательности сорбентам с индивидуальной специфичностью, а иногда даже имеют свои преимущества. Сорбент с ковалентно закрепленным лигандом групповой специфичности может быть использован, если аффинная очистка производится из такой смеси, где целевое вещество является заведомо единственным представителем группы веществ, обладающих специфичностью к данному лиганду. Аффинный сорбент групповой специфичности может быть использован для разделения веществ, обладающих сродством к одному и тому же лиганду. В случае, если сила взаимодействия разделяемых веществ с лигандом различна, может быть использована техника конкурентной элюции для их разделения. Такой подход не мог бы быть использован в случае аффинного сорбента индивидуальной специфичности [1, 2].
Тиофильная хроматография. Один из современных вариантов аффинной хроматографии с использованием сорбентов групповой специфичности является, в частности, тиофильная хроматография. Метод основан на взаимодействии тиоэфирных групп, закрепленных на полимерной матрице, с иммуноглобулинами с образованием псевдо 8-8-свя-зей, аналогичных 8-8-связям в Бе-фрагменте иммуноглобулинов. Использование такого метода позволяет выделять и очищать иммуноглобулины всех видов животных в условиях, при которых они не теряют своей биологической активности [3].
Металлохелат-аффинная хроматография. Еще один современный метод металлохелат-аффинной хроматографии основан на способности белков обратимо сорбироваться на иммобилизированных ионах переходных металлов.
Металлохелат-аффинная хроматография так же, как и тиофильная хроматография, является методом разделения и очистки, в котором используются сорбенты групповой специфичности, поскольку сорбция белков определяется в основном наличием в их аминокислотной последовательности поверхностно-экспонированных остатков гистидина.
Сорбенты для металлохелат-аффинной хроматографии представляют собой полимерные матрицы с закрепленными на них иминодиуксусной (ИДК) или нитрилтриуксусной кислотой (НТК), на которых иммобилизируются ионы переходных металлов. Данный метод используется для выделения и очистки белков, содержащих участки, богатые ги-стидиновыми остатками на №-ИДК сорбентах [4, 5].
Однако металлохелат-аффинная хроматография на таких сорбентах в основном используется для выделения и очистки рекомбинантных белков, в структуру которых встроены аффинные метки с высоким сродством к определенным хелатным сорбентам; наиболее распространенные аффинные метки - гексагистидиновые полипептиды. Реком-бинантные белки, в структуру которых встроены гексагистидиновые фрагменты, могут легко связываться с носителем, а потом элюироваться при изменении состава подвижной фазы. Техника поли-гистидиновых меток широко применяется для выделения различных ферментов, поскольку сами по-лигистидиновые вставки очень малы и практически не влияют на ферментативную активность, имму-ногенность или какие-либо другие функциональные свойства [6].
В качестве примера можно привести выделение и иммобилизацию рекомбинантной ацилазы глутарил-7-аминоцефалоспориновой кислоты. Данный иммобилизированный фермент можно использовать для получения из глута-рил-7-аминоцефалоспориновой кислоты - 7-амино-цефалоспориновой кислоты, которая широко применяется для получения антибиотиков. Такой рекомбинантный фермент со встроенной гексаги-стидиновой вставкой был одностадийно выделен и иммобилизирован на №-ИДК сорбенте. Было показано, что такая иммобилизация не приводит к значительным потерям активности фермента, а сам комплекс стабилен при физиологических значениях рН [7].
Субстратсвязывающие домены в аффинной хроматографии. Сейчас все более широкое применение в различных сферах биотехнологии находят субстратсвязывающие домены, которые представляют собой участки фермента, специфически связывающиеся с олиго- или полисахаридами, например с целлюлозой, хитином, ксиланом. Они обладают широким спектром физико-химических свойств, размеры их аминокислотных последовательностей варьируют от 30 до 200 аминокислотных остатков и, что особенно важно, они обладают высокой специфичностью связывания с различными субстратами. Такие домены сейчас используются, например, для увеличения гидролитической активности некоторых рекомбинантных ферментов [8, 9]. Субстратсвязывающие домены, соединенные с полигистиди-новыми цепями, иммобилизируются на металлохе-латных сорбентах и могут быть использованы для изучения взаимодействий субстрат-фермент [10].
Еще одно применение таких субстратсвязываю-щих участков - метод аффинной очистки рекомбинантных белков. Добавление в аминокислотную последовательность целевого белка какого-либо суб-стратсвязывающего домена и позволяет проводить выделение или очистку на аффинном сорбенте, с которым селективно связывается данный домен. Основная функция таких доменов в ферменте - увеличение локальной концентрации молекул фермента вблизи субстрата за счет связывания с ним. В рекомбинантных белках такой домен может быть использован для специфического связывания с сорбентом, в то время как балластные белки останутся в подвижной фазе при нанесении на колонку [8, 11].
Заключение
Обычно используемая метафора для иллюстрации аффинного связывания - это аналогия замка и ключа. Уникальная структура, присутствующая на поверхности белка, является ключом, который будет связываться только с соответствующим замком, специфическим лигандом на хроматографической подложке.
При двухэтапной очистке белка с аффинной меткой белок сначала очищается аффинной хроматографией, а затем обессоливается. В некоторых системах хроматографии среднего давления, таких как системы хроматографии среднего давления NGC, эти два этапа могут быть автоматизированы. На первом этапе рекомбинантную белковую смесь пропускают через хроматографический носитель, содержащий лиганд, который селективно связывает белки, содержащие аффинно-меточную последовательность (обычно His или GST). Загрязняющие вещества вымываются, и связанный белок затем элюируется в чистом виде.
Аффинные метки имеют различные преимущества. В иммобилизованной металлической аффинной хроматографии (IMAC) His связывается с хорошей селективностью с Ni2 + или другими переходными металлами, иммобилизованными на лиганде; меченый белок может быть селективно элюирован имидазолом. белки, помеченные GST, связываются с глутатионом в качестве лиганда и элюируются растворами глутатиона. Белки с ферментативно активной меткой слияния GST могут быть очищены только в нативных условиях. Напротив, меченные полигистидином белки могут быть очищены в нативных или денатурирующих условиях.
На второй стадии обессоливания аффинно очищенные образцы могут одновременно подвергаться буферному обмену для удаления солей при подготовке к последующему применению.
Ряд методов обессоливания, включая хроматографию исключения размера, диализ и ультрафильтрацию, также допускают буферный обмен. Обессоливание часто включает удаление не только соли, но и других посторонних веществ, таких как детергенты, нуклеотиды и липиды.
Аффинную хроматографию можно разделить на два типа методов:
Первый метод использует естественную структуру или последовательность аминокислот на белке в качестве сайта связывания. Примеры включают сродство Affi-Gel Blue support binding к билирубин-связывающему сайту альбумина и связывание белка A в Affi-Gel и Affi-Prep protein A supports с областью Fc IgG. Важным соображением для очистки антител является определение сродства целевого антитела к средам хроматографии белка A / G, которое широко варьируется.
Второй метод включает связывание со специальной аминокислотной последовательностью, сконструированной в представляющий интерес белок, обычно называемый "меткой". Имеется несколько различных меток. Двумя наиболее часто используемыми белковыми метками являются полигистидиновая метка, которая связывается с определенными металлосодержащими комплексами, такими как в смолах Profinity ™ IMAC, и последовательность глутатион s-трансферазы (GST), которая связывается с глутатионом, обнаруженным в средах Bio-Scale ™ Mini Profinity ™ GST. Теоретически любой белок может быть очищен с помощью метода мечения; однако необходимо учитывать множество факторов, чтобы разработка процесса очистки меченых рекомбинантных белков.
Список использованной литературы
J. Arnau, C. Lauritzen, G. E. Petersen, and J. Pedersen, “Current strategies for the use of affinity tags and tag removal for the purification of recombinant proteins,” Protein Expression and Purification, vol. 48, no. 1, pp. 1–13, 2006.
D. S. Waugh, “Making the most of affinity tags,” Trends in Biotechnology, vol. 23, no. 6, pp. 316–320, 2005.
D. Walls and S. T. Loughran, “Tagging recombinant proteins to enhance solubility and aid purification,” Methods in Molecular Biology, vol. 681, pp. 151–175, 2011.
D. R. Smyth, M. K. Mrozkiewicz, W. J. McGrath, P. Listwan, and B. Kobe, “Crystal structures of fusion proteins with large-affinity tags,” Protein Science, vol. 12, no. 7, pp. 1313–1322, 2003.
J. J. Lichty, J. L. Malecki, H. D. Agnew, D. J. Michelson-Horowitz, and S. Tan, “Comparison of affinity tags for protein purification,” Protein Expression and Purification, vol. 41, no. 1, pp. 98–105, 2005.
S. Liang, F. Gong, X. Zhao et al., “Prokaryotic expression, purification of a new tumor-relative protein FAM92A1-289 and its characterization in renal cell carcinoma,” Cancer Letters, vol. 276, no. 1, pp. 81–87, 2009.
C. di Guan, P. Li, P. D. Riggs, and H. Inouye, “Vectors that facilitate the expression and purification of foreign peptides in Escherichia coli by fusion to maltose-binding protein,” Gene, vol. 67, no. 1, pp. 21–30, 1988.
S. N. Hewitt, R. Choi, A. Kelley, G. J. Crowther, A. J. Napuli, and W. C. Van Voorhis, “Expression of proteins in Escherichia coli as fusions with maltose-binding protein to rescue non-expressed targets in a high-throughput protein-expression and purification pipeline,” Acta Crystallographica F, vol. 67, no. 9, pp. 1006–1009, 2011.
J. D. Fox, K. M. Routzahn, M. H. Bucher, and D. S. Waugh, “Maltodextrin-binding proteins from diverse bacteria and archaea are potent solubility enhancers,” FEBS Letters, vol. 537, no. 1–3, pp. 53–57, 2003.
D. Sachdev and J. M. Chirgwin, “Fusions to maltose-binding protein: control of folding and solubility in protein purification,” Methods in Enzymology, vol. 326, pp. 312–321, 2000.
M. Lebendiker and T. Danieli, “Purification of proteins fused to maltose-binding protein,” Methods in Molecular Biology, vol. 681, pp. 281–293, 2011.
J. P. Bannantine, J. K. Hansen, M. L. Paustian et al., “Expression and immunogenicity of proteins encoded by sequences specific to Mycobacterium avium subsp. paratuberculosis,” Journal of Clinical Microbiology, vol. 42, no. 1, pp. 106–114, 2004.
F. Guo and G. Zhu, “Presence and removal of a contaminating NADH oxidation activity in recombinant maltose-binding protein fusion proteins expressed in Escherichia coli,” BioTechniques, vol. 52, no. 4, pp. 247–253, 2012.
A. Malhotra, “Tagging for protein expression,” Methods in Enzymology, vol. 463, pp. 239–258, 2009.
R. J. Peroutka III, S. J. Orcutt, J. E. Strickler, and T. R. Butt, “SUMO fusion technology for enhanced protein expression and purification in prokaryotes and eukaryotes,” in Heterologous Gene Expression in E. coli, T. C. Evans and M. Q. Xu, Eds., vol. 705 of Methods in Molecular Biology, pp. 15–30, 2011.
D. B. Smith and K. S. Johnson, “Single-step purification of polypeptides expressed in Escherichia coli as fusions with glutathione S-transferase,” Gene, vol. 67, no. 1, pp. 31–40, 1988.
M. Hammarström, N. Hellgren, S. van den Berg, H. Berglund, and T. Härd, “Rapid screening for improved solubility of small human proteins produced as fusion proteins in Escherichia coli,” Protein Science, vol. 11, no. 2, pp. 313–321, 2002.
C. Wang, A. F. Castro, D. M. Wilkes, and G. A. Altenberg, “Expression and purification of the first nucleotide-binding domain and linker region of human multidrug resistance gene product: comparison of fusions to glutathione S-transferase, thioredoxin and maltose-binding protein,” Biochemical Journal, vol. 338, no. 1, pp. 77–81, 1999.
S. Harper and D. W. Speicher, “Purification of proteins fused to glutathione S-transferase,” Methods in Molecular Biology, vol. 681, pp. 259–280, 2011.
T. G. M. Schmidt, J. Koepke, R. Frank, and A. Skerra, “Molecular interaction between the strep-lag affinity peptide and its cognate target, streptavidin,” Journal of Molecular Biology, vol. 255, no. 5, pp. 753–766, 1996.
T. G. M. Schmidt and A. Skerra, “The random peptide library-assisted engineering of a C-terminal affinity peptide, useful for the detection and purification of a functional Ig Fv fragment,” Protein Engineering, vol. 6, no. 1, pp. 109–122, 1993.
T. G. M. Schmidt and A. Skerra, “The Strep-tag system for one-step purification and high-affinity detection or capturing of proteins,” Nature Protocols, vol. 2, no. 6, pp. 1528–1535, 2007.
I. P. Korndörfer and A. Skerra, “Improved affinity of engineered streptavidin for the Strep-tag II peptide is due to a fixed open conformation of the lid-like loop at the binding site,” Protein Science, vol. 11, no. 4, pp. 883–893, 2002.
S. Voss and A. Skerra, “Mutagenesis of a flexible loop in streptavidin leads to higher affinity for the Strep-tag II peptide and improved performance in recombinant protein purification,” Protein Engineering, vol. 10, no. 8, pp. 975–982, 1997.
M. R. Junttila, S. Saarinen, T. Schmidt, J. Kast, and J. Westermarck, “Single-step Strep-tag purification for the isolation and identification of protein complexes from mammalian cells,” Proteomics, vol. 5, no. 5, pp. 1199–1203, 2005.
|
|
|
 Скачать 0.91 Mb.
Скачать 0.91 Mb.




