Проект. Текст работы_пример. Разработка метода получения фрагмента сердечного тропонина т человека с помощью металл аффинной хроматографии
 Скачать 1.58 Mb. Скачать 1.58 Mb.
|
|
РАЗРАБОТКА МЕТОДА ПОЛУЧЕНИЯ ФРАГМЕНТА СЕРДЕЧНОГО ТРОПОНИНА Т ЧЕЛОВЕКА С ПОМОЩЬЮ МЕТАЛЛ - АФФИННОЙ ХРОМАТОГРАФИИ Автор: Руководитель: к.б.н. Нефёдова Виктория Викторовна учитель индивидуального проекта, научный сотрудник ФИЦ Биотехнологии РАН Москва, 2021 Оглавление1. Введение 2 Актуальность работы и медицинская значимость 2 Проблема 3 Цель работы 3 Задачи работы: 4 Практическая значимость 4 2. Обзор литературы 4 2.1.Инфаркт миокарда 4 2.2. Диагностика инфаркта миокарда 5 2.3.Строение мышцы. Тропониновый комплекс. 6 2.4. Сердечный тропонин Т 7 3. Методы и материалы 9 3.1. Материалы и приборы 9 3.2.Трансформация бактерий 9 3.3.Синтез белков в бактериях 10 3.4.Электрофорез белков 11 3.5. Очистка His – тропонина Т-Т1 методом металл – аффинной хроматографии 12 Первый способ очистки 13 Второй способ очистки 14 Результаты 15 Выводы 20 Список литературы 21 Приложение 22 Приложение 1. 22 1. ВведениеАктуальность работы и медицинская значимостьМногие заболевания человека связаны с изменением свойств белков вследствие мутаций в гене или изменения количества (уменьшения или увеличения) конкретного белка в тканях в результате заболевания. Высокоочищенные препараты различных белков очень широко используются не только в научных целях, но и в клинической практике в качестве стандартов. Одним из таких примеров является белок сердечный тропонин Т, который служит маркером инфаркта миокарда. Определение количества сердечного тропонина Т в крови пациента осуществляется с помощью иммуноферментного анализа, однако для выполнения данного метода необходимо получение препарата сердечного тропонина Т, который будет служить стандартом при количественной определении концентрации тропонина Т в крови. Помимо этого сердечный тропонин Т используется в исследованиях работы кардиомиоцитов и кардиомиопатий (наследственных заболеваний сердца). ПроблемаПолучение белков для промышленности или диагностических целей требует быстрого способа очистки белка в максимально короткие сроки. Одним из способов очистки являются аффинная и металл-аффинная хроматография. Аффинная хроматография (или хроматография по сродству) основана на принципе избирательного взаимодействия белков или других макромолекул с иммобилизованными на носителях специфическими веществами лигандами (это может быть кофермент, если выделяют фермент; антитело при выделении антигенов и др). Получение больших количеств сердечного тропонина Т из тканей человека невозможно. Тем не менее, с помощью биотехнологических методов синтеза возможно получение этого белка их клеток бактерий. Однако, по данным литературы, в клетках бактерий целый белок часто не приобретает нативную (правильную) структуру. В тоже время различные укороченные фрагменты сердечного тропонина Т хорошо синтезируются в клетках бактерий. При этом проблема быстрой очистки белка из клеток бактерий остается актуальной, и именно на ее решение направлен мой проект. Цель работыРазработать быстрый метод получения высокоочищенного фрагмента Т1 сердечного тропонина Т человека. Задачи работы:Получить бактерий, синтезирующие фрагмент сердечного тропонина Т (T1), содержащий 6 дополнительных аминокислот – гистидинов (6 His) (6 His - тропонин Т –T1). Подтвердить наличие в бактериях белка His - тропонин Т–T1 методом электрофореза. Выделить и очистить фрагмент сердечного тропонина Т (T1), методом металл-аффинной хроматографии, используя разные условия. Проанализировать результаты и выбрать лучшие условия для получения высокоочищенного белка His – тропонин Т –T1. Практическая значимостьМеталл-аффинная хроматографии является широко используемым способом очистки белков, с помощью которого можно довольно быстро разделить сложные смеси и компоненты. Возможность использования данного метода для очистки и получения фрагмента сердечного тропонина Т (Т1) имеет важное значение как для научных исследований, так и для практических исследований. Разработка протокола для быстрой очистки белка важна для практических работ и исследований. 2. Обзор литературы2.1.Инфаркт миокардаИнфарктом миокарда называют очаг ишемического некроза сердечной мышцы, развивающийся в результате острого нарушения коронарного кровообращения. Инфаркт сердца – одна из главных причин смертности населения. Развитие инфаркта зависит от возраста и пола человека. В связи с более поздним появлением атеросклероза у женщин инфаркты диагностируются у них в 3–5 раз реже, чем у мужчин. В группу риска попадают все представители мужского пола, начиная с 40-летнего возраста. У людей обоих полов, перешедших рубеж 55–65 лет, заболеваемость примерно одинакова. По статистике 30–35% всех случаев острого инфаркта сердечной мышцы заканчиваются летальным исходом [1]. 2.2. Диагностика инфаркта миокардаВ диагностике инфаркта миокарда есть несколько основных этапов: Обращение пациента. Проведение ЭКГ (электрокардиографическое исследование), которое помогает выявить распространенность повреждения, нарушение ритма сердца, формирование аневризмы сердца. Лабораторная диагностика – исследование крови на маркеры инфаркта миокарда. К специфическим белкам-маркерам сердечной мышцы относятся следующие соединения [2]: Тропонины Т и I Миоглобин Креатинфосфокиназа-МВ (КФК-МВ) Лактатдегидрогеназа-1 (ЛДГ-1) АСТ (аспартат аминотрансфераза) Сейчас в медицине применяют следующие тесты: Тропониновый тест. Этот тест наиболее чувствительный в диагностике острого инфаркта, хотя его уровень может повышаться и при других патологических процессах в организме. Повышение уровня ферментов наблюдается через 3-4 часа от начала приступа и достигает максимальных величин к 2-м суткам. Повышенный уровень тропонинов держится до 10 (I) и 15 (Т) суток. Миоглобиновый тест. Определяется содержание миоглобина. Фермент начинает повышаться через 2-3 часа и достигает максимальной концентрации к 10-му часу от начала инфаркта. Повышенный уровень этого фермента может наблюдаться до 3 суток. Уровень миоглобина может повышаться в 10-20 раз в сравнении с нормой [2,7]. Лактатдегидрогеназный (ЛДГ) тест — определение содержания в крови ЛДГ-1. Он начинает повышаться через 8 часов и достигает максимума на 2-3 сутки. Повышенный уровень фермента держится до 12 суток. 2.3.Строение мышцы. Тропониновый комплекс.Сердце состоит из трех типов мышечной ткани: миокард желудочков, миокард предсердия, атипический миокард проводящей системы сердца. Структурно-функциональные единицы волокон — кардиомиоциты. Эти клетки, имеют прямоугольную, вытянутую форму. Кардиомиоциты отличаются большим количеством митохондрий, которые расположены тесными рядами между миофибриллами. Клетки, которые имеют прямоугольную, вытянутую форму. Одно-два ядра располагаются в центре клетки. Периферическую часть цитоплазмы кардиомиоцитов занимают поперечноисчерченные миофибриллы, аналогичные таковым в симпластах скелетномышечного волокна. Снаружи миоциты покрыты сарколеммой, в составе которой выделяются плазмолемма и базальная мембрана. Характерной особенностью ткани является наличие вставочных дисков на границе между контактирующими кардиомиоцитами. Вставочные диски пересекают волокно в виде волнистой или ступенчатой линии, они включают межклеточные контакты от простых) [6,7]. Тропониновый комплекс – это группа мышечных белков, входящих в тропонин-тропомиозиновую систему. Тропониновый комплекс состоит из трех компонентов: Тропонин Т. Тропонин Т связывает тропомиозин. Тропонин С. Тропонин С отвечает за связывание кальция. Тропонин I. Тропонин I предназначен для ингибирования процессов, за которые отвечают тропонин Т и тропонин С [2,8]. 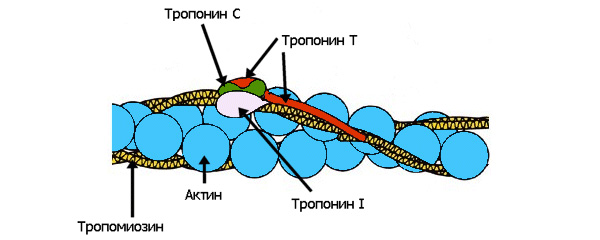  Рис. 1. Строение тропонинового комплекса и его взаимодействие с актиновым филаментом и тропомиозином. 2.4. Сердечный тропонин ТТропонин Т представлен в организме человека также тремя генами, кодирующими соответственно быструю и медленную скелетную, а также сердечную изоформы белка. Для различных животных и человека было показано, что помимо кардиомиоцитов сердечная изоформа ТнТ в небольшом количестве экспрессируется в скелетных мышцах во время эмбрионального развития [8]. Кинетика тропонина Т при инфаркте миокарда отличается от кинетики других белков. Его концентрация повышается в крови уже через 3-4 часа после начала болевого приступа, пик его концентрации приходится на 3-4 сутки, в течении 5-7 дней наблюдается плато, затем уровень тропонина Т постепенно снижается, остаются повышенные значения до 10-20-го дня. При успешно выполненном тромболизисе выявляется два пика: первый – через 14 часов после возникновения инфаркта миокарда, его величина значительно выше уровня второго пика, который соответствует 4-му дню острого инфаркта миокарда. Концентрация тропонина Т в крови в первый день инфаркта миокарда зависит от длительности окклюзии: чем скорее сосуд «открывается», тем сильнее будет выражено повышение тропонина Т. При крупноочаговом инфаркте миокарда после тромболизиса уровень тропонина Т может повышаться максимально в 400 раз [7]. Возрастание концентрации тропонина Т с течение времени (после инфаркта) говорит о необратимом некрозе миокарда. При длительной окклюзии высокий уровень тропонина Т в крови, наблюдаемый в течении 10 дней, объясняется продленным его выходом из зоны инфаркта. При неосложненном течении инфаркта миокарда концентрация тропонина Т снижается уже к 5-6-му дню, а к 7-му дню повышенные значения тропонина Т выявляются у 60% больных. В структуре тропонина Т можно выделить несколько участков: Т1 (начало белка, аминокислотные остатки 1-158) и Т2. Участок Т1 отвечает за связывание тропомиозина и образует α-спираль (рис. 2) [3,9].  3. Методы и материалыРабота выполнялась с 18 декабря 2020 года по 17 февраля 2021 года в ГБОУ Школа № 1517 и на базе Федерального исследовательского центра «Фундаментальные основы биотехнологии» РАН. 3.1. Материалы и приборыМатериалы: плазмида pET23, содержащая последовательность фрагмента сердечного тропонина Т и 6 остатков аминокислоты His (Приложение 1), компетентные клетки Е. coli штамм С41, ампициллин – антибиотик группы полусинтетических пенициллинов широкого спектра действия, LB – среда для роста бактерий, реактивы для электрофореза по методу Леммли, колонка для металл-аффинной хроматографии HisTrap GE HealthCare на 1 мл, стерильные пробирки на 30 и 1,5 мл, шприц на 2 мл, автоматические дозаторы. Приборы: Thermo-shaker используется для интенсивного перемешивания образцов в пробирке в условиях термостатирования, камера для вертикального электрофореза, ультразвуковой дезинтегратор (Sonics VibraCell), колонка для металл-аффинной хроматогарфии HisTrap (GE Healthcare), перистальтический насос. 3.2.Трансформация бактерийДля получения бактерий, экспрессирующих необходимый белок, провели трансформацию. Для трансформации использовали компетентные клетки E. coli штамм C41. Ход работы: Разморозили клетки C41 во льду в течение 30 минут. В стерильных условиях пипеткой набрали 1 мкл плазмиды His-Тропонин Т-T1-pET23a. Аккуратно перемешали и оставили во льду на 30 минут. Создали тепловой шок 42 оС в течение 50 секунд. Затем сразу поместили в лед. Оставили бактерии расти, поместив их в прибор Thermo-Shaker на 1 час при 37 оС и постоянном перемешивании 1100 оборотов/мин. Провели центрифигурирование 5 минут 4000 g. Удалили излишки среды, осадок клеток суспендировали в 100 мкл среды. Перенесли суспензию клеток на поверхность питательной среды LB-агар, содержащую ампициллин, и шпателем Дригальского распределили по поверхности. Помесили бактерии в термостат на 24 часа при 37 оС. 3.3.Синтез белков в бактерияхПлазмида pET 23a-His-тропонин Т-Т1, которую мы использовали в работе, содержит лактозный оперон, поэтому синтез белка индуцировали, добавляя ИПТГ (Изопропил-β-D-1-тиогалактопиранозид). Ход работы: 1. Стерильным наконечником перенесли колонию с твердой питательной среды LB-агар в 30 мл жидкой стерильной среды LB, содержащей ампициллин (100 мкг/мл), оставили при постоянном перемешивании и температуре 37 оС на 14 часов. 2. 1 мл культуры бактерий перенесли в 30 мл свежей жидкой стерильной среды LB, содержащей ампициллин. Растили при постоянном перемешивании и температуре 37 оС до достижения оптической плотности 0,6 ед. 3. Добавили ИПТГ до конечной концентрации 1мМ и оставили при постоянном перемешивании и температуре 37 оС на 24 часа. Перед добавлением ИПТГ отобрали 1 мл культуры (отрицательный контроль). 4. Через 4 часа отобрали по 1 мл культуры бактерий. Бактериальные клетки осадили центрифугированием при 3000 g 10 минут. 5. Оставшиеся клетки (29 мл бактериальной культуры) оставили на 24 часа при постоянном перемешивании и температуре 37 оС, затем осадили центрифугированием при 3000 g 30 минут. 3.4.Электрофорез белковЭлектрофорез – это способ разделения смеси белков на фракции или индивидуальные белки, основанный на движении заряженных белковых макромолекул различного молекулярного веса в стационарном электрическом поле. Электрофорез белков применяют как для анализа компонентов смеси белков, так и для получения гомогенного белка. С помощью электрофореза можно разделить на отдельные компоненты белковую смесь, что позволяет установить молекулярную массу белка или его субъединиц, подтвердить чистоту выделенного белка 1) Растворили осадок клеток в буфере (объем пробы 3 мл). 2) Разрушение бактериальных клеток при помощи ультразвука. Содержимое клеток (лизат) анализировали методом электрофореза по методу Леммли [4]. (Все реактивы и гель для проведения электрофореза были предоставлены научным руководителем). 3) Подготовка проб: смешивали лизат и буфер для образцов в соотношении 3:1, грели пробы 10 мин 85 оС. 4) Собирали камеру для электрофореза и наносили образцы в лунки геля 1.Первый образец (После добавления ИПТГ) (10 мкл) 2.Второй образец (После добавления ИПТГ) (10 мкл) 3.Третий образец (Образец «До добавления ИПТГ») (10 мкл) 3.5. Очистка His – тропонина Т-Т1 методом металл – аффинной хроматографииАффинная хроматография – это разновидность адсорбционной хроматографии. Основной особенностью аффинной хроматографии является наличие комплементарности между иммобилизованным на матрице лигандом и вторым партнером пары взаимодействующих компонентов, который извлекается из смеси с другими, не комплементарными лиганду веществами. Использование высокоизбирательного взаимодействия позволяет за одну стадию достичь очень высокой степени очистки искомого вещества. Принцип металл-аффинной хроматографии был впервые сформулирован Поратом. Он был основан на сродстве ионов переходных металлов, таких как Zn2+ , Cu2+ , Ni2+ и Co2+ к гистидину и цистеину в водных растворах (рис. 3). Реакция образования комплекса иона металла и функциональных групп (например, фосфатных групп) биоорганических молекул, как правило, обратима. Поэтому иммобилизованные ионы металлов можно использовать как сорбент. Взаимодействие между сорбентом и аналитом (например, белком) находится в зависимости от pH, поэтому связанные вещества можно элюировать, изменяя рН, уменьшая ионную силу буфера или используя другие хелатирующие агенты, такие как ЭДТА или имидазол [5]. 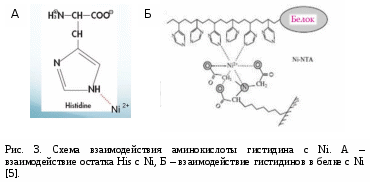 Первый способ очисткиХод работы: 1) К осадку бактериальных клеток добавили 30 мл буфера А для хроматографии (50 мМ Трис рН 8.0, 15 мM имидазол, 300 мМ NaCl) 2) Разрушили клетки бактерий при помощи ультразвука; избавились от нерастворимых частиц при помощи центрифугирования при 18.000 g 30 минут, 4 оС. Аккуратно слили раствор=супернатант (без осадка). 3) Подготовили колонку для металл-аффинной хроматографии (His-Trap GE Healthcare, 1 мл) к работе. Для этого, используя перистальтический насос, промыли 20 мл буфера А (процедура уравновешивания колонки, рис. 4, этап 1). 4) При помощи перистальтического насоса нанесли смесь бактериальных белков на колонку (рис. 4, этап 2). Затем еще раз промыли колонку 10 мл буфера А (рис. 4, этап 3). Собрали фракцию белков, которые не связались с колонкой («проскок») для анализа методом электрофореза. 5) Используя буфер В (с повышенной концентрацией имидазола: 50 мМ Трис рН 8,0, 500 мM имидазол, 300 мМ NaCl), элюировали связавшиеся с носителем белки (рис. 4, этап 4), фракции собирали по 200 мкл и проанализировали методом электрофореза. Схема хроматографии представлена на рис. 4. 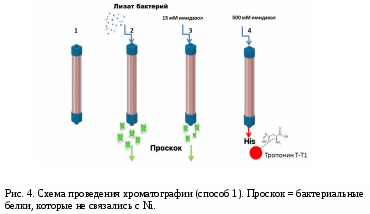 Второй способ очисткиВо втором способе очистки мы использовали шприц вместо перистальтического насоса и элюировали белки ступенчатым градиентом, т.е. постепенно повышая концентрацию имидазола в буфере. Ход работы: Подготовили колонку His-Trap к работе, для этого промыли ее 16 мл буфера А. При помощи шприца нанесли смесь бактериальных белков на колонку. Собрали «проскок» в отдельную пробирку. Стали промывать колонку растворами с разной концентрацией имидазола, по 2 мл каждого. В пробирки 1,2 собрали по каплям раствор белков, элюирующихся при 15 мМ имидазола. В пробирки 3,4 собрали по каплям раствор белков, элюирующихся при 50 мМ имидазола В пробирки 5,6 собрали по каплям раствор белков, элюирующихся при 100 мМ имидазола. В пробирки 7,8 собрали по каплям раствор белков, элюирующихся при 150 мМ имидазола. В пробирки 9,10 собрали по каплям раствор белков, элюирующихся при 200 мМ имидазола. В пробирки 11,12 собрали по каплям раствор белков, элюирующихся при 250 мМ имидазола. В пробирки 13,14 собрали по каплям раствор белков, элюирующихся при 300 мМ имидазола. В пробирки 15,16 собрали по каплям раствор белков, элюирующихся при 400 мМ имидазола. В пробирки 17,18 собрали по каплям раствор белков, элюирующихся при 500 мМ имидазола. После хроматографии все пробы были проанализированы методом электрофореза. Результаты1. На первом этапе работы мною были получены колонии бактерий С41, содержащие плазмиду с геном устойчивости к ампициллину и нуклеотидную последовательность фрагмента сердечного тропонина Т-Т1 (рис. 5). Питательная среда LB-агар содержала антибиотик ампициллин. Выросло очень много колоний бактерий, что говорит о том, что трансформация прошла успешно.   Рис. 5. Фотография чашки Петри с питательной средой и колониями бактерий после трансформации. 2. На втором этапе работы я провела синтез белка в бактериях в жидкой среде LB. Для того чтобы узнать, синтезировался ли нужный нам белок, мы проанализировали пробы методом электрофореза (рис. 6.)  Нужный нам белок синтезируется. Как видно на рис. 6 (дорожки «+») в бактериях появляется новый белок, его молекулярная масса составляет 25 кДа (при сравнении с белками-маркерами, на первой дорожке). 3. Далее я приступила к очистке белка His-Тропонин Т-Т1. Первый способ очистки состоял в том, что после нанесения всех белков бактерий на колонку, для очистки я вначале использовала 1 буферный раствор с концентрацией 15 мМ имидазола (чтобы отмыть колонку от белков, которые не связались с Ni, так называемый «проскок»), а затем сразу повысила концентрацию имидазола до 500 мМ. При этом я собирала пробы по 150-200 мкл, которые затем проанализировала методом электрофореза (рис. 7).  На дорожках 3 и 4 (рис. 7) присутствует нужный нам белок. Его масса составляет 25 кДа. Во фракции «проскока» так же остаются белки, однако среди них нет His-Тропонин-Т1. Белок His-Тропонин-Т1 удалось почистить, однако чистота препарата не 100%, и в пробе в небольшом количестве присутствуют много других белков. Второй способ очистки состоял в том, что мы повышали концентрацию имидазола ступенчато (рис. 8 и 9). Я брала поочередно буферные растворы с концентрацией 15 мМ, 50 мМ, 100 мМ, 150 мМ, 200 мМ, 250 мМ, 300 мМ, 400 мМ и 500 мМ имидазола и собирала каждый раз пробы белков, которые удалось элюировать. Белок His-Тропонин Т-Т1 начинает очищаться уже при концентрации имидазола 100 мМ. Так же во втором способе мы использовали вместо перистальтического насоса шприц, что доказывает то, что можно провести очистку белка методом металл-аффинной хроматографии при помощи колонки вручную. 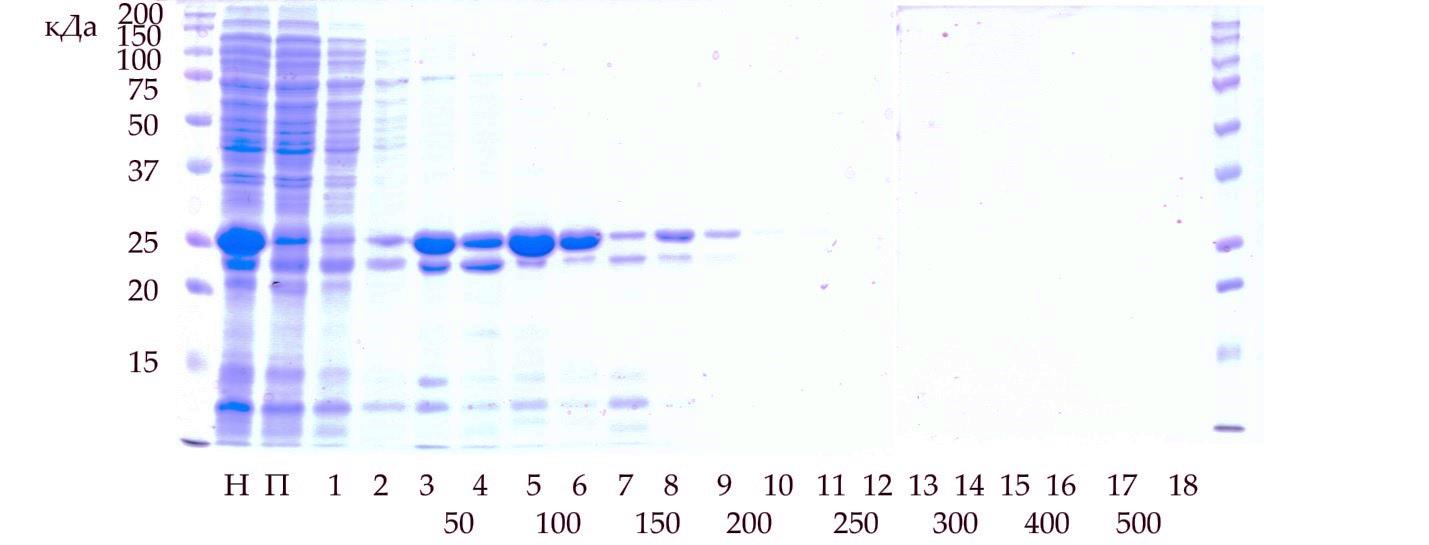  Рис. 8. Фотография геля после электрофореза. Номера дорожек соответствуют номерам проб, внизу подписана концентрация имидазола в буфере: 1,2 – 15 мМ; 3,4 – 50 мМ; 5,6 – 100 мМ; 7,8 – 150 мМ; 9,10 – 200 мМ; 11,12 – 250 мМ; 13,14 – 300 мМ; 15,16 – 400 мМ; 17,18 – 450 мМ. На первой и последней дорожках обозначены маркеры молекулярных масс. . Как видно на рис. 8. на дорожках 3-9 находится нужный нам белок. При концентрации имидазола равной 100 мМ белок His-Тропонин Т-Т1 перестает быть связанным с носителем на колонке. На дорожке 9 самый чистый белок, но его количество не очень большое. Если сравнивать пробы по чистоте белка одновременно с самым большим количеством белка, то такой пробой будет проба № 5 (дорожка 5, рис. 8). Эксперимент был повторен 2 раза (рис. 8 и 9).  На дорожках 3-11 (рис. 9) находится нужный нам белок. При концентрации имидазола 100 мМ His-Тропонин Т-Т1 перестает быть связанным с носителем в колонке. На дорожке 11 самый чистый белок, однако так же, как и в предущем эксперименте. при желании получить как моэно больше более чистого белка можно выбрать пробы № 5 и 6. Итак, я считаю, что оба метода очистки белка эффективны, но первый метод (одностадийный) более быстрый, т.к. мы резко повышаем концентрацию с 15 мМ до 500 мМ имидазола, а во втором методе мы повышаем концентрацию ступенчато, что помогает нам убедиться в том, что белок очищается со 100 мМ. Однако во втором случае мы можем выбрать пробы, в которых находится только His-Тропонин Т-Т1, и практически нет других белков. Так же при работе с колонкой я считаю, что удобнее пользоваться перистальтическим насосом, т.к. это быстрее, но шприцом так же можно работать, если отсутствуют определенные условия. Проведение металл-аффинной хроматографии с использованием шприца доказывает то, что очистку белка при помощи колонки можно провести и в школьных условиях. По результатам свое работы всем желающим получить высокоочищенный препарат фрагмента Т1 сердечного тропонина Т человека я рекомендую использовать метод металл-аффинной хроматографии со ступенчатой элюцией, при этом самые лучшие пробы для работы получатся после промывки колонки буфером с 100 мм имидазола. ВыводыБыли получены бактерии, синтезирующие фрагмент сердечного тропонина Т (T1), содержащий 6 дополнительных аминокислот – гистидина (6 His) (6 His - тропонин Т –T1). Используя элюцию буфером с 500 мМ имидазола и градиент буферов с различной концентрацией имидазола, методом металл-аффинной хроматографии был выделен и очищен фрагмент сердечного тропонина Т (T1). Оба метода являются эффективными для быстрой очистки белка. Используя градиент имидазола (при 100 мМ имидазола) был получен высокоочищенный белок His - тропонин Т –T1. Разработанный метод может использоваться для быстрой и эффективной очистки белка в школьной лаборатории. Список литературы[сайт]. – URL: https://www.krasotaimedicina.ru/diseases/zabolevanija_cardiology/myocardial_infartion (дата обращения 10.01.2021). – Текст : электронный. NCBI : [сайт] – Национальный институт биоинформатики. Раздел Books Книги URL : https://www.ncbi.nlm.nih.gov/books/NBK545216/ (дата обращения 2.01.2021) Текст : электронный. Patibandla; S., Gupta, K, Alsayou, K. Cardiac Enzymes. Protein Data Bank База Данных Структур Белков : сайт URL: https://www.rcsb.org (дата обращения: 10.02.2021) Текст. Изображение : электронные. PDB ID: 1J1E Takeda, S., Yamashita, A., Maeda, K., Maeda, Y. Crystal structure of the 52kDa domain of human cardiac troponin in the Ca2+ saturated form. Nature. – 2003, – 424, pp 35-41. Сафронова, М.И. Основы практической биохимии белка : учебно-методическое пособие для практических занятий по биохимии МГУ им. М.В. Ломоносова, кафедра биохимии / Сафронова, М.И., Зайцева, Н.Н.. Рубцов, А.М., Гривенникова, В.Г., Рыжавская, А.С., Гусев, Н.Б. – Москва, – Макс-Пресс, . – 2009. текст: непосредственный Кельциева, О.А. Металл – аффинная хроматография. Основы и применения. / Кельциева, О.А., Гладилович, В.Д., Подольская, Е.П. – Текст : непосредственный. – Научное приборостроение, – 2013, – т. 23, – № 1, с. 74-85. – ISSN 0868-5886. [сайт]. – URL: https://gemohelp.ru/id/313 (дата обращения 11.01.2021). – Текст : электронный. [сайт]. – URL: http://vmede.org/sait/?id=msprav_Laboratornaja_diagnostika&menu=msprav_Laboratornaja_diagnostika&page=70 (дата обращения 11.01.2021). – Текст : электронный. Катруха, И.А.. Тропониновый комплекс сержца человека. Структура и функции. / Катруха, И.А. – Текст : непосредственный // Успехи биологической химии. – 2013. – т. 3. – с. 149-194. Heeley, D.H. The effects of troponin T fragments T1 and T2 on the binding of nonpolymerizable tropomyosin to F-actin in the presence and absence of troponin I and troponin C. / Heeley, D.H., Golosinska, K., Smillie, L.B. Текст : непосредственный // Journal of Biological Chemistry. – 1987. – V. 262. – I. 21. – P. 9971-9978 ПриложениеПриложение 1.Аминокислотная последовательность фрагмента T1 сердечного тропонина Т (обозначена черным цветом), дополнительно содержащая 6 аминокислотных остатков гистидина (обозначена красным цветом) и последовательность, которую расщепить протеаза 3С (обозначена синим цветом). mhhhhhhlevlfqgpmsdieevveeyeeeeqeeaaveeqeeaaeedaeaeaeteetraeedeeeeeakeaedgpmeeskpkprsfmpnlvppkipdgervdfddihrkrmekdlnelqalieahfenrkkeeeelvslkdrierrraeraeqqrirnerekerqnrlaeerarr |
