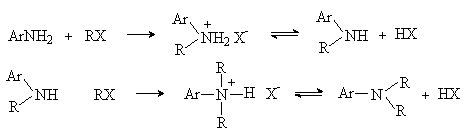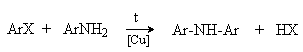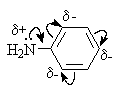Тема 24. Ариламины и другие азотсодержащие соединения. Аренмонокарбоновые кислоты Ароматические нитросоединения Методы получения
 Скачать 295.7 Kb. Скачать 295.7 Kb.
|
3 – 5). Причина низкой основности ариламинов – стабилизация свободного амина за счет делокализации неподеленной пары электронов азота по ароматическому кольцу и потеря энергии стабилизации при нарушении сопряженной системы в результате протонирования. |
| | | | |
| п-CH3C6H4NH2 | 5,1 | п-O2NC6H4NH2 | 1,0 |
| C6H5NH2 | 4,6 | (C6H5)2NH | 0,78 |
| м-O2NC6H4NH2 | 2,5 | | |
Реакции с С-электрофилами
Важнейшими реакциями этого типа являются алкилирование и ацилирование, которые протекают по атому азота и аналогичны реакциям алифатических аминов. Ароматические амины менее реакционноспособны из-за меньшей основности атома азота.
Реакции ароматического электрофильного замещения
а) Галогенирование
Аминогруппа является сильным активирующим заместителем и ориентантом I рода. Галогенирование свободных аминов протекает очень легко и часто приводит к полигалоидпроизводным. Например, анилин при действии бромной воды мгновенно превращаются в нерастворимое 2,4,6-трибромпроизводное.
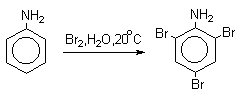
Для получения моногалогенпроизводных активирующее действие аминогруппы снижают путем ацилирования. После снятия ацильной защиты путем гидролиза получают свободный амин.
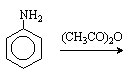
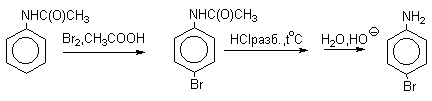
б) Нитрование
При нитровании нитрующей смесью амины окисляются. Кроме того, из-за солеобразования по аминогруппе образуется м-изомер (-NH3+ - ориентант II рода).
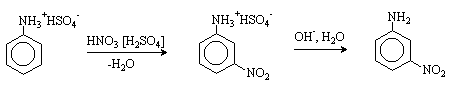
Для введения нитрогруппы в орто- или пара-положение к аминогруппе последнюю защищают ацилированием. Варьируя условия реакций (температуру, нитрующие агенты), можно проводить нитрование региоселективно.
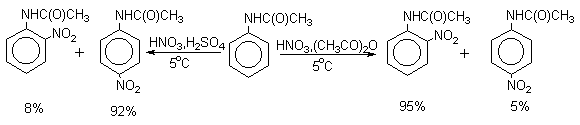
После снятия ацетильной защиты получают свободные орто- и пара-нитроанилины.
в) Сульфирование
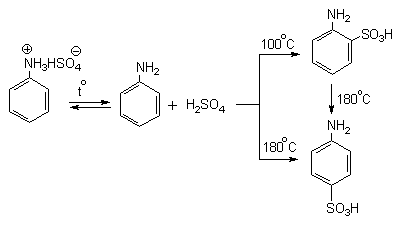
Сульфированием ароматических аминов получают аминосульфокислоты. В 90-100%-ной серной кислоте или олеуме амин полностью находится в протонированной форме. Аммониевая группа NH3+как сильный электроакцепторный заместитель вызывает резкое замедление реакции сульфирования и ориентирует замещение в мета-положение.
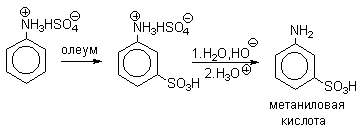
Для получения орто- и пара-аминобензолсульфокислот используют “метод запекания”. Процесс осуществляют при длительном нагревании гидросульфатов ароматических аминов при 100-200оС в сухом виде или в высококипящих растворителях. При температуре около 100оС образуется практически чистый орто-изомер (ортаниловая кислота, продукт кинетического контроля), а при 180-200оС - пара-изомер (сульфаниловая кислота, продукт термодинамического контроля).
Нитрозирование
Первичные ароматические амины с азотистой кислотой образуют относительно устойчивые соли арилдиазония.
ArNH2 + NaNO2 + 2HCl ® ArN2+Cl- + NaCl + 2H2O
Эту реакцию называют диазотированием (см.лек. №43).
Вторичные ароматические амины при нитрозировании дают N-нитрозамины.
ArNHR + NaNO2 + HCl ® Ar-N(R)-N=O + NaCl + H2O
Третичные ариламины дают продукты нитрозирования в пара-положение ароматического кольца.
ДЕГИДРОБЕНЗОЛ
1. Механизм отщепления-присоединения
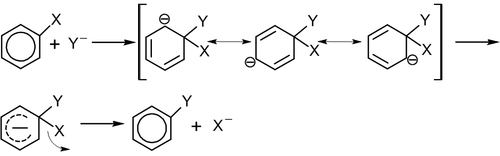
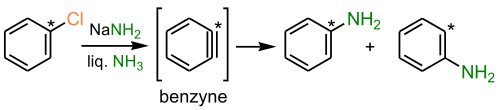
Данный механизм реализуется при взаимодействии неактивированных субстратов с сильными основаниями в жестких условиях, например, в реакциях галогенбензолов с концентрированными растворами щелочей или амидами металлов в жидком аммиаке. Механизм включает последовательные стадии отщепления и присоединения. На первой стадии нуклеофил действует как основание и отщепляет протон из орто-положения к атому галогена ароматического субстрата. Образовавшийся карбанион (I) быстро отщепляет галогенид-анион Х-, в результате чего образуется нестабильная частица (II), содержащая тройную связь в шестичленном цикле.
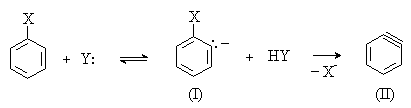
Далее следует стадия нуклеофильного присоединения к интермедиату (II) с образованием конечного продукта.
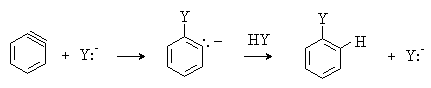
Отличительной чертой реакций, протекающих по ариновому механизму, является то, что нуклеофил вступает не только на место уходящей группы, но и в соседнее по отношению к уходящей группе положение. Так, при использовании хлорбензола с изотопной меткой 14С в реакции с амидом калия образуется анилин, содержащий метку 14С как в положении 1, так и в положении 2, в примерно равных количествах.
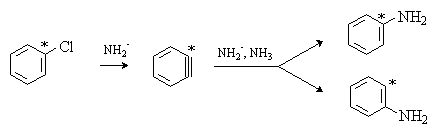
Нуклеофильное замещение в галогенбензолах, имеющих в ароматическом кольце помимо галогена другой заместитель, приводит к образованию изомеров. Так, при взаимодействии пара-хлортолуола с амидом натрия в жидком аммиаке получают смесь мета- (62%) и пара-толуидинов (38%):
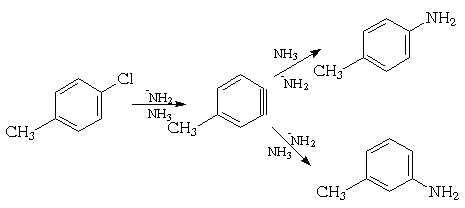
Если оба орто-положения по отношению к атому галогена заняты, то замещения в данных условиях вообще не идет.
Образующиеся в качестве интермедиатов арины не содержат полноценную тройную связь, так как присутствие тройной связи в шестичленном цикле должно приводить к очень большому напряжению. Более вероятно, что делокализованные p -орбитали ароматической системы в основном не затрагиваются, а лежащая в плоскости кольца локализованная p -связь образуется за счет частичного перекрывания sp2-гибридных орбиталей.
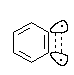
Перекрывание между этими орбиталями с учетом пространственных требований оказывается слабым, поэтому арины по структуре близки к бирадикалам, что обусловливает их чрезвычайно высокую реакционноспособнную способность.
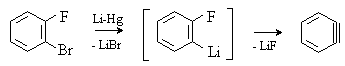
В настоящее время разработан ряд методов генерирования аринов. Дегидробензол образуется при взаимодействии о-дигалогенаренов с амальгамой лития или магния.
Наиболее удобный метод генерирования дегидробензола состоит в диазотировании антраниловой кислоты с последующим разложением образующейся внутренней соли диазония, которая при нагревании или облучении синхронно отщепляет азот и СО2.
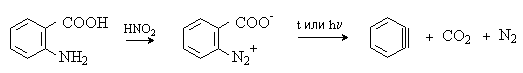
В связи с высокой реакционной способностью арины не могут быть выделены как индивидуальные вещества. Существование аринов доказано в экспериментах с их улавливанием. Так, генерирование дегидробензола в присутствии фурана приводит к получению аддукта реакции Дильса-Альдера:
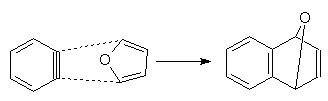
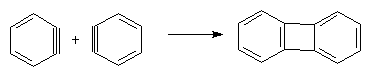
При генерировании дегидробензола в отсутствие частиц, способных с ним взаимодействовать, он очень быстро димеризуется в устойчивый бифенилен:
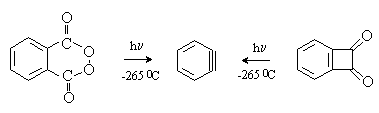
Дегидробензол в качестве индивидуального соединения, а не предполагаемого интермедиата, был зафиксирован при фотолизе фталоилпероксида или бензциклобутен-1,2-диона в твердой аргоновой матрице при –2650С.
ДИАЗОСОЕДИНЕНИЯ
План
Ароматические диазосоединения.
Алифатические диазосоединения.
Диазосоединения содержат группу N2, причем один атом азота связан с органическим радикалом, а другой - с гетероатомом. Ароматические и алифатические диазосоединения сильно различаются по строению, стабильности и реакционной способности.
1. Ароматические диазосоединения
Классификация и номенклатура
Ароматические диазосоединения имеют общую формулу ArN2X. В зависимости от типа связи между фрагментамиArN2 и X различают следующие типы диазосоединений.
Соединения, содержащие ионную связь (соли диазония):
ArN2+X-
X- – анион сильной кислоты с низкой нуклеофильностью, в том числе комплексный ион (Cl-, Br- HSO4-, BF4-, SbF6-, PF6-), например:

Соединения, содержащие ковалентную связь:
Ar-N=N-X
X= -CN, -OCOCH3, -I, -SO3H, -OH, -OAr, -NH-Ar
Например:
| C6H5-N=N-CN | C6H5-N=N-OH | C6H5-N=N-O- Na+ |
| бензолдиазоцианид | бензолдиазогидроксид | бензолдиазотат натрия |
Основной тип ароматический диазосоединений – соли арендиазония.
Методы получения солей арендиазония
Основной метод получения солей арендиазония – диазотирование. Процесс диазотирования выражается следующим суммарным уравнением.
ArNH2 + NaNO2 + 2 HX ® ArN+=N X - + NaX + 2 H2O
(X= Cl, HSO4, BF4 и др.)
Механизм реакции диазотирования
Механизм включает cтадии нитрозирования амина. Нитрозирующими агентами являются соединения общей формулы O=N-X. Сама азотистая кислота (X=OH) является слишком слабым электрофильным реагентом, поэтому для ускорения процесса требуется присутствие сильной кислоты, в водном растворе которой азотистая кислота частично протонируется с образованием очень активного электрофильного агента - нитрозацидий-катиона:
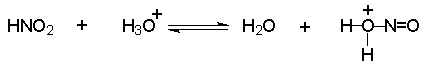
Этот катион гораздо быстрее реагирует с неорганическими анионами, присутствующими в растворе, чем с амином. В результате образуются новые нитрозирующие реагенты: азотистый ангидрид, хлористый или бромистый нитрозил.
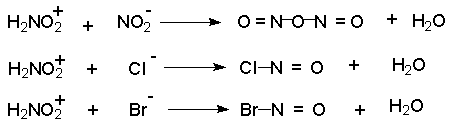
В разбавленных водных растворах серной, фосфорной, хлорной и других кислот с малонуклеофильными анионами нитрозирующим агентом является азотистый ангидрид N2O3 . При диазотировании в растворах HCl и HBr электрофильными агентами являются соответственно NOCl и NOBr. В сильно кислой среде активной частицей является, вероятно, катион H2NO2+. Наиболее активный нитрозирующий агент - нитрозилсерная кислота получается при взаимодействии нитрита натрия с концентрированной серной кислотой.