517Демина_АВГУСТ ХОРСТМАН. Август хорстман и начала химической термодинамики
 Скачать 1.63 Mb. Скачать 1.63 Mb.
|
|
АВГУСТ ХОРСТМАН И НАЧАЛА ХИМИЧЕСКОЙ ТЕРМОДИНАМИКИ Уильям Б. Дженсен Университет Цинциннати (William B. Jensen University of Cincinnati) Задача (1) Вероятно, самым узнаваемым уравнением современной химической термодинамики является уравнение, связывающее свободную энергию реакции (∆G) при постоянных T и P с её стандартным изменением энтальпии (∆H°), стандартным изменением энтропии (∆S°) и коэффициентом реакции (Q) (2): ∆G = ∆H° - T∆S° + RTlnQ которое в предельном случае равновесия (∆G = 0 и Qeq = K) дает нам не менее известное уравнение: ∆G° = ∆H° - T∆S° = - RTlnK Если спросить, когда эти соотношения были впервые признаны и кем, большинство химиков, вероятно, сказали бы, что не знают. Некоторые могли бы предположить, что раз ∆G теперь известна как функция свободной энергии Гиббса, то впервые она была выведена американским физиком Джозайей Уиллардом Гиббсом (Josiah Willard Gibbs). На самом деле, как будет показано в дальнейшем, впервые они были выведены в 1873 году, в другой, но эквивалентной форме неизвестным немецким химиком Августом Фридрихом Хорстманом (August Friedrich Horstmann), имя которого почти исчезло из современных учебников. Но, прежде чем рассматривать вклад Хорстмана, необходимо представить суть его работы, кратко рассмотрев раннюю историю как термохимии, так и химической термодинамики. Эта история была подробно задокументирована предыдущими историками и является предметом многочисленных монографий, некоторые из которых перечислены в сопроводительных ссылках. Наша цель не повторить эту историю в деталях, а просто напомнить читателю о некоторых важных именах и датах, чтобы обеспечить хронологические рамки для нашего более подробного обсуждения Хорстмана. В термохимическом контексте Как уже было сказано, необходимо различать «старую» термохимию, которая занимается только теплотами, и дисциплину собственно химической термодинамики, которая занимается теплотой, работой и энтропией. Действительно, история термохимии, в свою очередь, может быть дополнительно разделена на то, что можно было бы назвать «калорической (caloric) фазой» и «фазой первого закона» (3). В первой фазе тепло рассматривалось как жидкая, невесомая субстанция, которая могла химически соединяться с атомами, образуя их внешнюю сферу, что делало их взаимно отталкивающимися (4). Она работала в противовес химическому сродству, которое заставляло атомы взаимно притягиваться. Предполагалось, что ассоциативные реакции по своей сути являются экзотермическими, поскольку они уменьшают площадь атомной поверхности, доступную для связывания калорий, тем самым высвобождая часть их в качестве ощутимого тепла. Считалось, что реакции диссоциации, наоборот, являются эндотермическими, поскольку они увеличивают площадь атомной поверхности, доступной для связывания свободного тепла в виде нечувствительной комбинированной субстанции. Отсутствие необходимости взаимодействия было объяснено связью между выделением или поглощением тепла и степенью химического сродства. Во всяком случае, поглощение было скорее композиционным, нежели динамическим (т. е. измеряли калорийность или состав различных молекул). Калорическая фаза началась в 1784 году с работ Лавуазье (Lavoisier) и Лапласа (Laplace) о теплотах сгорания. Наиболее продуктивными исследователями тогда были Пьер Фавр (Pierre Favre) и Иоганн Зильберман (Johann Silbermann), которые измерили множество теплот реакций образования и трансформации в период 1844-1853 гг. Наиболее важным достижением этого периода был закон о постоянстве теплового эффекта реакций, который впервые был предложен швейцарско-русским химиком, Германом Ивановичем Гессом (Germain Hess) в 1840 году. Как следует из названия, фаза первого закона началась с провозглашения первого закона термодинамики или закона сохранения энергии основывался на формулировках 1841-1847 гг.—в первую очередь Джеймса Джоуля (James Joule) из Англии и Роберта Майера (Robert Mayer) и Германа фон Гельмгольца (Hermann von Helmholtz) из Германии — хотя было много и других претендентов (5). Впервые закон был широко применен к химическим системам десятилетие спустя, где он был наиболее тесно связан с работами Джулиуса Томсена (Julius Thomsen) из Дании в 1850-1886 гг. и Марселена Бертло (Marcelin Berthelot) во Франции в 1864-1897 гг. (6, 7). Основываясь на эквивалентности тепла и работы, в отличие от калорической теории, закон постулировал, прямую зависимость между выделением тепла и степенью химического сродства через так называемый «принцип максимальной работы», который предполагал, что чем больше тепла выделяется, тем больше уменьшение потенциальной энергии атомов и тем стабильнее получающаяся молекула. Прямое его применение требовало, чтобы было проведено различие между выделением тепла в результате химического изменения вещества (∆Hchem) — количеством теплоты, к которому фактически применялся принцип максимальной работы, — и теплотой, связанно с изменением физического состояния вещества(∆Hphy), которые обязательно сопровождали реакцию: ∆Hrx = ∆ Hchem + ∆Hphy [3] различие, которое оказалось невозможным для применения на практике. В термодинамическом контексте Переход от термохимии к собственно химической термодинамике основан на провозглашении второго закона термодинамики немецким ученым Рудольфом Клаузиусом (Rudolph Clausius) в 1850 году (с использованием Q/T, вместо энтропии до 1865 года) и британским ученым Уильямом Томсоном (лордом Кельвином) (William Thomson, Lord Kelvin) в 1852 году (с использованием концепции рассеивания энергии) (2, 8). Однако прошло почти два десятилетия, прежде чем второй закон был применен к химическим реакциям (9). На ранних этапах заметный вклад в эту область исследования внесли Ж. Мутье (J. Moutier) (1871) и Х. Песлин (H. Peslin) (1871) во Франции, лорд Роли (Lord Raleigh) (1875) в Великобритании, Дж. У. Гиббс (1875-1878) в Соединенных Штатах и, как мы скоро увидим, Хорстман в Германии (1869, 1873). Первая монография, посвященная собственно химической термодинамике, была опубликована в Англии Джорджем Ливингом (George Liveing) в 1885 году и была основана на качественной концепции рассеивания энергии, а не на количественной функции энтропии Клаузиуса (10). Эмпирический Контекст В дополнение к вышеупомянутым двум концептуальным нитям у нас также есть заключительная экспериментальная нить, основанная на эмпирической концепции химического равновесия. Впервые она была представлена французским химиком Клодом Бертолле (Claude Berthollet) в 1799-1803 годах. Пионерские работы по изучению равновесных реакций в растворах были сделаны Л. Ф. Вильхеми (Wilhemy) (1850), Дж. Гладстоном (Gladstone) (1855), М. Бертло и Л. Пеан де Сен-Жиль (Berthelot and Péan de Saint-Gilles) (1862), А.Г.В. Харкортом (Harcourt) и У. Эссеном (Essen) (1864) и, что наиболее известно, норвежской группой исследователей К.М.Гульдберга и П.Вааге (Guldberg, Waage) (1864, 1867) (9, 11). Эмпирические исследования равновесия вступили в новую фазу (как в прямом, так и в переносном смысле), когда они были расширены от реакций растворения до реакций газовой диссоциации. Типичные примеры такого типа реакций: Q + CaCO3(тв) ↔ CaO(тв) + CO2(г) Q + NH4Cl(тв) ↔ NH3(г) + HCl(г) Q + PCl5(тв) ↔ PCl3(г) + Cl2(г) Помимо важных ранних результатов, полученых Г. Эймом (Aime) (1837) и У. Р. Гроувом (Grove) (1847), это были обширные исследования Анри Сент-Клера Девилля (Henri Sainte-Claire Deville) и его коллег, Х.Дж.Дебрэ (Debray) и Л. Дж. Трооста (Troost), во Франции в 1857-1868 годах, которые вывели экспериментальное изучение равновесий диссоциации газов на передний план, установив важные аналогии между зависимостью давления и температуры этих равновесных реакций и реакциями, наблюдаемыми под давлением паров жидкостей (12). Рационализация газовой диссоциации Равновесие Различные попытки теоретически обосновать эти экспериментальные результаты начали появляться в конце 1860-х и 1870-х годах. Некоторые из них были основаны на недавно появившейся кинетико-молекулярной теории газов, другие - на законах термодинамики. Самое важное качественное кинетико-молекулярное обоснование было дано австрийским физиком Леопольдом Пфаундлером (Pfaundler) в 1867 году, который, основываясь на зависимости частот столкновений молекул от температуры и давления, постановил образование переходных комплексов при столкновении и требование пороговых энергий реакции — идеи, которые во многом предвосхитили концептуальную основу современной химической кинетики (13). Следуя качественному подходу Пфаундлера, Хорстманн первоначально попытался разработать количественную теорию диссоциации, используя кинетическую теорию газов, но отказался от этих попыток, потому что они оказались недостаточными для объяснения отсутствия эффекта массового действия в случае твердых тел (14). Приняв вместо этого альтернативный термодинамический подход, Хорстманн сначала применил его к термической диссоциации хлорида аммония (вторая реакция, приведенная в предыдущем разделе) в 1869 (15). Используя аналогию с давлением пара, он сопоставил данные об изменении давления диссоциации хлорида аммония в зависимости от абсолютной температуры с эмпирическим уравнением, впервые предложенным Биотом (Biot) для давления пара, а затем применил перестановку в уравнении Клаузиуса-Клапейрона: (dP/dT) = ∆H/(T∆V) [4] для того чтобы рассчитать соответствующую теплоту диссоциации: ∆H = (T∆V)(dP/dT) [5] За этим последовали еще три статьи о диссоциации в 1871-1872 годах, опять же основанные на применении как дифференциальных, так и интегрированных форм уравнения Клаузиуса-Клапейрона (16). Однако в 1873 году Хорстманн еще раз вернулся к этой теме в статье, озаглавленной «Теория диссоциации», в которой он использовал совершенно новый подход, основанный на явном применении новой функции энтропии Клаузиуса (17). Здесь он сформулировал условие равновесия для диссоциации как прямую функцию максимального изменения общей энтропии (∆S) изолированной системы в зависимости от степени реакции или диссоциации (dх): (∆S/dx) = 0 [6] в котором общее производство энтропии определялось уравнением: S = (Qx)/T + Z [7] где Q/T - теплота реакции на моль (Q), деленная на абсолютную температуру (T), а Z – изменение «разобщенности» химических реагентов и продуктов. Этот последнее определение было впервые введено Клаузиусом в 1862 году и послужило его обоснованием для лежащей в основе молекулярного базиса увеличения энтропии. Увеличение «разобщенности» соответствовало уменьшению степени молекулярной агрегации и, следовательно, соответствующему увеличению степени молекулярной дисперсии или дезагрегации (18). Аналогично, требование Хорстмана о том, что (dS/dx) = 0 при равновесии, было ни чем иным, как прямым математическим выражением знаменитой переформулировки второго закона Клаузиуса в 1865 году: «Die En tropie der Welt strebt einem Maximum zu». Однако применение этих уравнений к реальным химическим реакциям потребовало дальнейшей доработки уравнения 7, которую Хорстман затем продолжил делать для каждого конкретного случая. Это можно проиллюстрировать его простейшим случаем: термическая диссоциация твердого реагента с получением одного твердого продукта и сопутствующего газообразного продукта: Q + AB(тв) ↔ A(тв) + B(г) как показано на примере термической диссоциации карбоната кальция, приведенной в предыдущем разделе. Здесь конечное условие равновесия было задано конкретным уравнением: (dS/dx) = q/T + ARln(u/uo) + C = 0 [8] где q - равновесное значение Qx, A - механический эквивалент теплоты, R - универсальная газовая постоянная, C - изменение распределения различных реагентов и продуктов в их стандартных состояниях, а u/uo - отношение равновесного молярного объема (u) одного газообразного продукта к его стандартному состоянию (uо). Другими словами, второй член в этом уравнении отражает способ, которым дезагрегация или энтропия газообразного состояния изменяется в зависимости от степени его разбавления, выраженное в объеме на моль (V/n). Выводя его, Хорстманн впервые использовал закон идеального газа, написанный на основе расчета на моль, а не на грамм: up = RT [9] где u - объем на моль газа (19). Молярный объем (V/n), конечно, обратно пропорционален как молярной концентрации (n/V), так и парциальному давлению (p), двум переменным, обычно используемым при написании коэффициентов реакции. В своем третьем примере Хорстман вывел конкретные условия равновесия для реакции газа с твердым веществом для получения как твердого, так и газообразного продукта, например, как при реакции пара с горячим железом для получения газообразного водорода и оксида железа: H2O(г) + Fe(тв) ↔ H2(г) + FeO(тв), для которого он получил конкретный результат: (dS/dx) = q/T + ARln(p1/p3) + C = 0 [10] где p1 и p3 - равновесные давления газообразного реагента и газообразного продукта соответственно (обратите внимание на их инверсию относительно u1 и u3), а другие символы имеют то же значение, что и ранее. Наконец, Хорстман применил свой подход к реакции двойного замещения в фазе раствора: K2SO4(водн) + BaCO3(тв) ↔ K2CO3(водн) + BaSO4(тв) Используя данные и символику Гульдберга и Вааге, он показал, что его подход привел к выводу Джулиуса Тома Сена о том, что при равновесии эта реакция подчиняется соотношению: apq = p'q' [11] где p и q - равновесные концентрации реагентов, а p' и q' - равновесные концентрации продуктов. Это не следует путать с более ранним использованием Хорстманом тех же символов для других величин (2). Буква a в этом уравнении представляет нашу современную константу равновесия K, но только в том случае, если, как отметил Хорстман, зависимость концентрации разложения для растворенных веществ подчинялась закону, аналогичному закону для идеальных газов, и значения q и q' для нерастворимых карбоната и сульфата бария также оставались постоянными. Это первое условие более чем на десятилетие предвосхитило более позднюю работу Вант Гоффа (van’t Hoff) по теории разбавленных растворов и его знаменитую аналогию между осмотическим давлением и законом идеального газа (20). Подводя итог, мы видим, что все специфические особенности результатов Хорстмана при равновесии могут быть обобщены с помощью основного уравнения: (dS/dx) = q/T - ARlnK + C = 0 [12], хотя сам он никогда не делал заключительного шага, включив все свои конкретные соотношения концентрации и/или давления для газовых и растворных фаз в равновесии под одним обобщенным символом K. Сравнение с современным уравнением для свободной энергии Чтобы увидеть эквивалентность между результатом Хорстмана и нашим современным уравнением свободной энергии, необходимо сначала разделить последнее в состоянии равновесия на -T: -∆G/T= -∆H°/T + ∆S° - RlnK = 0 [13] и сравнить результат с уравнением 12 с надлежащим учетом результирующих изменений энтропии (21): ∆St = ∆Se + ∆Ss [14] где ∆Ss - энтропия изменения замкнутой химической реакционной системы, ∆Se - изменение энтропии окружающей среды, а ∆St – общее изменение энтропии для результирующей изолированной системы, соответствующее их сумме, откуда очевидно, что: ∆St = -∆G/T = dS/dx [15] ∆Se = -∆H°/T =q/T [16] ∆Ss = (∆S° - RlnK) = (C - ARlnK) [17] Отсутствие знака минус перед q в уравнении 16 отражает разницу в условностях знаков для теплоты реакции, как сформулировано Томсеном в 19 веке, и наших современных условностях для изменения энтальпии (6), тогда как наличие знака минус в уравнении 15 объясняет, почему максимизация общей энтропии соответствует минимизации свободной энергии и наоборот. Кем был Хорстманн? П 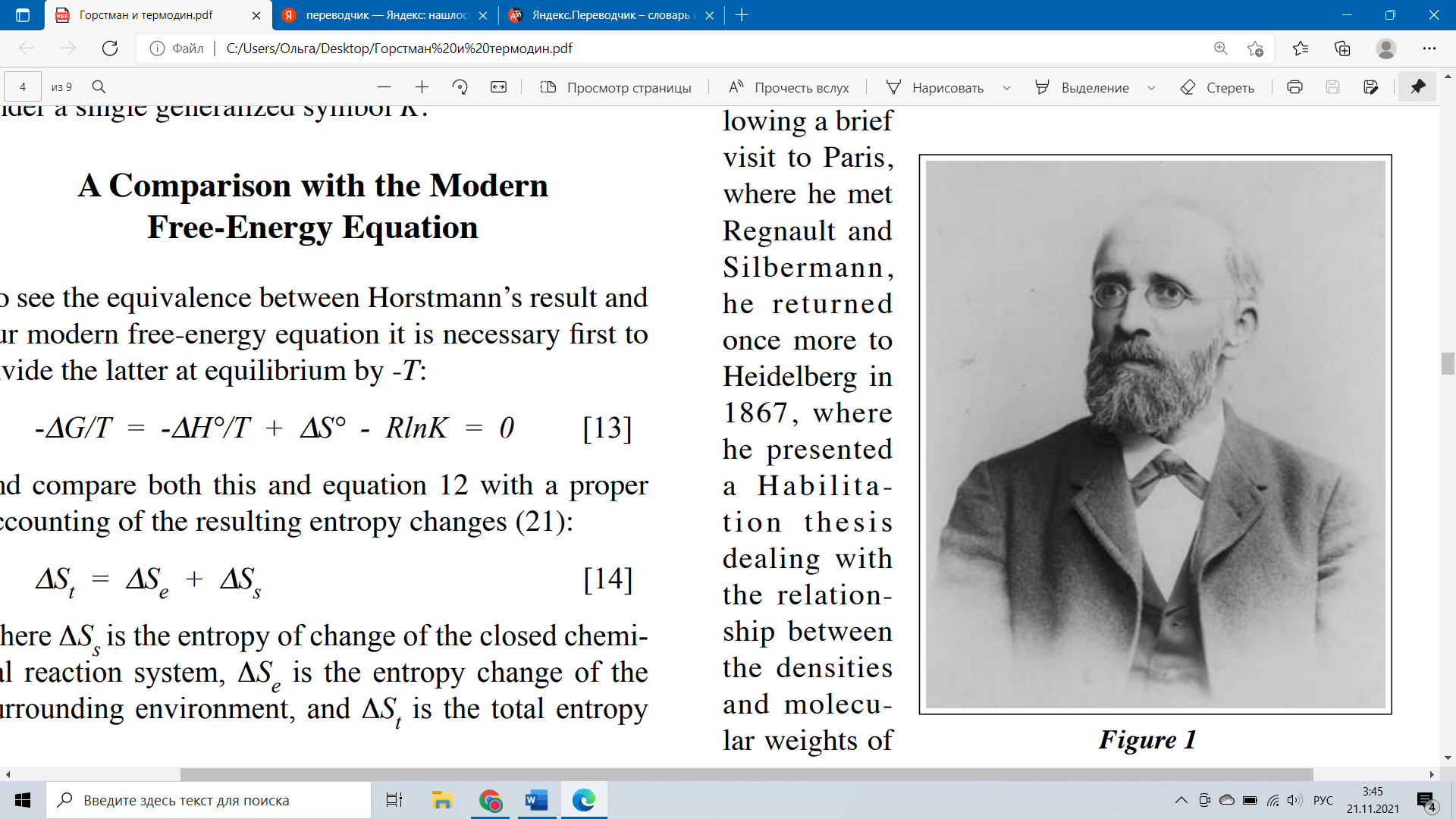 оскольку жизнь Хорстмана (рис. 1 и 2) недавно стала предметом отличной биографической монографии Александра Кипниса (Kipnis), все, что здесь требуется, - это краткое изложение ее основных положений (22). Август Фридрих Хорстман родился 20 ноября 1842 года в Маннгейме, Германия, в семье преуспевающих торговцев. Он поступил в Гейдельбергский университет в 1862 году, где, несмотря на присутствие таких просветителей будущей дисциплины физической химии, как Бунзен, Копп, Кирхгофф и Гельмгольц, (Bunsen, Kopp, Kirch-hoff, Helmholtz) он предпочел вместо этого изучать органическую и теоретическую химию в частной лаборатории Эмиля Эрленмейера (Erlenmeyer). Получив степень доктора философии в 1865 году, он закончил докторскую работу под руководством Рудофа Клаузиуса (Rudoph Clausius) в Цюрихе, где изучал термодинамику, и под руководством Ханса Ландольта (Hans Landolt) в Бонне, где он изучил методы экспериментального исследования давления паров летучих жидкостей. После краткого визита в Париж, где он встретился с Реньо (Regnault) и Зильберман (Silbermann), он снова вернулся к Гейдельбергу в 1867 году, где представил тезисы по абилитации, касающиеся отношения между плотностями и молекулярными весами паров и был назначен приват-доцентом. Там он оставался до конца своей жизни, в конце концов став профессором теоретической химии. Ему было 26 лет, когда он написал свою статью о диссоциации хлорида аммония в 1869 году, и 30 лет, когда он написал свою окончательную статью о теории диссоциации в 1873 году. Его продуктивность в последующие годы все больше снижалась из-за ухудшения зрения, и он был практически ослеп, когда умер в возрасте 86 лет 10 октября 1929 года. оскольку жизнь Хорстмана (рис. 1 и 2) недавно стала предметом отличной биографической монографии Александра Кипниса (Kipnis), все, что здесь требуется, - это краткое изложение ее основных положений (22). Август Фридрих Хорстман родился 20 ноября 1842 года в Маннгейме, Германия, в семье преуспевающих торговцев. Он поступил в Гейдельбергский университет в 1862 году, где, несмотря на присутствие таких просветителей будущей дисциплины физической химии, как Бунзен, Копп, Кирхгофф и Гельмгольц, (Bunsen, Kopp, Kirch-hoff, Helmholtz) он предпочел вместо этого изучать органическую и теоретическую химию в частной лаборатории Эмиля Эрленмейера (Erlenmeyer). Получив степень доктора философии в 1865 году, он закончил докторскую работу под руководством Рудофа Клаузиуса (Rudoph Clausius) в Цюрихе, где изучал термодинамику, и под руководством Ханса Ландольта (Hans Landolt) в Бонне, где он изучил методы экспериментального исследования давления паров летучих жидкостей. После краткого визита в Париж, где он встретился с Реньо (Regnault) и Зильберман (Silbermann), он снова вернулся к Гейдельбергу в 1867 году, где представил тезисы по абилитации, касающиеся отношения между плотностями и молекулярными весами паров и был назначен приват-доцентом. Там он оставался до конца своей жизни, в конце концов став профессором теоретической химии. Ему было 26 лет, когда он написал свою статью о диссоциации хлорида аммония в 1869 году, и 30 лет, когда он написал свою окончательную статью о теории диссоциации в 1873 году. Его продуктивность в последующие годы все больше снижалась из-за ухудшения зрения, и он был практически ослеп, когда умер в возрасте 86 лет 10 октября 1929 года. Почему он забыт? К концу 19-го века работа Хорстмана уже регулярно упоминалась в различных книгах по истории химии (23). В 1903 году его сборник статей по теории диссоциации был переиздан под редакцией Вант Гоффа в рамках серии Оствальда «Klassiker der exakten Wissenschaften» (24), и ему было предоставлено 25-страничное некрологическое уведомление в Ber. Dtsch. Chem. Ges. в 1929 году, а также многочисленные более короткие заметки в других журналах (25). Но в отличие от Гиббса, например, его имя практически исчезло из литературы по термодинамике 20-го и 21-го веков. Одной из важных причин такого пренебрежения является то, что Хорстман мало что сделал для распространения своего явного энтропийного подхода к химическому равновесию. Так, в важной словарной статье о «Диссоциации», которую он написал для издания 1876 года «Neues Handwörterbuch der Chemie» Фелинга, он подробно описал кинетическую теорию Пфаундлера, но пропустил ссылку на свою собственную работу 1873 года с комментарием, который невозможно было описать подробно (26). Хотя он опубликовал по меньшей мере еще восемь работ по теории диссоциации между 1876 и 1884 годами, он больше не упоминал о своем уравнении энтропии, а скорее вернулся к подходу, который он первоначально использовал в 1869 году, основанному на уравнении Клаузиуса-Клапейрона (15, 16). Только в своем учебнике 1885 года «Теоретическая химия» он снова сделал явное, хотя и краткое, упоминание о своей функции энтропии (27). Однако эта книга никогда не выходила за рамки первого издания и, насколько мне известно, никогда не переводилась на другие языки. Причины такого пренебрежения были достаточно просты. Все параметры в уравнении Клаузиуса-Клапейрона могут быть количественно оценены с использованием доступных экспериментальных данных, тогда как то же самое не относится к стандартному члену разделения (C) в энтропийной функции Хорстмана. Это произойдет только в первые десятилетия 20-го века, с появлением термодинамической программы количественной оценки, созданной Г.Н. Льюисом (Lewis) и его коллегами из Калифорнийского университета в Беркли, чтобы данные о количественной энтропии и свободной энергии стали широко доступными (28). Однако гораздо более важной причиной этого неувязки был тот факт, что химическое сообщество 19-го и начала 20-го века было крайне недовольно концепцией энтропии, и именно поэтому подход Хорстмана был уникальным. Привыкнув сегодня к молекулярной интерпретации энтропии как меры рассеивания кинетической энергии, основанной на квантово-статистической теории термодинамики, нам трудно оценить, насколько мало эта физическая точка зрения проникла в химические и инженерные круги на конец 19-го века и насколько абстрактным чисто феноменологическое определение, встречающееся в типичных учебниках того периода, казалось среднему студенту на химических и инженерных факультетах. Как сокрушался инженер Джеймс Суинберн (James Swineburne) в 1903 году (29, 30): В молодости я пытался читать термодинамику, но всегда сталкивался с энтропией как с кирпичной стеной, которая останавливала мой дальнейший прогресс. Конечно, я нашел обычное математическое объяснение, но в его основе не было никакой физической идеи. Ни один автор, казалось, не пытался дать какую-либо физическую идею. Испытывая в те дни большое уважение к учебникам, я пришел к выводу, что физический смысл должен быть настолько очевиден, что не нуждается в объяснении, и что я был особенно глуп в этом конкретном предмете... Через несколько лет я снова пытался заняться этой темой и снова всегда убивался идеей об энтропии. Я спрашивал других людей, но никогда не встречал никого, кто мог бы мне сказать об этом, но встретил одного инженера, который признался, что не знает. П 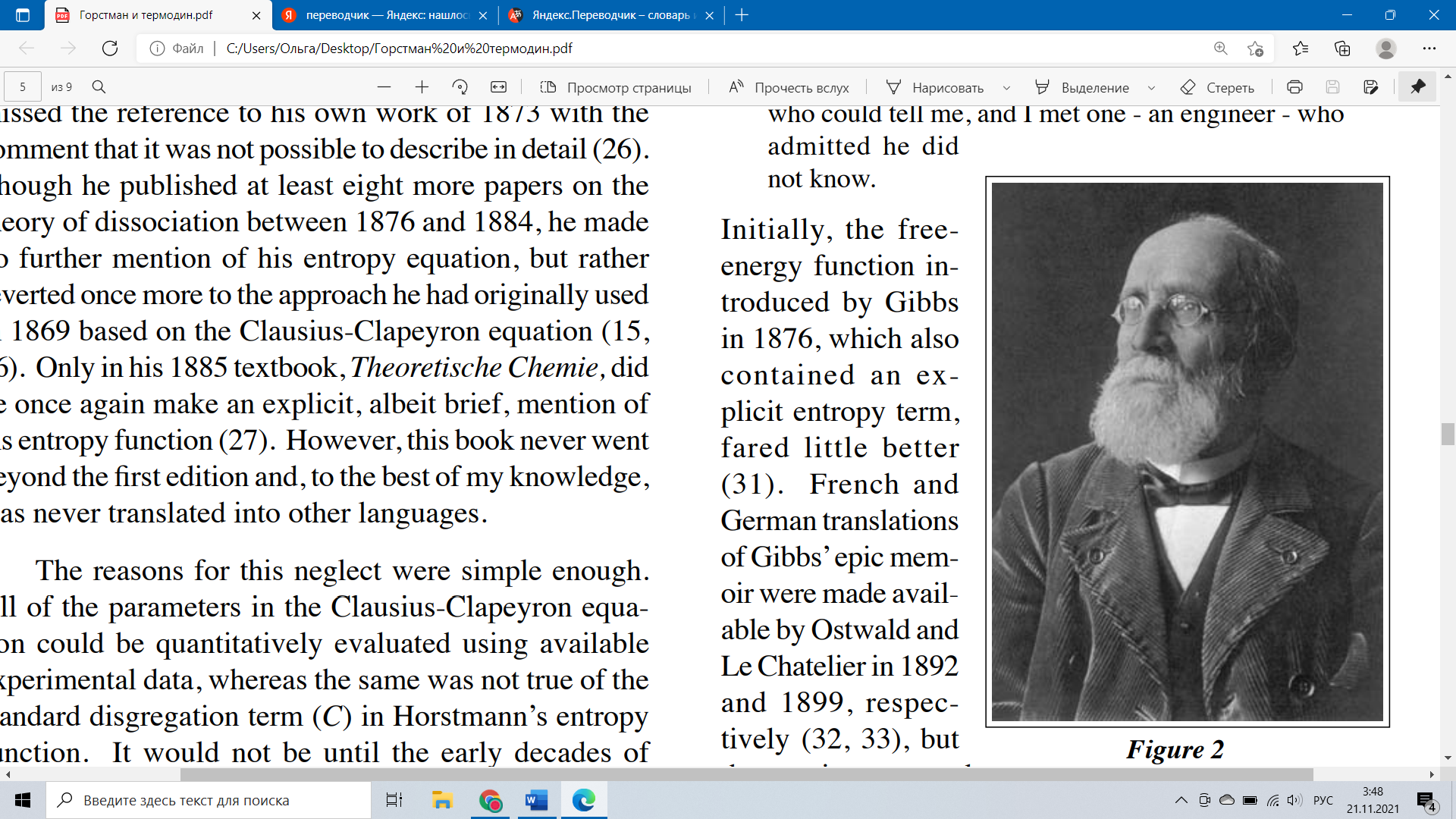 ервоначально функция свободной энергии, введенная Гиббсом в 1876 году, которая также содержала термин энтропии, работала немногим лучше (31). Французский и немецкий переводы эпических мемуаров Гиббса были предоставлены Оствальдом (Ostwald) и Ле Шателье (Le Chatelier) в 1892 и 1899 году соответственно (32, 33), но лаконичность и строгость математического подхода Гиббса сделали его работу в значительной степени недоступной для среднего химика. Хотя к 1920-м годам он стал виртуальной иконой среди физико-химиков, это было, как заметил Уайлдер Д. Бэнкрофт (Wilder D. Bancroft) в 1926 году, в значительной степени в результате того, что они ретроспективно раскрыли в своих мемуарах идеи и концепции, которые они открыли самостоятельно, пройдя гораздо менее строгий и более извилистый путь (34): ервоначально функция свободной энергии, введенная Гиббсом в 1876 году, которая также содержала термин энтропии, работала немногим лучше (31). Французский и немецкий переводы эпических мемуаров Гиббса были предоставлены Оствальдом (Ostwald) и Ле Шателье (Le Chatelier) в 1892 и 1899 году соответственно (32, 33), но лаконичность и строгость математического подхода Гиббса сделали его работу в значительной степени недоступной для среднего химика. Хотя к 1920-м годам он стал виртуальной иконой среди физико-химиков, это было, как заметил Уайлдер Д. Бэнкрофт (Wilder D. Bancroft) в 1926 году, в значительной степени в результате того, что они ретроспективно раскрыли в своих мемуарах идеи и концепции, которые они открыли самостоятельно, пройдя гораздо менее строгий и более извилистый путь (34):Знаменитая монография Дж. Уилларда Гиббса "Равновесие в гетерогенных системах" в некоторых отношениях является одной из самых замечательных научных статей, когда-либо написанных. Гиббс обладал удивительной и, по-видимому, безошибочной проницательностью, но ему было отказано в даре выражения. Не будет преувеличением сказать, что Гиббс писал иероглифами, и что большая часть его рукописей до сих пор не расшифрована. Теперь мы знаем, что можем найти в ней химический потенциал, правило фаз и теорию осмотического давления; теорию электродвижущих сил, равновесие Доннана и теорию эмульгирования. Мы уверены, что когда-нибудь найдем в ней теории, касающиеся всевозможных других вещей; но мы не знаем, когда мы их найдем. Раньше было популярно приписывать незначительное влияние, которое Гиббс тогда оказал на развитие физической химии, тому факту, что его монография была опубликована в трудах Коннектикутской Академии, но эту фикцию поддерживать нельзя. Сейчас все знают о Гиббсе; но единственный способ найти что-то новое в монографии Гиббса - это открыть это самостоятельно, а затем посмотреть тоже самое в ней. Хотя верно, что Планк (Planck) использовал явную функцию полной энтропии в своем учебнике по термодинамике 1897 года (35), и как Дюхем (Duhem) (36), так и Ван Лаар (van Laar) (37) ранее написали десять монографий, в которых приводились доводы в пользу использования функции свободной энергии Гиббса (1886, 1906), большинство химиков этого периода предпочитали вместо этого обсуждать термодинамику химического равновесия в терминах функций «Arbeit» или «Сродства» (A) и аналогов осмотического давления, пропагандируемых во влиятельных работах Вант Гоффа и Нернста (Nernst). Хотя математически они эквивалентны функциям Хорстмана, Планка и Гиббса, эти подходы полностью замаскировали роль функции энтропии в химических реакциях, сделав ее скорее неявной, чем явной. Таким образом, Нернст предпочитал использовать «более понятное» понятие максимальной работы (A) или свободной энергии Гельмгольца и всегда использовал ее температурный коэффициент (dA/dT), а не -∆S° при написании своей функции Сродства (38): -RTlnK = A = U + T(dA/dt) [18] Еще более эклектичным был Вант Гофф, который предпочел подход, формально аналогичный стандартному уравнению для взаимопревращения тепла и работы в паровом двигателе! (39): -RTln K = A = q(P -T)/P [19] где q - теплота реакции, P – равновесная температура для реакции (т. е. температура при A = 0), а T - фактическая температура, при которой протекает реакция. В других случаях он предпочитал использовать газовый закон и свое знаменитое уравнение для осмотического давления для расчета работы, необходимой для преобразования исходной системы в равновесную с помощью ряда расширяющихся и сжимающихся поршней и селективных осмотических мембран, собранных в воображаемом устройстве, известном как «коробка равновесия» (см. рис. 3) что напоминает знаменитый саркастический комментарий Льюиса и Рэндалла относительно так называемых «циклических процессов, хромающих вокруг эксцентричных и не совсем завершенных циклов» (28).  Действительно, неформальное исследование учебников по введению в физическую химию и химической термодинамике, опубликованных в период с 1893 по 1933 год, показало, что 70% предпочитают подход к работе, как у Нернста и Вант-Гоффа, в 22% используются свободные энергии Гиббса или Гельмгольца с данной в явном виде ∆S, 8% не используют ничего, и 40% не содержат записей со значком энтропии. И тут ещё стоит отметить, конечно, знаменитый учебник по химической термодинамике 1923 года Льюиса и Рэндалла в Соединенных Штатах (28), распространявшийся Хадлстоном (Hudleston) в Великобритании (40), которому как правило, приписывают то, что он, наконец, сделал ∆G и ∆S° неотъемлемой частью мышления каждого химика. Третья и последняя причина такого пренебрежения кроется в описании вклада Хорстмана, в среднестатистическом тексте по истории химии, написанного при его жизни (23) или впоследствии (41). Хотя все они признавали его вклад в теорию диссоциации и часто упоминали о его использовании уравнения Клаузиуса-Клапейрона, почти ни один из них, включая отчет о его жизни, появившийся в престижном справочнике научных биографий («Dictionary of Scientific Biography») (42), не привлек явное внимание к его новаторскому применению функции (dS/dx) к теории химического равновесия в целом. Исключением является статья 1952 года Эдуарда Фарбера (Eduard Farber), которая, по сути, впервые привлекла внимание настоящего автора к этой теме (43). Что посеешь, то и пожнешь Учитывая почти полное исчезновение Хорстмана из литературы по термодинамике 20-го века, несколько иронично, что несколько разработок в этой области за прошедшее столетие сильно перекликаются с оригинальным подходом Хорстмана: 1. Введение Де Дондером (De Donder) в 1920 году параметра степени реакции (ξ) и его замена в определенных ситуациях символа ∆G дифференциальным dG/dξ - различие, которое значительно проясняет взаимосвязь между терминами ∆St и ∆G в уравнении 15 и cобственное использование Хорстманном dS/dx (44): ∆St = -∆G/T = -(dG/dξ)/T = dS/dξ [20] Это неудачное двойное использование символа ∆ было охарактеризовано Бентом (Bent) в 1973 году как «сорняк в саду термодинамики» и с тех пор стало предметом некоторого интереса в литературе по химическому образованию (45). 2. Широкое использование с 1960-х годов качественной интерпретации энтропии молекулярного беспорядка на вводных курсах химии, как и оригинальная качественная интерпретация энтропии молекулярного беспорядка, используемая Клаузиусом и Хорстманом, в проблеме (\жалобе?) Суинберна «недостающая физическая основа». Конечно, ни беспорядочная, ни дезагрегантная интерпретации энтропии не являются абсолютно идентичными более сложной картине рассеивания энергии, представленной современной статистической механикой и, как неоднократно указывал Ламберт, картина беспорядка, в частности, может привести к ряду неверных выводов, если углубиться слишком сильно (46). 3. Предложение Розенберга и Клотца в 1999 году, заменить ∆G явной функцией полной энтропии, которую они назвали “функцией Планка” в честь Планка, использовавшего такой подход в своем учебнике 1897 года. С тех пор они также включили его в последнее издание своего собственного популярного текста по термодинамике (47, 48). Они, похоже, не знают, что этот подход уже использовался ван Лааром в его тексте по термодинамике 1893 года и что он уже окрестил его «потенциалом Планка» (37). Конечно, оба термина, как мы видели, исторически неточны, и более подходящим названием было бы функция Хорстмана или потенциал Хорстмана-Планка. Как известно любому историку, такие исторические искажения широко распространены в учебниках литературы, где они служат прекрасными примерами знаменитого закона эпонимии Стиглера (49). Кроме того, существуют проблемы с сопряжением этого подхода с теорией абсолютной скорости в химической кинетике, так как она требует, чтобы барьеры активации были заменены поглотителями энтропии (50). ССЫЛКИ И ПРИМЕЧАНИЯ ***** ОБ АВТОРЕ Уильям Б. Дженсен – профессор Университета Цинциннати, преподаватель по химическому образованию и истории химии на химическом факультете Университета Цинциннати, Цинциннати, OH 45221-0172, где он также является куратором университетской коллекции по истории химии. Победитель конкурса «Премия Эдельштейна за выдающиеся достижения в истории химии» в 2005 году. Его интересы включают историю физической и неорганической химии 19-го и 20-го веков, а также историю и развитие химического аппарата. Приложение Джозайя Уиллард Гиббс (Josiah Willard Gibbs) – {1839—1903} - американский физик, физикохимик, математик и механик, один из создателей векторного анализа, статистической физики, математической теории термодинамики, что во многом предопределило развитие современных точных наук и естествознания в целом. Основные работы Гиббса относятся к химической термодинамике и статистической механике, одним из основоположников которых он является. Признание пришло к учёному не сразу, потому что он публиковался в малочитаемом журнале «Transactions of the Connecticut Academy of Sciences». Лишь после того, как статьи Гиббса были переведены на немецкий и французский языки, его идеи получили широкое распространение в Европе. Август Фридрих Хорстман – статья посвящена деятельности и биографии этого ученого. Герман фон Гельмгольц (Hermann von Helmholtz) - {1821—1894} — немецкий физик, врач, физиолог, психолог, акустик. Среди огромного количества его научных достижений приведем лишь некоторые из них. В своих первых научных работах при изучении процессов брожения и теплообразования в живых организмах Гельмгольц пришел к формулировке закона сохранения энергии. Позже сформулировал законы сохранения энергии в химических процессах и ввел в 1881 году понятие свободной энергии — энергии, которую необходимо сообщить телу для приведения его в термодинамическое равновесие с окружающей средой. Гельмгольц способства признанию теории трёхцветового зрения Томаса Юнга, изобрел в 1850 году офтальмоскоп, офтальмометр и факоскоп. Установлением законов поведения вихрей для невязких жидкостей (1858) Гельмгольц заложил основы гидродинамики. Также он является автором ряда трудов в области физиологии — о нервной и мышечной системе. Джулиус (/Юлиус) Томсен (Julius Thomsen) - {1826—1909} - датский химик. Основные работы Томсена посвящены термохимии. Начиная с 1852 года Томсен выполнил термохимические исследования важнейших химических реакций. В 1853 году он разработал промышленный способ получения соды. В 1866 году Томсен сформулировал правило, согласно которому каждый простой или сложный химический процесс сопровождается тепловым эффектом, и в системе взаимодействующих веществ вероятен тот процесс, который протекает с наибольшим выделением теплоты. В 1882—1886 годах Томсен опубликовал фундаментальный труд «Термохимические исследования» (в 1908 году под названием «Термохимия» работа была переведена на английский язык). Рудольф Клаузиус (Rudolph Clausius) – {1822—1888} - немецкий физик, механик и математик. Славу Клаузиусу создали его работы по теоретической термодинамике, до него бывшей в младенческом периоде развития; лишь благодаря трудам Клаузиуса, одновременно с работами Джоуля, Гельмгольца и Ренкина, термодинамика получила окончательную разработку. В работе «О движущей силе теплоты и о законах, которые можно отсюда получить для теории теплоты», опубликованной в 1850 г., Клаузиус исправил теорию тепловых двигателей Карно, сформулированную автором в терминах теплорода, в соответствии с работами Джоуля о механическом эквиваленте теплоты, и сформулировал утверждение, которое позднее назвал тепловой аксиомой: «Теплота сама собой не может переходить от тела холодного к телу горячему». Тепловая аксиома Клаузиуса стала первой формулировкой второго начала термодинамики, ныне известной сейчас как формулировка Клаузиуса. В ряде последующих работ по механической теории тепла Клаузиус уточнил свою формулировку второго начала и доказал несколько новых теорем, носящих теперь его имя. Леопольд Пфаундлер фон Хадермур (Leopold Pfaundler von Hadermur) - {1839 – 1920} - австрийский физик и химик. Основные работы посвящены физической химии: диссоциации, определению теплоёмкости растворов и чистой воды, изучению охладительных смесей, определению молекулярного веса и т.д. Пфаундлер предложил объяснение механизма протекания обратимых реакций на основе кинетической теории газов. Известен несколькими орографическими работами в Альпах. Также он изобрел ряд научных приборов - устройств, которые он часто использовал в демонстрациях в классе. К ним относятся регулятор температуры, стромкалориметр, дифференциальный воздушный термометр, сейсмограф и дальномер. Бенуа Поль Эмиль Клапейрон (фр. Benoît Paul Émile Clapeyron) – {1799 – 1864} — французский физик и инженер. Физические исследования Клапейрона посвящены теплоте, пластичности и равновесию твердых тел. Он придал в 1834 году математическую форму идеям C. Карно, первым оценив большое научное значение его труда «Размышления о движущей силе огня», содержащего фактически формулировку второго начала термодинамики. Исходя из этих идей, впервые ввёл в термодинамику графический метод — индикаторные диаграммы, в частности предложил систему координат р-V. В 1834 году вывел уравнение состояния идеального газа, объединяющее закон Бойля — Мариотта, закон Гей-Люссака и закон Авогадро, обобщённое в 1874 году Д. И. Менделеевым (уравнение Менделеева — Клапейрона). Вывел уравнение, устанавливающее связь между температурой плавления и кипения вещества и давлением, которое было термодинамически обосновано в 1851 году Р. Клаузиусом (уравнение Клапейрона — Клаузиуса). Якоб Хендрик (Хенри) Вант-Гофф (Jacobus Henricus (Henry) van 't Hoff) – {1852 – 1911} — нидерландский химик, один из основателей стереохимии и химической кинетики, первый лауреат Нобелевской премии по химии (1901) с формулировкой «в знак признания огромной важности открытия законов химической динамики и осмотического давления в растворах». В 1884 году Вант-Гофф выпускает свою книгу «Очерки по химической динамике». Появление этой книги знаменует рождение физической химии как таковой. Вант-Гофф, по существу, впервые широко использовал здесь при трактовке химических процессов принципы термодинамики и математические методы. В 1886 г. Вант-Гофф публикует работу «Химическое равновесие в системах газов и разбавленных растворов». Основной её целью была попытка установить аналогии в законах, описывающих поведение газообразных систем и растворов. Вант-Гофф является одним из основателей стереохимии. Вильгельм Фридрих Оствальд (Wilhelm Friedrich Ostwald) – {1853 – 1932} — русский и немецкий физико-химик и философ. Лауреат Нобелевской премии по химии 1909 года «за изучение природы катализа и основополагающие исследования скоростей химических реакций».. Основные научные работы Оствальда посвящены развитию теории электролитической диссоциации. Обнаружил связь электропроводности растворов кислот со степенью их электролитической диссоциации. Дал способ определения основности кислот по электропроводности их растворов. Установил закон разбавления Оствальда (1888). Впервые описал явление Оствальдовского созревания. Предложил рассматривать реакции аналитической химии как взаимодействия между ионами. Оствальд изучал также вопросы химической кинетики и катализа; разработал основы каталитического окисления аммиака. Макс Карл Планк (Max Karl Planck) – {1858 - 1947} — немецкий физик-теоретик, основоположник квантовой физики. Лауреат Нобелевской премии по физике (1918). Научные труды Планка посвящены термодинамике, теории теплового излучения, квантовой теории, специальной теории относительности, оптике. Он сформулировал второе начало термодинамики в виде принципа возрастания энтропии и использовал его для решения различных задач физической химии. Применив к проблеме равновесного теплового излучения методы электродинамики и термодинамики, Планк получил закон распределения энергии в спектре абсолютно чёрного тела (формула Планка) и обосновал этот закон, введя представление о квантах энергии и кванте действия. Это достижение положило начало развитию квантовой физики, разработкой различных аспектов которой он занимался в последующие годы («вторая теория» Планка, проблема структуры фазового пространства, статистическая механика квантовых систем и так далее). Планк впервые вывел уравнения динамики релятивистской частицы и заложил основы релятивистской термодинамики. Ряд работ Планка посвящён историческим, методологическим и философским аспектам науки. Вальтер Герман Нернст (Walther Hermann Nernst) – {1864 – 1941} — немецкий физик и химик. Профессор и академик. Лауреат Нобелевской премии по химии (1920) «в признание его работ по термодинамике». Наибольшее значение из исследований Нернста имеют работы в области низких температур. В декабре 1905г. на заседании Геттингенского общества точных наук Нернст впервые изложил открытый им тепловой закон (третье начало термодинамики) и показал, что атомные теплоемкости твердых тел при очень низких температурах становятся чрезвычайно малы, а при абсолютном нуле свободная энергия равна тепловому эффекту, т. е. при Т = 0, энтропия также равна нулю. Им открыто одно из гальвано- и термомагнитных явлений, так называемое явление Нернста - появление разности потенциалов или температур, если проводник тока или тепла помещен в магнитное поле, перпендикулярное направлению тока. Нернсту принадлежит много работ по электрохимии и физической химии. В 1888 г. он опубликовал теорию электролитического растворения металлов, в которой установил связь между подвижностью ионов и коэффициентом диффузии электролита. Мысли о материале Благодарю за интересную статью. Полученная информация еще раз напомнила о сложностях поиска законов, в настоящий момент кажущихся столь простыми. Я восхищаюсь учеными, которые искали истину в вопросах термодинамики и находили ее по малым крупицам. Статья демонстрирует пример несправедливого отношения к трудам Хорстмана и предостерегает нас от умалчивания вклада каждого ученого в различные теории. В тоже время она показывает отсутствие тщеславия у Хорстмана (на том примере, что он даже не приводил ссылки на собственные статьи в своей же книге), что тоже может служить хорошим примером. При прочтении биографий ученых, упомянутых в статье несколько раз порой удивлялась, как много всего успели сделать эти люди в самых разных областях науки. Такие биографии могут служить отличным источником вдохновления. |
