Азотная кислота. Азотная кислота
 Скачать 455.51 Kb. Скачать 455.51 Kb.
|
  Муниципальное бюджетное общеобразовательное учреждение «Средняя школа №2 города Евпатории Республики Крым» Муниципальное бюджетное общеобразовательное учреждение «Средняя школа №2 города Евпатории Республики Крым»Реферат по химии На тему: Азотная кислота ученица 11-Б класса Щеглакова Анна 2018 год Содержание
Вступление Азо́тная кислота́ (HNO3) — сильная одноосновная кислота. Твёрдая азотная кислота образует две кристаллические модификации с моноклинной и ромбической решётками. Азотная кислота смешивается с водой в любых соотношениях. В водных растворах она практически полностью диссоциирует на ионы. Образует с водой азеотропную смесь с концентрацией 68,4 % и tкип120 °C при нормальном атмосферном давлении. Известны два твёрдых гидрата: моногидрат (HNO3·H2O) и тригидрат (HNO3·3H2O). Физические свойства Азотная кислота — бесцветная, дымящая на воздухе жидкость, температура плавления −41,59 °C, кипения +82,6 °C (при нормальном атмосферном давлении) с частичным разложением. Азотная кислота смешивается с водой во всех соотношениях. Водные растворы HNO3 с массовой долей 0,95-0,98 называют «дымящей азотной кислотой», с массовой долей 0,6-0,7 — концентрированной азотной кислотой. С водой образует азеотропную смесь (массовая доля 68,4 %, Tкип = 120,7 °C) При кристаллизации из водных растворов азотная кислота образует кристаллогидраты:
Твёрдая азотная кислота образует две кристаллические модификации:
Химические свойства Высококонцентрированная HNO3 имеет обычно бурую окраску вследствие происходящего на свету процесса разложения: 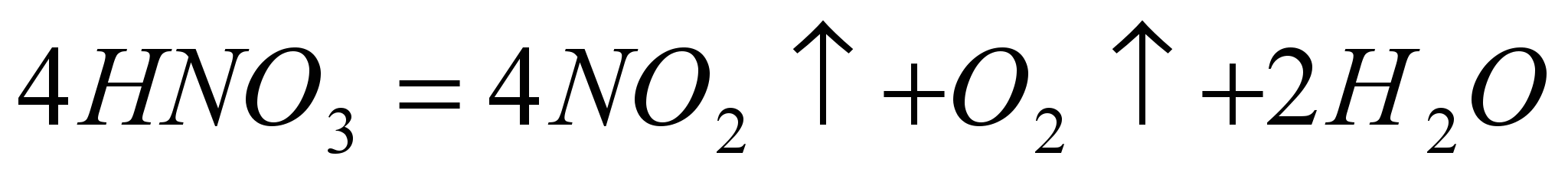 При нагревании азотная кислота распадается по той же реакции. Азотную кислоту можно перегонять без разложения только при пониженном давлении (указанная температура кипения при атмосферном давлении найдена экстраполяцией). Золото, некоторые металлы платиновой группы и тантал инертны к азотной кислоте во всём диапазоне концентраций, остальные металлы реагируют с ней, ход реакции при этом определяется её концентрацией. HNO3 как сильная одноосновная кислота взаимодействует: а) с основными и амфотерными оксидами: СuO+2HNO3 →Cu(NO3)2 +Н2О ZnO+2HNO3 →Zn(NO3)2 +Н2О б) с основаниями: KOH+HNO3→K NO3 +Н2О в) вытесняет слабые кислоты из их солей: CaCO3+2HNO3→Ca(NO3)2 +Н2О+CO2↑ При кипении или под действием света азотная кислота частично разлагается: 4HNO3→4NO3↑+O2↑+Н2О Азотная кислота в любой концентрации проявляет свойства кислоты-окислителя, при этом азот восстанавливается до степени окисления от +5 до −3. Глубина восстановления зависит в первую очередь от природы восстановителя и от концентрации азотной кислоты. Как кислота-окислитель, HNO3 взаимодействует: а) с металлами, стоящими в ряду активности правее водородa: Концентрированная HNO3  б) с металлами, стоящими в ряду активности левее водорода: 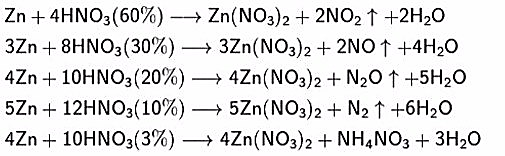 Все приведенные выше уравнения отражают только доминирующий ход реакции. Это означает, что в данных условиях продуктов данной реакции больше, чем продуктов других реакций, например, при взаимодействии цинка с азотной кислотой (массовая доля азотной кислоты в растворе 0,3) в продуктах будет содержаться больше всего NO, но также будут содержаться (только в меньших количествах) и NO2, N2O, N2 и NH4NO3. Единственная общая закономерность при взаимодействии азотной кислоты с металлами: чем более разбавленная кислота и чем активнее металл, тем глубже восстанавливается азот. С золотом и платиной азотная кислота, даже концентрированная, не взаимодействует. Железо, алюминий, хром холодной концентрированной азотной кислотой пассивируются. С разбавленной азотной кислотой железо взаимодействует, причем в зависимости от концентрации кислоты образуются не только различные продукты восстановления азота, но и различные продукты окисления железа:  Азотная кислота окисляет неметаллы, при этом азот обычно восстанавливается до NO или NO2:  Некоторые органические соединения (например амины, скипидар) самовоспламеняются при контакте с концентрированной азотной кислотой. Некоторые металлы (железо, хром, алюминий, кобальт, никель, марганец, бериллий), реагирующие с разбавленной азотной кислотой, пассивируются концентрированной азотной кислотой и устойчивы к её воздействию. Смесь азотной и серной кислот носит название «меланж». Азотная кислота широко используется для получения нитросоединений. Смесь трех объёмов соляной кислоты и одного объёма азотной называется «царской водкой». Царская водка растворяет большинство металлов, в том числе золото и платину. Её сильные окислительные способности обусловлены образующимся атомарным хлором и хлоридом нитрозила:  Нитраты Азотная кислота является сильной кислотой. Её соли — нитраты — получают действием HNO3 на металлы и некоторые соединения неметаллов, оксиды, гидроксиды или карбонаты. Все нитраты хорошо растворимы в воде. Нитрат-ион в воде не гидролизуется. Соли азотной кислоты при нагревании необратимо разлагаются, причём состав продуктов разложения определяется катионом: а) нитраты металлов, стоящих в ряду напряжений левее магния (исключая литий): 2KNO3→KNO2+O2 б) нитраты металлов, расположенных в ряду напряжений между магнием и медью (а также литий): 4Al(NO3)3→2Al2O3+12NO2+3O2 в) нитраты металлов, расположенных в ряду напряжений правее ртути: 2AgNO3→2Ag+2NO2+O2 г) нитрат аммония: NH4NO3→NO2+2H2O Нитраты в водных растворах практически не проявляют окислительных свойств, но при высокой температуре в твердом состоянии являются сильными окислителями, например, при сплавлении твердых веществ: Fe+KNO3+2KOH→K2FeO4+3KNO2+H2O Цинк и алюминий в щелочном растворе восстанавливают нитраты до NH3. Соли азотной кислоты — нитраты — широко используются как удобрения. При этом практически все нитраты хорошо растворимы в воде, поэтому в виде минералов их в природе чрезвычайно мало; исключение составляют чилийская (натриевая) селитра и индийская селитра (нитрат калия). Большинство нитратов получают искусственно. С азотной кислотой не реагируют стекло, фторопласт-4. Исторические сведения Методика получения разбавленной азотной кислоты путём сухой перегонки селитры с квасцами и медным купоросом была, по видимому, впервые описана в трактатах Джабира (Гебера в латинизированных переводах) в VIII веке. Этот метод с теми или иными модификациями, наиболее существенной из которых была замена медного купороса железным, применялся в европейской и арабской алхимии вплоть до XVII века. В XVII веке Глаубер предложил метод получения летучих кислот реакцией их солей с концентрированной серной кислотой, в том числе и азотной кислоты из калийной селитры, что позволило ввести в химическую практику концентрированную азотную кислоту и изучить её свойства. Метод Глаубера применялся до начала XX века, причём единственной существенной модификацией его оказалась замена калийной селитры на более дешёвую натриевую (чилийскую) селитру. Во времена М. В. Ломоносова азотную кислоту называли крепкой водкой. Производство азотной кислоты Современный способ её производства основан на каталитическом окислении синтетического аммиака на платино-родиевых катализаторах (процесс Оствальда) до смеси оксидов азота (нитрозных газов), с дальнейшим поглощением их водой 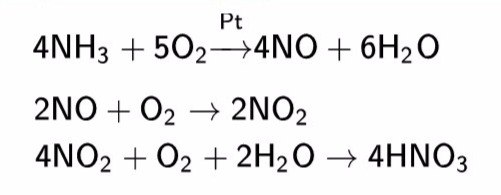 Все три реакции — экзотермические, первая — необратимая, остальные — обратимые. Концентрация полученной таким методом азотной кислоты колеблется в зависимости от технологического оформления процесса от 45 до 58 %. Для получения концентрированной азотной кислоты либо смещают равновесие в третьей реакции путём повышения давления до 50 атмосфер, либо в разбавленную азотную кислоту добавляют серную кислоту и нагревают, при этом азотная кислота, в отличие от воды и серной кислоты, испаряется. Впервые азотную кислоту получили алхимики, нагревая смесь селитры и железного купороса: Чистую азотную кислоту получил впервые Иоганн Рудольф Глаубер, действуя на селитру концентрированной серной кислотой: Дальнейшей дистилляцией может быть получена т. н. «дымящая азотная кислота», практически не содержащая воды. Применение
Воздействие на организм Азотная кислота по степени воздействия на организм относится к веществам 3-го класса опасности. Её пары очень вредны: пары вызывают раздражение дыхательных путей, а сама кислота оставляет на коже долгозаживающие язвы. При действии на кожу возникает характерное жёлтое окрашивание кожи, обусловленное ксантопротеиновой реакцией. При нагреве или под действием света кислота разлагается с образованием высокотоксичного диоксида азота NO2 Интернет-ресурсы https://ru.wikipedia.org/wiki/Азотная_кислота#Физические_и_физико-химические_свойства http://himege.ru/azotnaya-kislota-stroenie-i-ximicheskie-svojstva/ |
