|
|
технологическая карта. Типы химических реакций
Технологическая карта урока
ФИО учителя: Чельманова Наталья Владимировна
Место работы: МКОУ «Пителинская СОШ»
Должность: учитель
Предмет: химия
Класс: 8
Тема урока: «Типы химических реакций»
Тип урока: урок открытия нового знания.
Цель урока: создать условия для формирования у учащихся знаний о классификации химических реакций по числу и составу исходных веществ и продуктов реакции, для продолжения формирования умений учащихся составлять уравнения химических реакций.
Задачи урока:
Образовательные: обучающиеся должны повторить знания о химических реакциях, правилах их составления, законе сохранения массы веществ, изучить классификацию химических реакций, научиться определять их тип; продолжить формирование умений записывать уравнения.
Развивающие: обучающиеся должны продолжить работу по развитию интеллектуальных и мыслительных
умений (умение анализировать, сравнивать и обобщать); развивать познавательный интерес. совершенствовать умения школьников при составлении химических уравнений; совершенствовать умения учащихся сравнивать и обобщать; развивать память, устойчивое внимание, самостоятельное мышление, умение слушать и слышать другого человека; развивать аналитическое мышление.
Воспитательные: обучающиеся должны продолжить воспитывать культуру общения через работу в группах «ученик-ученик», «ученик-учитель»; воспитывать такие личностные качества, как внимание, наблюдательность, инициатива; проводить рефлексию собственной деятельности.
Формирование УУД:
1. Познавательные: 1. Осознать познавательную задачу.
2. Самостоятельно находить нужную информацию.
3. Осуществлять для решения данной проблемы операции анализа, синтеза, сравнения, классификации.
4. Устанавливать причинно – следственные связи.
5. Умение делать выводы и обобщения.
2. Личностные : 1. Умение управлять своей познавательной деятельностью.
2. Развитие умений самооценки.
3. Использование химических знаний.
4. Самоконтроль.
3. Регулятивные: 1. Умение ставить цель.
2. Способность в течении урока регулировать свою работу.
3. Прогнозирование.
4. Вносить необходимые коррективы.
5. Адекватно оценивать свои достижения.
4. Коммуникативные: 1. Умение участвовать в коллективном обсуждении проблемы, аргументировать свою
точку зрения.
2. Слушать и отвечать на вопросы других.
3. Умение организовать учебное сотрудничество.
4. Умение выражать свои мысли в соответствии с поставленными задачами.
Планируемый результат:
Учащиеся должны уметь: определять тип реакции по химическому уравнению.
Формы организации учебной деятельности: фронтальная, индивидуальная, групповая
Методы обучения: постановка и решение учебных проблем, беседа, метод классификации, самостоятельная работа, сравнение, частично –поисковый, тестовые задания.
Оборудование: учебник химии для 8 класса, проектор, презентация, инструктивные карточки.
УМК: Г.Е. Рудзитис, Ф.Г. Фельдман. Химия 8 класс.
Деятельность учителя
|
Деятельность учащихся
|
Формируемые УУД
|
Этап 1. Организационный.
|
Приветствует учащихся, создает эмоциональный настрой на урок.
- Добрый день, уважаемые гости и ребята! Если день начинать с улыбки, то можно надеяться, что он пройдет удачно. Давайте сегодняшнее занятие проведем с улыбкой. Главная задача – быть внимательными, активными, находчивыми, а главное – трудолюбивыми - показывать, что мы знаем и как умеем работать.
|
Приветствуют учителя, настраиваются на урок.
|
Личностные (смыслообразование)
Регулятивные (оценка, саморегуляция)
|
Этап 2. Проверка домашнего задания.
|
Предлагает выполнение упражнений по теме «Химические уравнения».
Фронтальный опрос.
- Что такое химическая реакция?
- Каковы признаки химической реакции?
-Что называют уравнением химической реакции?
- В чем отличие схемы реакции от уравнения реакции?
- Что называют исходными веществами и продуктами реакции?
- На основе какого закона составляют уравнения реакций?
Превратить схемы (даны на доске) в уравнения реакций. (Приложение 1)
Экспресс-тест. (Приложение 2)
|
Отвечают на вопросы учителя. Выполняют задания у доски и в тетради.
Выполняют самостоятельно тест.
|
Личностные (самоопределение)
Регулятивные (оценка, саморегуляция)
Коммуникативные (взаимоконтроль по ходу выполнения заданий)
|
Этап 3. Актуализация знаний и фиксирование индивидуального затруднения в пробном действии, выявление места и причины затруднения.
|
Предлагает заполнить схемы классификации, дать обоснование.(Слайды 1- 8)
Создание проблемной ситуации. (Cлайд 9) Предлагает заполнить схему, распределив химические реакции, записанные на доске. - Почему вы не можете справиться с заданием? - Каких знаний вам не хватает?
|
Проводят классификацию смесей, явлений, веществ, химических элементов. Обосновывают свои ответы.
Затрудняются выполнить задание учителя.
Сообщают о недостатке знаний и умений классификации реакций.
|
Познавательные
(анализ химических реакций с целью выявления отличий, умение классифицировать, самостоятельно выбирать основания и критерии для классификации, постановка и решение проблемы)
Коммуникативные (умение формулировать, аргументировать и отстаивать свое мнение)
|
Этап 4. Целеполагание.
|
Предлагает учащимся сформулировать цель урока.
Сообщает тему урока. (Слайд 10)
|
Формулируют цель урока.
Записывают тему урока в тетрадь.
|
Регулятивные (умение самостоятельно определять цели своего обучения)
|
Этап 5. Этап изучения новых знаний и способов деятельности.
|
- На сколько типов делятся все химические реакции? Составим схему.
Упрощает задание:
- разделите уравнения на 2 типа, ответ обоснуйте. (Cлайд 11)
С + О2 → СО2
2H2O → 2H2 + O2
Cu(OH)2 → CuO + H2O
CaO + CO2 → CaCO3
4NO2 + 2H2O + O2 → 4 HNO3
2KMnO4 → K2MnO4 + MnO2 + O2
(Слайд 12)
- Что общего в каждой группе? В чем различия?
Сообщает, что данные реакции относятся к двум типам: соединения и разложения.
Предлагает определить, где реакции соединения, а где разложения.
Предлагает заполнить схему в тетради.
- Попытайтесь сформулировать определения.
- Разделите уравнения на 2 типа, ответ обоснуйте. (Слайд 13)
Mg + H2SO4 → MgSO4 + H2
CuSO4 + Fe → FeSO4 + Cu
AgNO3 + NaCl → NaNO3 + AgCl
2HCl + K2S → 2KCl + H2S
2KOH + FeCl2 → Fe(OH)2 + 2KCl
CuO + H2 → Cu + H2O
(Слайд 14)
- Что общего в каждой группе?
Сообщает, что данные реакции относятся к двум типам: замещения и обмена.
Предлагает определить, где реакции замещения, а где обмена.
Предлагает заполнить схему в тетради.
- Попытайтесь сформулировать определения.
|
Отвечают на вопросы.
Составляют схему.
Отмечают количество и состав исходных веществ и продуктов реакции.
Формулируют определения.
|
Познавательные (поиск и выделение необходимой информации и структурирование знаний, анализ объектов с целью выделения признаков, логические универсальные действия)
Коммуникативные
(сотрудничество в поиске и сборе информации)
Регулятивные
( формирование умения слушать собеседника, проявлять познавательную инициативу в учебном сотрудничестве)
Личностные (смыслообразование)
|
Этап 6. Первичная проверка понимания изученного материала.
|
Предлагает вставить пропущенные слова в текст. (Слайды 15, 16)
|
Работают с текстом.
|
Познавательные (поиск и выделение необходимой информации и структурирование знаний, анализ объектов с целью выделения признаков)
|
Этап 7. Закрепление изученного материала.
|
Предлагает выполнить задание, вызвавшее затруднение в начале урока. (Слайд 17)
Предлагает взять карточки со стола и согласно этим карточкам разделиться на 4 группы. (Приложение 3)
- Почему так разделились?
Раздает задания каждой группе. (Приложение 4)
Проверка по ключевым словам: 1 группа – обмена, 2 группа – соединение, 3 группа – разложение, 4 группа – замещение.
Предлагает выполнить задание 75 стр. 21 в печатной тетради.
|
Классифицируют уравнения реакций.
Подходят к столу, берут карточки, делятся на группы.
Обосновывают действия.
Выполняют задания в группах и сообщают учителю результаты.
Выполняют упражнение в тетради и у доски.
|
Познавательные
( анализ объектов с целью выделения признаков)
Регулятивные
( формирование умения в сотрудничестве с учителем ставить новые учебные задачи)
Коммуникативные
(планирование учебного сотрудничества и способов взаимодействия, умение работать в группе, находить общее решение)
|
Этап 8. Информация о домашнем задании.
|
Предлагает домашнее задание: (слайд 18)
Для всех: § 21, № 2-17
По желанию: составить кроссворд или ребус по изученной теме.
|
Ученики выбирают задания.
|
Личностные (самоопределение)
Регулятивные (оценка, саморегуляция)
|
Этап 9. Подведение итогов учебного занятия. Рефлексия.
|
Анализирует работу класса, групп, нацеливает на формулирование выводов по уроку.
Инициирует рефлексию. (Приложение 5)
Благодарит за урок. (Слайд 19)
|
Делают выводы.
|
Регулятивные (оценка, саморегуляция)
|
Приложение 1.
H2 + O2 → H2O
K2O + H2O → KOH
Al(OH)3 → Al2O3 + H2O
CH4 → C + H2
Zn + HCl → ZnCl2 + H2
K + H2O → KOH + H2
NaOH + CuCl2 → Cu(OH)2 + NaCl
BaCl2 + H2SO4 → BaSO4 + HCl
Приложение 2.
Экспресс-тест потеме: «Химические уравнения»
Вариант 1
 Задание 1. Подчеркните схемы реакций, которые являются химическими уравнениями. Задание 1. Подчеркните схемы реакций, которые являются химическими уравнениями.
Ca + O2 → CaO
S + O2 → SO2
2CО + O2→2CO2
3NO + O2→3NO2
 Задание 2. Расставьте коэффициенты в следующих уравнениях реакций. Задание 2. Расставьте коэффициенты в следующих уравнениях реакций.
Ca + O2 → CaO
Al(OH)3 → Al2O3 + H2O
Na + H2O → NaOH + H2
ZnCl2 + H2SO4 → ZnSO4 + HCl
Вариант 2
 Задание 1. Подчеркните схемы реакций, которые являются химическими уравнениями. Задание 1. Подчеркните схемы реакций, которые являются химическими уравнениями.
2Ca + O2 → 2CaO
2S + O2 →2SO2
CО + O2→CO2
2NO + O2→2NO2
 Задание 2. Расставьте коэффициенты в следующих уравнениях реакций. Задание 2. Расставьте коэффициенты в следующих уравнениях реакций.
Fe + HCl → FeCl2 + H2
HgO → Hg + O2
HCl + Ca(OH)2 → CaCl2 + H2O
Mg + O2 → MgO
Приложение 3.
СuO + H2 → Cu + H2O
|
Mg + 2HCl → MgCl2 + H2
|
K3PO4 +3AgNO3 → Ag3PO4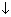 + 3KNO3 + 3KNO3
|
4P + 5O2 → 2P2O5
|
2Fe(OH) 3 → Fe2O3 + 3H2O
|
Fe + CuCl2→FeCl2 +Cu
|
NaOH + HNO3 → NaNO3 + H2O
|
2HgO → 2Hg + O2
|
Zn + H2SO4 → ZnSO4 + H2
|
ZnО + H2SO4 → ZnSO4 + H2О
|
MgО + 2HCl → MgCl2 + H2О
|
2Ca + O2 → 2CaO
|
Ba + S → BaS
|
Zn + S → ZnS
|
CaCO3 → CaO + CO2
|
Н2СО3 → Н2О + СО2
|
Приложение 4.
«Угадай слово» 1 группа
Уравнения реакций
|
Типы химических реакций
|
соединения
|
разложения
|
замещения
|
обмена
|
Mg + 2HCl → MgCl2 + H2
|
Б
|
В
|
О
|
З
|
2Fe(OH) 3 → Fe2O3 + 3H2O
|
Г
|
Б
|
К
|
Д
|
2Ca + O2 → 2CaO
|
М
|
Ж
|
С
|
Ф
|
K3PO4 + 3AgNO3 → Ag3PO4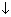 + 3KNO3 + 3KNO3
|
Н
|
У
|
Т
|
Е
|
2HgO → 2Hg + O2
|
А
|
Н
|
Р
|
П
|
Br2 + 2KI → 2KBr + I2
|
Ш
|
Л
|
А
|
И
|
«Угадай слово» 2 группа
Уравнения реакций
|
Типы химических реакций
|
соединения
|
разложения
|
замещения
|
обмена
|
2Ca + O2 → 2CaO
|
С
|
В
|
О
|
З
|
2Fe(OH) 3 → Fe2O3 + 3H2O
|
Г
|
О
|
К
|
Д
|
Ba + S → BaS
|
Е
|
Ж
|
С
|
Ф
|
K3PO4 + 3AgNO3 → Ag3PO4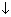 + 3KNO3 + 3KNO3
|
Н
|
У
|
Т
|
Д
|
Mg + 2HCl → MgCl2 + H2
|
А
|
Н
|
И
|
П
|
K2O + H2O → 2KOH
|
Н
|
Л
|
А
|
И
|
NaOH + HNO3 → NaNO3 + H2O
|
К
|
Р
|
Ф
|
Е
|
2HgO → 2Hg + O2
|
А
|
Н
|
Т
|
Ф
|
Zn + H2SO4 → ZnSO4 + H2
|
Л
|
Д
|
И
|
Ж
|
4P + 5O2 → 2P2O5
|
Е
|
У
|
Л
|
З
|
«Угадай слово»3 группа
Уравнения реакций
|
Типы химических реакций
|
соединения
|
разложения
|
замещения
|
обмена
|
K3PO4 + 3AgNO3 → Ag3PO4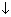 + 3KNO3 + 3KNO3
|
С
|
В
|
О
|
P
|
Mg + 2HCl → MgCl2 + H2
|
Г
|
О
|
А
|
Д
|
Ba + S → BaS
|
З
|
Ж
|
С
|
Ф
|
2Fe(OH) 3 → Fe2O3 + 3H2O
|
Н
|
Л
|
Т
|
Д
|
4P + 5O2 → 2P2O5
|
О
|
Н
|
И
|
П
|
Fe + CuCl2 → FeCl2 +Cu
|
Н
|
Л
|
Ж
|
И
|
NaOH + HNO3 → NaNO3 + H2O
|
К
|
Р
|
Ф
|
Е
|
2HgO → 2Hg + O2
|
А
|
Н
|
Т
|
Ф
|
Zn + H2SO4 → ZnSO4 + H2
|
Л
|
Д
|
И
|
Ж
|
CaCO3 → CaO + CO2
|
Д
|
Е
|
Л
|
З
|
«Угадай слово» 4 группа
Уравнения реакций
|
Типы химических реакций
|
соединения
|
разложения
|
замещения
|
обмена
|
СuO + H2 → Cu + H2O
|
С
|
В
|
З
|
P
|
Mg + 2HCl → MgCl2 + H2
|
Г
|
О
|
А
|
Д
|
K3PO4 + 3AgNO3 → Ag3PO4 + 3KNO3 + 3KNO3
|
З
|
Ж
|
С
|
М
|
4P + 5O2 → 2P2O5
|
Е
|
Л
|
Т
|
Д
|
2Fe(OH) 3 → Fe2O3 + 3H2O
|
О
|
Щ
|
И
|
П
|
Fe + CuCl2→FeCl2 +Cu
|
Н
|
Л
|
Е
|
И
|
NaOH + HNO3 → NaNO3 + H2O
|
К
|
Р
|
Ф
|
Н
|
2HgO → 2Hg + O2
|
А
|
И
|
Т
|
Ф
|
Zn + H2SO4 → ZnSO4 + H2
|
Л
|
Д
|
Е
|
Ж
|
Приложение 5.
Лист рефлексии
На уроке я работал …
Своей работой на уроке я …
Урок для меня показался…
За урок я…
Мое настроение…
Материал урока мне был…
|
активно/пассивно
доволен/не доволен
коротким/длинным
не устал/ устал
улучшилось/ухудшилось
понятен/не понятен
интересен/скучен
| |
|
|
 Скачать 52.68 Kb.
Скачать 52.68 Kb. Задание 1. Подчеркните схемы реакций, которые являются химическими уравнениями.
Задание 1. Подчеркните схемы реакций, которые являются химическими уравнениями. Задание 2. Расставьте коэффициенты в следующих уравнениях реакций.
Задание 2. Расставьте коэффициенты в следующих уравнениях реакций. Задание 1. Подчеркните схемы реакций, которые являются химическими уравнениями.
Задание 1. Подчеркните схемы реакций, которые являются химическими уравнениями. Задание 2. Расставьте коэффициенты в следующих уравнениях реакций.
Задание 2. Расставьте коэффициенты в следующих уравнениях реакций.