Бх задачи. Белка
 Скачать 118.76 Kb. Скачать 118.76 Kb.
|
|
Задача 1 Белки, осуществляющие транспорт молекул или ионов через мембрану, часто классифицируются как трансмембранные белки. Такие белки имеют в своей структуре область, заключенную в липидном бислое мембраны, и области, обращенные внутрь клетки (в цитоплазму) и во внеклеточное пространство. Исходя из классификации аминокислот по полярности радикала, предположите, какие аминокислоты должны преобладать в различных участках данного трансмембранного протеина. Ответ: Область белка, которая заключена в самой мембране – непролярная гидрофобная, следовательно, аминокислоты также будут неполярными гидрофобными (например, аланин, валин, лейцин и др), а область, которая выступает за пределы мембраны в цитоплазму или внеклеточную область будет полярной гидрофильной => аминокислоты будут такими же. Задача 2 Ниже приведены названия 19 природных белков и 7 функций которые они выполняют в организме. Назовите функцию, которую выполняет каждый из перечисленных белков. Результаты представьте в виде таблицы.
Ответ:
Задача 3 Найдите, в какой зоне рН (нейтральной, кислой или щелочной) лежит ИЭТ полипептида, состоящего из следующих аминокислотных остатков: арг-гис-глу-цис. В каком направлении будет двигаться данный пептид при разделении пептидов методом электрофореза в буферном растворе с нейтральным значением рН? Как изменится заряд и направление движения пептида в электрическом поле, если в составе пептида аргинин заменить лейцином? Ответ: ИЭТ пептида лежит в щелочной среде (арг (+) + гис (+) + глу (-) + цис (0) = +) Пептид будет двигаться к катоду (катод имеет отрицательный заряд, а пептид – положительный, среда нейтральная, значит, плюс двигается к минусу) Заряд пептида не изменится (лей (0) + гис (+) + глу (-) + цис (0) = 0) => пептид в нейтральной среде при электрофорезе двигаться будет к катоду Задача 4 Ожоги кожи, вызванные кислотами или щелочами заживают медленнее, чем механические повреждения кожи. Объясните возможные причины данного отличия. Ответ: кислоты и щёлочи взаимодействуют с белками кожи и нарушают их структуру. Белки, которые отвечают за заживление ран также подвергаются воздействию химических веществ и при этом их структура тоже нарушается и процесс заживления происходит очень медленно. При механическом повреждении кожи процесс заживления начинается сразу же, так как на белки, заживляющие раны нет такого воздействия, как при химическом ожоге. Задача 5 Объясните, почему биуретовым методом можно определить содержание белков, а не аминокислот в растворе. Как можно определить наличие отдельных аминокислот? Дадут ли одинаковую окраску с биуретовым реактивом 1000 молекул альбумина и 1000 молекул γ-глобулина? Обоснуйте Ваш ответ. Ответ: биуретовая реакция – реакция на пептидные связи (а они есть только в белках, в пробирке с отдельными аминокислотами окрашивания не будет). Альбумин состоит из одной полипептидной цепи, а гамма-глобулин из нескольких цепей. Значит в гамма-глобулине пептидных связей больше, следовательно, окраска будет более интенсивна. Задача 6 Чем объяснить возможное снижение растворимости белков при отщеплении от них пептидов (как в случае с пепсиногеном)? Для ответа: Дайте определение изоэлектрической точки белка. Как меняются свойства белков в изоэлектрической точке? Что такое растворимость белков, чем она обусловлена? Ответ: ИЭТ- значение pH, при котором поверхностный заряд белка равен нулю. В ИЭТ активность белка снижается, он выпадет в осадок Растворимость белков обусловлена ионизацией и гидратацией. Чтобы белок был растворим в воде, его должен облепить слой или слои молекул воды, это облегчает движение и растворимость белковой частице в воде. Образование таких оболочек называется гидратацией (чем больше таких оболочек из молекул воды, тем выше растворимость белка) Ионизация – общий заряд на поверхности белка. Радикалы полярных аминокислот притягивают воду => такие аминокислоты растворимые (чем больше заряженных радикалов, тем растворимее белок) Если мы отщепляем от белков пептиды, то мы отщепляем от них заряды, от которых как раз зависит растворимость белков. Оторвали один – растворимость снизилась, оторвали два – снизилась ещё сильнее и тд. Задача 7 Белки в организме человека подвергаются гидролизу до аминокислот, которые лишены антигенных свойств и не вызывают иммунных реакций. Почему у некоторых людей возникает иммунная реакция на прием белка (пищевая аллергия)? Ответ: Небольшую долю продуктов переваривания белка составляют негидролизованные короткие пептиды. У некоторых людей нарушена способность к их всасыванию, поэтому и возникает иммунная реакция. Задача 8 Протеиновые киназы фосфорилируют белки только по определенным гидроксильным группам в радикалах аминокислот. Какие из нижеперечисленных групп аминокислот содержат гидроксильные группы в радикале? 1. асп, глу, сер 2. сер, тре, тир 3. тре, фен, арг 4. лиз, арг, про 5. ала, асн, сер Ответ: 2 (так как в этом ряду каждая аминокислота имеет гидроксильную группу в радикале) Задача 9 Изучалась устойчивость двух разных ферментов (гексокиназы и рибонуклеазы) к действию температуры. Выяснилось, что при нагревании ферментов при температуре 50° в течение 15 минут гексокиназа теряет 70% своей активности, в то время как рибонуклеаза - только 30%. При сравнении структурной организации этих ферментов выяснилось, что рибонуклеаза содержит в своей структуре 4 дисульфидные связи. Исходя из приведенных выше данных, объясните отличия в устойчивости двух ферментов к тепловой денатурации. Ответ: Рибонуклеаза содержит 4 дисульфидных связи, которые являются самыми прочными в белке. При тепловой денатурации в белке разрушаются связи – сначала слабые, а после, с повышением температуры и прочные. Гексокиназа потеряла 70 процентов своей активности из-за наличия в своем составе преимущественного количества слабых связей, которые не выдержали температурного воздействия. Задача 10 Фермент изоцитратдегидрогеназа катализирует реакцию превращения изоцитрата в α-кетоглутарат. АТФ является отрицательным эффектором фермента, а АДФ - его положительным эффектором. Объясните механизм регуляции фермента. Дайте графическое изображение кинетики данной ферментативной реакции. Ответ: Механизм регуляции – химическая модификация (при присоединении или отщеплении от фермента каких-либо групп активирует или ингибирует активность фермента). При присоединении фосфатной группы (АТФ - донор) фермент становится инактивным, а при отщеплении (АДФ забирает себе группу и становится АТФ) фермент вновь преобретает активность.  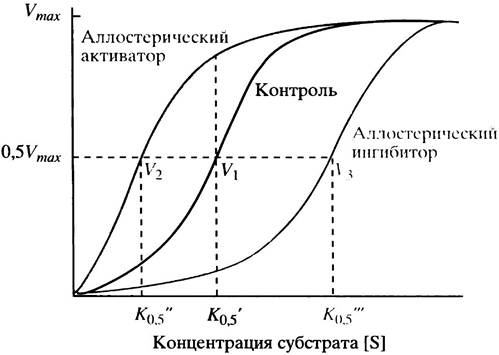 Задача 11 Фермент пепсин способен расщеплять пептидные связи белков. Почему воздействие пепсина приводит к инактивации многих ферментов? Для обоснования ответа вспомните: 1. Что такое ферменты? 2. К какому классу ферментов относится пепсин? 3. Какие аминокислоты (какие пептидные связи) подвергаются его действию? Ответ: Ферменты – глобулярные белки, обладающие каталитической активностью. Пепсин относится к классу гидролаз Пепсин расщепляет центральные пептидные связи в молекулах белков и пептидов. В основном он гидролизует пептидные связи, образованные аминогруппами ароматических аминокислот. Пепсин приводит к инактивации многих ферментов, тк он гидролизует белковую часть этих ферментов. Задача 12 Фосфорорганические соединения являются мощными ядами и обладают нервно-паралитическим действием. Симптомы отравления связаны с необратимым ингибированием ацетилхолинэстеразы (АХЭ), которая ускоряет гидролиз ацетилхолина, функционирующего в качестве нейромедиатора. Увеличение количества ацетилхолина в синаптической щели при ингибировании АХЭ приводит к стойкой деполяризации постсинаптической мембраны и может вызвать паралич. Объясните механизм ингибирования АХЭ. Ответ: механизм ингибирования – неконкурентый. Фосфорорганические соединения изменяют конформацию АХЭ, из-за чего фермент теряет свою активность. Задача 13 Протеолитические ферменты и дезоксирибонуклеазы используют для лечения гнойных ран. На чем основано их применение? Для ответа вспомните: 1. Какие реакции катализируют эти ферменты? 2. Как изменится вязкость гнойного содержимого, если она зависит от концентрации макромолекул в его составе? 3. Можно ли в этих целях использовать пепсин, коллагеназу и гиалуронидазу? Ответ: Эти ферменты катализируют реакцию гидролиза Вязкость уменьшится (если вязкость зависит от концентрации макромолекул, то при действии ферментов часть из них гидролизуется, следовательно, макромолекул станет меньше) Пепсин нельзя использовать, так как он действует только в кислой среде; гиалуронидаза, как следует из названия, разрушает гиалурон, который входит в состав кожи, поэтому её нельзя использовать, тк гной пройдет дальше в ткани; коллагеназа аналогично гиалуронидазе будет негативно влиять на кожу. Задача 14 Фермент киназа гликогенфосфорилазы в печени может находиться в двух формах с различной активностью: в виде простого белка и фосфопротеина. 1. Объясните, каким путем одна форма фермента переходит в другую? 2. Почему этот переход сопровождается изменением активности фермента? Ответ: Одна форма переходит в другую путём аллостерической модификации (присоединение фосфогруппы к ОН- группе протеина) Эффектор присоединяется к аллостерическому центру белка, в результате чего меняется конформация фермента => меняется его активность Задача 15 Метанол - очень токсичное соединение: прием внутрь 30 мл метанола может привести к смерти. Такая токсичность обусловлена действием формальдегида - продукта его превращения. Метанол окисляется под действием фермента печени - алкогольдегидрогеназы. Один из методов лечения при отравлении метанолом состоит в том, что больному назначают внутрь или внутривенно этанол в дозах, которые вызывают интоксикацию у здорового человека. Объясните, почему такое лечение эффективно? Ответ: При введении этанола внутривенно, он гораздо быстрее достигает печени и быстрее метанола начинает взаимодействовать с ферментом. Так как все ферменты «заняты» этанолом, метанол не распадается, следовательно, формальдегид не образуется и человек остается жив. Механизм ингибирования – конкурентный. Задача 16 Фермент лактатдегидрогеназа (ЛДГ) имеет 5 изоферментов и катализирует обратимую реакцию превращения пирувата в лактат. В таблице приведены величины Км для пирувата. В культуре клеток показано, что при снижении парциального давления кислорода в тканях повышается синтез М-субъединиц, а синтез Н-субъединиц практически не меняется. Объясните роль изоферментов ЛДГ в регуляции метаболизма. Как меняется состав изоферментов ЛДГ при недостатке кислорода? В каком направлении идет лактатдегидрогеназная реакция в этих условиях?
Ответ: Изоферменты – ферменты, катализирующие катализирующие одну и ту же реакцию, но цепи которых обладают разными физикохимическими свойствами; чаще всего являются органоспецифичными. Лактатдегидрогеназа – состоит из 4х субъединиц, ускоряет превращение молочной кислоты в пировиноградную При недостатке кислорода преобладает форма ЛДГ5, так как повышается синтез М единиц Лактатдегидрогеназная реакция в обоих условиях идёт в сторону образования молочной кислоты. Задача 17 Известно, что употребление в пищу сырых яиц может вызвать гиповитаминоз витамина Н. В составе яиц содержится белок авидин, который способен взаимодействовать с витамином Н и препятствовать его всасыванию в желудочно-кишечном тракте. Объясните, почему вареные яйца таким эффектом не обладают? Ответ: Если есть много сырых яиц, то будет много белка авидина, который связывается с витамином Н и не дает ему всасываться в кишечнике => возникает гиповитаминоз витамина Н. В варёных яйцах авидина нет, так как белок денатурирует при высоких температурах. Поэтому если мы кушаем варёные яйца, то витамин Н всасывается нормально и гиповитаминоз не возникает. Задача 18 Предположите, какой принцип положен в основу диагностики заболеваний органов человека с помощью определения активности ферментов в крови. Почему, выявляя активность некоторых ферментов в крови, можно получить дополнительные объективные данные для постановки диагноза больному (например, инфаркт миокарда, гепатит и т.п.)? Приведите примеры таких ферментов. Ответ: Каждый фермент в организме работает только в определенных местах и поэтому если фермент, который, например, работает в клетках сердца оказывается в крови, то это может свидетельствовать о нарушениях в работе организма Например, фермент лактатдегидрогеназа (ЛДГ) является тетрамером (каждый протомер может иметь 2 варианта, поэтому всего изоформ 5 штук). ЛДГ 1 и 2 характерны для сердца – их появление в крови свидетельствует об инфаркте миокарда, а 4 и 5 изоформы характерны для скелетной мускулатуры, их появление в крови свидетельствует о миопатии. Также при инфаркте миокарда в крови может быть обнаружен АСАТ. Задача 19 Сладкий вкус зёрен в свежесобранных початках кукурузы обусловлен высоким содержанием в них сахара. Кукуруза, которую продают через несколько дней после сбора, имеет более низкую сахаристость, так как около половины свободного сахара в зёрнах превращается в крахмал в течение одного дня хранения. Чтобы сохранить сладкий вкус свежесобранной кукурузы, очищенные початки помещают на несколько дней в кипящую воду (бланшируют), а затем охлаждают в холодной воде. Кукуруза, обработанная таким образом и хранящаяся в замороженном виде, сохраняет свой сладкий вкус. В чём, по Вашему мнению, биологическая основа такой технологии? Ответ: При кипячении разрушается белковая часть фермента, который катализирует превращение сахара в крахмал, и кукуруза дольше сохраняет свой сладкий вкус. Задача 20 Объяснить, почему препараты, содержащие кальций в сочетании с вит. Д эффективнее при восполнении недостатка кальция в организме, чем препараты, содержащие только кальций. Ответ: Витамин D в условиях организма превращается в гормон кальцитрол, который повышает всасывание кальция в кишечнике. Задача 21 Объясните, почему детям первого месяца жизни, особенно родившимся в осеннее-зимнее время, назначают дополнительный прием витамина Д? Ответ: у младенцев очень мало кальция в костях, из-за чего они очень эластичны. Чтобы усилить кальцификацию костей, врачи назначают прием витамина D, который в условиях организма превращается в гормон кальцитрол. Этот гормон увеличивает всасывание кальция в кишечнике, в результате чего кости укрепляются. Прием витамина D особенно необходим в осенне-зимнее время, так как в этот период года солнца очень мало и синтез витамина в организме снижен и необходимо его поступление извне. Задача 22 Чем обусловлено использование разных групп витаминов в БАДАх, применяемых в различных целях: омолаживающие и косметические, для улучшения памяти и работы мозга, стимулирующие иммунитет? Для ответа на вопрос перечислите основные функции витаминов и предположите, какие из них используют в данных целях. Ответ: Использование разных групп витаминов в БАДах обусловлено тем, что недостаток какого-либо одного витамина бывает редко + у многих разных витаминов схожи функции в организме и обладают одними и теми же эффектами Витамины выполняют важнейшие функции: участвуют в обмене веществ, контролируют баланс гормонов в организме, а также работу иммунной системы; они нормализуют процесс образования новых клеток крови, поддерживают эффективность работы нервной системы, участвуют в образовании зубной, костной, мышечной ткани. Омолаживающие и косметические: Прием витамина А предотвращает шелушение, уменьшает сухость кожи, делает ее более эластичной. Происходит омоложение клеток эпидермиса, что позволяет дольше сохранять кожу в прекрасном состоянии. Витамин Е обладает антиоксидантным эффектом, тем самым сохраняя молодость кожи. Для улучшения памяти и работы мозга: Фолиевая кислота известная также как витамин B9, участвует в синтезе красных кровяных клеток, благодаря чему увеличивается поступление кислорода к мозгу. Этот витамин используют для снижения скорости потери памяти, связанной со старением. Путем экспериментов доказано, что В12 поддерживает уровень гомоцистеина в крови на нужном уровне у здорового человека. Гомоцистеин – это амикислота, при нарушениях метаболизма которой, происходит увядание функций мозга. Данный витамин способен восстанавливать нервные волокна головного мозга, а следовательно — это отличный усилитель памяти. Стимулирующие иммунитет: Витамин А помогает хорошо работать иммунным клеткам — лимфоцитам и фагоцитам. Обеспечивает здоровье кожи и слизистых, а это барьеры от проникновения инфекций в организм. Сильные антиоксидантные свойства этого витамина препятствуют окислительному стрессу и повышают защиту клеток, в том числе иммунной системы, от свободных радикалов. Витамин С Стимулирует образование иммунных клеток-лейкоцитов, нейтрализует свободные радикалы и защищает клетки от повреждения Задача 23 Известно, что витамины, предназначенные для беременных, содержат очень малые дозы витамина А, или не содержат его вовсе. Прием ретинол-содержащих препаратов беременным строжайше запрещён. Объясните это. Ответ: Витамин А – жирорастворимый. Организм откладывает его излишки в печени, и это может оказывать токсическое действие на организм и приводить к повреждению печени. Чрезмерное количество витамина А во время беременности вызывает врожденные аномалии у плода. Задача 24 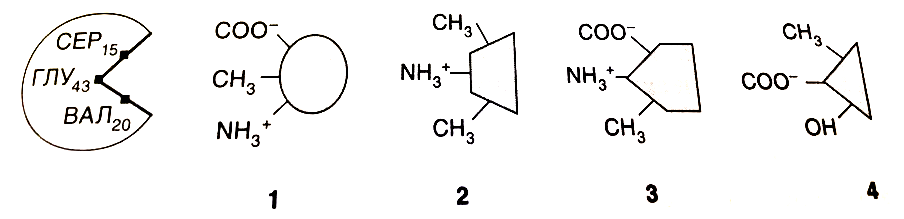 На рисунке представлена схема белка, состоящего из одной полипептидной цепи и имеющего активный центр, а также структуры четырех лигандов. Выберите из четырех представленных лигандов один, который с наибольшей вероятностью будет взаимодействовать с активным центром белка. Для этого: А) напишите формулы аминокислот, входящих в состав активного центра; Б) объясните, чем обусловлена специфичность связывания белка с лигандом; В) укажите, какие связи возникают между выбранным вами лигандом и активным центром; Г) дайте определение активного центра белка и объясните, на каком уровне структурной организации он формируется; укажите, какую роль играет активный центр в формировании белка; Д) объясните значение первичной структуры белка в формировании активного центра и приведите примеры влияния изменения первичной структуры белков на их активность. Ответ: а) Будет взаимодействовать с 3. б) Высокая специфичность взаимодействия белка с лигандом обеспечивается комплементарностью структуры активного центра структуре лиганда. Комплементарность-пространственное и химическое соответствие взаимодействующих поверхностей. Активный центр должен не только пространственно соответствовать входящему в него лиганду, но и между функциональными группами радикалов, входящих в АЦ, и лигандом должны образовываться связи, которые удерживают лиганд а АЦ. В) Между ГЛУ и NH3-ионные, ВАЛ и Ch3-гидрофобные. СЕР и COO-водородные Г) Участок, имеющий уникальное строение для данного белка и способный специфично взаимодействовать с определенной молекулой или группой похожих молекул, называется центром связывания белка с лигандом или активным центром. Д) Уникальная первичная структура белков человека, закодированная в молекуле днк, в клетках реализуется в виде уникальной конформации, структурны активного центра и функций белков. |
