Белки. ()БЕЛКИ-1. Белки Переваривание и всасывание. Анализ желудочного сока
 Скачать 414.5 Kb. Скачать 414.5 Kb.
|
1 2 Министерство здравоохранения Республики Беларусь Учреждение образования «Гомельский государственный медицинский университет» Кафедра биологической химии Обсуждено на заседании кафедры биологической химии Протокол № __________ МЕТОДИЧЕСКАЯ РАЗРАБОТКА Для проведения занятия со студентами 2 курса ФПСЗС по биологической химии (наименование дисциплины) Тема: Белки 1. Переваривание и всасывание. Анализ желудочного сока. Время 3ч. 1. УЧЕБНЫЕ И ВОСПИТАТЕЛЬНЫЕ ЦЕЛИ, МОТИВАЦИЯ ДЛЯ УСВОЕНИЯ ТЕМЫ; ТРЕБОВАНИЕ К ИСХОДНОМУ УРОВНЮ ЗНАНИЙ. Цель занятия: формирование представления о пищевой ценности белков, молекулярных механизмах их переваривания и всасывания в желудочно-кишечном тракте, путях формирования пула свободных аминокислот тканей и жидкостей организма. Освоение методов определения кислотности и патологических компонентов желудочного сока. В результате проведения занятия студент должен: 1) Знать: строение, классификацию и свойства аминокислот; уровни структурной организации белковой молекулы; механизм микросомального окисления; механизмы мембранного транспорта веществ. 2) Научиться проводить титриметрический анализ; проводить качественные реакции на кровь и молочную кислоту. 2. КОНТРОЛЬНЫЕ ВОПРОСЫ ИЗ СМЕЖНЫХ ДИСЦИПЛИН. 2.1. Структура и свойства белков и аминокислот (биоорганическая химия). 2.2. Строение пищеварительной системы (анатомия). 2.3. Механизмы регуляции деятельности желудочно-кишечного тракта (физиология). 2.4. Бактериальная микрофлора полостей ЖКТ (микробиология). 3.КОНТРОЛЬНЫЕ ВОПРОСЫ ПО ТЕМЕ ЗАНЯТИЯ. 1. Роль белков в питании. Полноценные и неполноценные белки. Нормы белка в питании. Заменимые и незаменимые аминокислоты. Азотистый баланс Роль белков в питании. Источники свободных аминокислот в клетке: белки пищи; собственные белки тканей; синтез аминокислот из углеводов. В организме человека в сутки распадается на аминокислоты около 400 г белков, примерно столько же синтезируется. Тканевые белки не могут восполнять затраты аминокислот при их катаболизме и использовании на синтез других веществ. Первичными источниками аминокислот не могут служить и углеводы, т.к. из них синтезируются только углеродная часть молекулы большинства аминокислот. Следовательно, основным источником аминокислот организма служат белки пищи. Полноценные и неполноценные белки. Все белки по биологической ценности подразделяются на 2-е группы: -условно полноценные -условно неполноценные. Факторы полноценности белка: 1) аминокислотный состав (чем ближе аминокислотный состав принимаемого с пищей белка к аминокислотному составу белков тела, тем выше его биологическая ценность); 2) усвояемость белка (зависит от аминокислотного состава и от степени гидролиза белка под действием ферментов ЖКТ. Ряд белков, близких по аминокислотному составу белкам тела - шерсть, волосы не используются в пищу, потому что не перевариваются протеиназами кишечника. Например, степень усвоения белка куриного яйца составляет 95% -мяса составляет 85% -молока - 70% 3) потребность организма в белках. Растительные белки не являются полноценными, т. к. они покрыты специфическими бета-гликозидными оболочками, а в организме нет ферментов, расщепляющих ее. Полноценными белками являются животные белки. Условно-полноценными считаются те белки, которые содержат 10 незаменимых аминокислот (эссенциальных):
Аргинин и гистидин являются частично заменимыми, т.к. синтезируются в организме в количестве удовлетворяющем потребность в этих АК взрослого организма, но не детского. Недостаток какой-либо одной аминокислоты ведет к неполному усвоению и других аминокислот. В этом случае вступает в силу закон "минимума" Либиха: "рост и развитие живых организмов определяется тем незаменимым веществом, которое поступает с пищей в минимальном количестве". Нормы белка в питании. (1г на 1 кг массы тела) Нормы белка для взрослого человека и для детей разного возраста учитывают разные климатические условия, условия труда, профессию, возраст и др. факторы. Для взрослого человека, занимающегося умственным трудом, уровень белка должен составлять 100-120 г/сутки. Для людей, занимающихся частично механизированным трудом -120-130 г/сутки. Рабочие, выполняющие тяжелую физическую работу, должны получать 130-150 г белка в сутки. Для детей суточная потребность в белках определяется возрастом и массой: 1-3 года ----> 55 г/сутки 4-6 лет ----> 72 -//- 7-9 -//- ----> 89 -//- 10-12 -//- ----> 100 -//- Суточные потребности в белках возрастают при беременности и лактации, при патологических состояниях, когда организм теряет белок с мочой, асцитной жидкостью, экссудатами (нефриты, ожоги, травмы). Заменимые и незаменимые аминокислоты В то время как растения и микроорганизмы могут синтезировать все аминокислоты, млекопитающие в ходе эволюции утратили способность к синтезу примерно половины из 20 протеиногенных аминокислот. Поэтому незаменимые аминокислоты должны поступать с пищей. Так, организм высших организмов не способен синтезировать ароматические аминокислоты de novo (тирозин не является незаменимой аминокислотой только потому, что может образоваться из фенилаланина). К незаменимым аминокислотам принадлежат аминокислоты с разветвленной боковой цепью: валин и изолейцин, а также лейцин, треонин, метионин и лизин. Гистидин и аргинин являются незаменимыми для крыс, но касается ли это также человека — спорно. Заменимые аминокислоты (аланин, аспарагиновая и глутаминовая кислоты и их амиды, аспарагин и глутамин) образуются в результате трансаминирования из промежуточных метаболитов — 2-кетокислот. Пролин синтезируется в достаточных количествах из глутамата, а представители серинового семейства (серин, глицин и цистеин) сами являются естественными метаболитами организма животных.
Азотистый баланс. Поскольку основная масса азота пищи представлена белками, принято считать, что для правильной оценки состояния белкового обмена точным критерием является определение азотистого баланса (АБ). АБ - соотношение количества поступившего с пищей белка к количеству продуктов метаболизма этого же белка, выраженное в г/сут. Здесь следует отметить, что количество пищевого азота (соответственно белка) можно легко и точно определить, т. к. 6,25г белка содержит 1г N2, то количество N2 умножают на 6,25 и получают количество белка, в то время как количество теряемого азота не всегда легко определить, поскольку на практике учитывают только азотистые продукты, выделяемые с мочой и калом, потерей азота с молоком, слюной, эпителием кожи, волосами пренебрегают. В возрасте от 30 до 45 лет при нормальном белковом питании наблюдается азотистое равновесие: АБ = 0. Бывает положительный АБ: количество поступившего с пищей азота (белка) больше, чем количество выделившегося азота (белка). ПАБ наблюдается при растущем организме, во время беременности, выздоровлении, отдыхе, почечной недостаточности. Бывает отрицательный АБ: количество выделяемого азота (белка) больше, чем количество поступившего. Наблюдается при голодании, физической нагрузке, опухолях, высокой температуре, у старых людей даже без видимой патологии. Соотношение белков, липидов и углеводов в детском организме:1:1:2, у взрослых - 4:1:1. 2. Обмен простых белков. Переваривание белков в ЖКТ. Состав и свойства желудочного сока. Значение компонентов сока в переваривании белков (HCl, пепсин, слизь и др.). Характеристика пепсина. Механизмы образования и секреции HCl в желудочном соке. Регуляция секреции HCl (роль гистамина, гастрина, ацетилхолина и др.). Обмен простых белков. Белки в организме, независимо от их функций, находятся в динамическом состоянии. Это значит, что они постоянно синтезируются и распадаются. Эти процессы названы белковым обменом. Существует необходимость замены белков, которые теряют свою биологическую активность путем окисления, денатурации и другими необратимыми модификациями. Скорость обмена разных белковых молекул различна. Некоторые белки, подобно иммуноглобулинам, имеют длинную жизнь, измеряемую годами, в то время как другие имеют короткую жизнь (в минутах). Эти процессы протекают в каждой клетке, но клетки некоторых тканей более активны, чем другие. Например, белки печени и кишечника обмениваются быстрее, чем белки скелетной мышцы. Синтез и распад белка необязательно протекает в одной и той же клетке. Некоторые клетки секретируют белки, которые затем работают и распадаются в другом месте (альбумин, антитела, ферменты, катализирующие процессы пищеварения, гормоны). Приблизительное содержание и обмен некоторых белков приводится ниже.
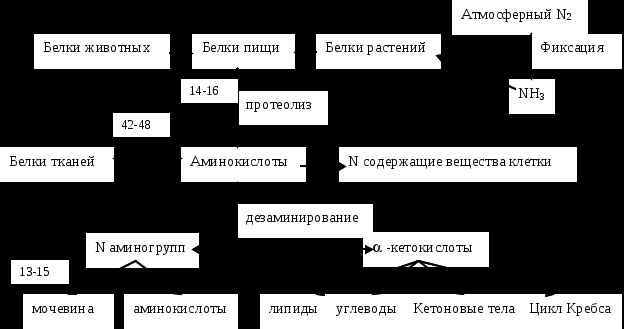 Схема обмена белков у человека. (Цифры на схеме показывают общее количество обмениваемого азота в граммах) Переваривание белков в ЖКТ. В желудочно-кишечном тракте под действием протеолитических ферментов происходит расщепление белков. Они имеют различную специфичность и последовательно гидролизуют белки до аминокислот. Для переваривания белков необходимы: Водный раствор с различным значением рН и концентрацией электролитов (создает условия, необходимые для оптимальной активности ферментов) Предшественники ферментов - протеолитические ферменты - синтезируются в виде неактивных предшественников (проферментов) и затем активируются в полости желудочно-кишечного тракта. Проферменты активируются путем ограниченного протеолиза. Слизь (мукопротеины) – высоковязкие растворы мукопротеинов действуют как смазочные средства, ускоряя прохождение пищи по ЖКТ. Переваривание белков осуществляется главным образом до аминокислот, в форме которых и происходит всасывание. Гидролиз химически сводится к разрыву пептидной связи. При расщеплении одной пептидной связи происходит снижение свободной энергии на 16,8 кДж. Протеолитические ферменты чувствительны: к размеру полипептида; к точке приложения гидролиза; к природе аминокислот, участвующих в образовании пептидной связи. Все белки подвергаются воздействию ограниченного числа протеолитических ферментов, относящихся к классу гидролаз (пептидаз). Известны 2-е группы пептидаз: экзопептидазы - катализируют разрыв концевой пептидной связи с освобождением одной какой-либо а/к; эндопептидазы - гидролизуют пептидные связи внутри полипептидной цепи, а также, в зависимости от природы а/к, и некоторые концевые пептидные связи. Состав и свойства желудочного сока. Значение компонентов сока в переваривании белков (HCl, пепсин, слизь и др.). Характеристика пепсина. Желудочный сок - бесцветная жидкость кислой реакции (pH =1-6). Главные компоненты - H2O (99%) и 1% сухой остаток. Соляная кислота: свободная (H+ и Cl-) и связанная форма (на поверхности частиц в форме хлоридов). HCl вместе с лактатом и ПВК формирует общую кислотность. Наличие лактата имеет диагностическое значение; повышение его содержания свидетельствует о раке желудка. Важнейшие органические компоненты, ферменты желудочного сока: 1. Пепсин (эндопептидаза), активен при pH = 0,8 - 5,4 (оптимум pH = 2,0). Обладает протеазным, пептидазным, транспептидазным действием. Очень активен (1г пепсина за 2 часа способен расщепить 50кг яичного альбумина). Неактивная форма - пепсиноген. В процессе активации HCl образуются пепсины 2-х групп:1-ая группа (их 5) образуется в своде желудка; 2-ая группа (их 3) - в привратнике. Из них собственно пепсинами называются ферменты, гидролизующие белки с максимальной скоростью при pH = 1,5 - 2,0. Другая фракция гидролизует белки с максимальной скоростью при pH = 3,2 - 3,5 и называется гастриксином. Отношение между пепсином и гастриксином составляет от 1:2,5 до 1:6.Пепсин и гастриксин отличаются изоэлектрическими точками и электрофоретической подвижностью. Пепсин расщепляет практически все природные белки, кроме некоторых кератинов, гистонов, протаминов и мукопротеидов. 2. Реннин (сычужный фермент - химозин) встречается преимущественно у детей. Его роль заключается в створаживании молока, т. е. он превращает растворимый казеиноген в нерастворимый казеин, кальциевая соль которого выпадает в осадок в виде творога: Ca2+ казеиноген -----------------> нерастворимый казеин (творог). реннин В желудке взрослого человека роль реннина выполняет пепсин. 3. Парапепсин (обладает желатиназным действием, в 140 раз сильнее пепсина). 4. Муцин - защитный фактор: обволакивает слизистую, защищая ее от действия HCl, выполняет роль сорбента, на котором иммобилизируется пепсин. 5. Муколизин - фактор, растворяющий слизь. Существует слизь 2-ух фаз: нерастворимой, или видимой, и растворимой. Нерастворимая слизь выполняет защитную функцию: она формирует защитный барьер, который препятствует контакту слизистой с содержимым желудка, ингибирует пепсин, нейтрализует HCl (за счет буферных свойств слизи). 6. Липаза - расщепляет эмульгированные жиры (молока) до глицерина и ЖК. 7. Амилаза - очень мало, имеет реинкреторное роисхождение (из плазмы крови). 8. Лизоцим - оказывает бактерицидное действие. 9. Ряд а/к, имеющих диагностическое значение. 10. Гликопротеид, необходимый для транспорта Vit B12. 11. Соли: хлориды, сульфаты, фосфаты, бикарбонаты, нитраты. 12. Ионы - K+, Na+, Ca2+, Mg2+, Cl-. 13. Патологические компоненты: молочная кислота и кровь. Образование желудочного сока осуществляется секреторным аппаратом слизистой, который представлен несколькими видами клеток: главные - продуцируют пепсиногены и химозин; обкладочные (париетальные) участвуют в образовании HCl: поставляют Cl-; добавочные - единственные клетки, продуцирующие сульфатированные мукополисахариды; слизистые (среди них млечные - камбиальные); эндокринные - 8 типов: ЕС - энтерохромаффинные (серотонин); ECL - энтерохромаффиноподобные (гистамин); G - гастриновые (гастрин); А - вырабатывают глюкагон; D - соматостатин; D1 - ВИП; P - бомбезин; PP - ПП. Гастрин имеет 4 формы: а) минигастрин (13 а/к); б) малый гастрин (17 а/к); в) большой гастрин (34 а/к); г) супер-гастрин. Гастрин - специфический стимулятор желудочной секреции, оказывает трофическое влияние на слизистую желудка, стимулирует выделение гистамина. Энтерогастрон, ваго-, бульбо-, сиало-, соматогастрон и гастрон тормозят желудочную секрецию и секрецию HCl. Бомбезин - стимулирует секрецию HCl, играет роль рилизинг фактора по отношению к другим гастроинтестинальным гормонам. ВИП - мощный ингибитор гастрина, подавляет секрецию HCl, сильный дилятатор. Гистамин - через аденилатциклазный механизм активирует карбоангидразу, участвующую в секреции HCl. ТТГ, АКТГ - стимуляторы желудочной секреции. СТГ - стимулирует слизеобразование. PG - в некотором роде оказывает действие сходное с действием гистамина. Механизмы образования и секреции HCl в желудочном соке. Секреция соляной кислоты обкладочными клетками является процессом активного транспорта (идет с затратой энергии АТФ). Диоксид углерода (СО2) диффундирует из крови в обкладочные клетки, где гидратируется (соединяется с молекулой воды) при участии карбоангидразы с образованием угольной кислоты, которая спонтанно диссоциирует на протон водорода Н+ и анион гидрокарбоната (НСО3-)..Протоны водорода Н+ транспортируются Н+/К+-АТФ-азой из цитоплазматического пространства обкладочных клеток в просвет желудка, при этом концентрация протонов в желудке возрастает примерно в 106 раз (концентрация Н+ в клетке примерно 10-7 M = рН 7, в просвете желудка примерно 10-1 M = рН 1). Равновесие ионов между кровью и обкладочными клетками достигается поступлением НСО3- в кровь в обмен на ионы Cl, поступающие из крови в гастроцит. Хлорид-ионы следуют за активно секретируемыми (при помощи Н+/К+-АТФ-азы)протонами через хлоридный канал в просвет желудка (для сохранения электронейтральности). 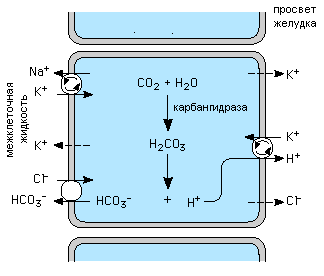 Минимальная скорость секреции HCl наблюдается с 5 до 11 утра. В норме общая кислотность желудочного сока должна составлять 40-60 ммоль/л (связанная HCl + свободная HCl). Свободная HCl - 20-40 ммоль/л, связанная HCl - 10-20 ммоль/л. Роль HCl. 1. Активирует пепсин: вначале осуществляется первичная активация пепсиногена с последующим превращением его в пепсин аутокаталитически (под действием активного пепсина). HCl Пепсиноген --------------> пепсин - 42 а/к От N- конца молекулы пепсиногена отщепляется 42 а/к остатка, что составляет 5 нейтральных пептидов и один щелочной пептид, который считается ингибитором пепсина. 2. Создает оптимум pH для действия ферментов желудочного сока. (pH = 1,5 _+ 0,5) 3. Обладает бактерицидным действием (является своего рода фактором неспецифической защиты организма). 4. Принимает участие в денатурации белков и их набухании. 5. Участвует в створаживании молока. 6. Осуществляет декальцинацию костей. 7. Стимулирует секреторную, моторную и гормональную деятельность ЖКТ. 8. Ускоряет всасывание железа. 9. Активирует образование гастрина из прогастрина. Регуляция секреции HCl (роль гистамина, гастрина, ацетилхолина и др.). Механизм секреции HCl находится под контролем инсулина и гистамина. Секреция соляной кислоты стимулируется гистамином через H2 рецепторы, ацетилхолином через M3 мускариновые рецепторы, и гастрином, частично через гастриновые рецепторы в мембранах париетальных клеток. H2 рецепторы увеличивают внутриклеточный цАМФ при участии Gs белков, а мускариновые и гастриновые рецепторы проявляют свои эффекты, увеличивая концентрацию внутриклеточного свободного Ca2+. Действие одного из указанных регуляторов обычно потенцируeт ответ другого на возбуждение. Простагландины, особенно E ряда, ингибируют секрецию кислоты, активируя Gi (ингибирующие) белки, и это объясняет частично повышение риска язвенной болезни у людей, принимающих антивоспалительные препараты, которые ингибируют синтез простагландинов. Циклическая АМФ и Ca2+ действуют через протеинкиназы, повышая транспорт H+ в желудочный просвет H+-K+ АТФазой. 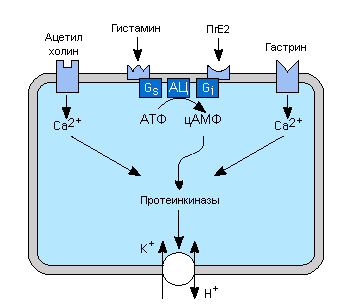 Гипоацидоз наблюдается: при недостатке инсулина; при дефиците Vit B1; при нарушении энергообразовательных процессов. Кишечный сок. Его состав и свойства. Характеристика панкреатических и кишечных ферментов. Механизм активации трипсина, химотрипсина и др. Переваривание в кишечнике иногда называют панкреатическим перевариванием, поскольку основные ферменты образуются и секретируются поджелудочной железой. Панкреатический сок содержит ферменты, которые несут основную функцию в переваривании белков. Панкреатический сок - бесцветная жидкость щелочной реакции pH = 7,8 - 8,4. Щелочность обусловлена наличием бикарбонатов, концентрация которых изменяется прямо пропорционально скорости секреции. Источником бикарбонатов является как бикарбонат плазмы крови, так и образующийся CO2 в pancreas в результате окисления. Неорганические компоненты: Na+, K+, Mg2+, Ca2+, Cl-. Органические компоненты, главным образом ферменты: 1. Трипсин (эндопептидаза, гидролизует пептидные связи, образованные карбоксильными группами основных аминокислот - лиз и арг). Трипсин - активная форма трипсиногена. Первичная активация трипсиногена осуществляется энтерокиназой и заключается в отщеплении от N-конца 6 а/к: ВАЛ - (АСП)4 - ЛИЗ. В дальнейшем аналогичный процесс происходит под действием активного трипсина, т. е. путем аутокатализа. При этом происходит формирование активного центра и трехмерной структуры трипсина. Ca2+ Трипсиноген -----------------------------> трипсин энтерокиназа Такой механизм активации называется частичным (ограниченным) протеолизом. Он имеет большое биологическое значение: 1) исключает самопереваривание органа; 2) обеспечивает более тонкую регуляцию количества фермента. Если бы трипсин вырабатывался в активной форме в pancreas, то он бы оказывал протеолитическое воздействие на клетки железы, вызывая некроз, что и наблюдается при остром панкреатите. В этом случае трипсин появляется в крови и его определение в сыворотке крови, является надежным ферментным тестом в диагностике острого панкреатита. 2. Химотрипсин (эндопептидаза, гидролизует пептидные связи, образованные карбоксильными группами ароматических аминокислот (фен, тир, три). . Химотрипсин бывает нескольких разновидностей (альфа, бета, гамма, пи), но это все различные кристаллические формы одного и того же белка. Они синтезируются из двух предшественников - химотрипсиногенов А и В. Они активируются первоначально под действием трипсина и впоследствии под действием химотрипсинов аутокаталитически. Получены доказательства, что разрыв одной пептидной связи между АРГ и ЛЕЙ в молекуле химотрипсиногена А под действием трипсина приводит к формированию пи-химотрипсина, обладающего наибольшей ферментативной активностью. Последующее отщепление серил-аргинина приводит к образованию бета-химотрипсина. Аутокаталитическая активация приводит к образованию вначале неактивного неохимотрипсина, который под действием трипсина превращается в альфа-химотрипсин. Альфа-химотрипсин образуется из бета-химотрипсина под действием активного химотрипсина. Химотрипсин обладает более широкой субстратной специфичностью, чем трипсин. Он катализирует гидролиз не только пептидов, но и эфиров, амидов. 3. Эластаза (эндопептидаза, гидролизует пептидные связи, образованные карбоксильными группами маленьких алифатичеких аминокислот (гли, ала, сер). Выделяется в виде проэластазы и активируется трипсином. Гидролизует пептидные связи эластина. 4. Карбоксипептидазы (экзопептидазы). Представлены двумя видами: А и В. А - разрывают преимущественно связи, образованные С-концевыми ароматическими а/к, В - катализируют отщепление С-концевых остатков диаминокислот: АРГ и ЛИЗ. А и В карбоксипептидазы активируются трипсином. А - обладает бифункциональной активностью - пептидазной и эстеразной и содержит ион Zn2+. При замене Zn на Ca происходит полная потеря пептидазной активности и усиление эстеразной. 5. Альфа-амилаза - расщепляет альфа-1,4 -гликозидные связи, активируется ионами Ca2+, которые повышают устойчивость фермента к изменению температуры и pH. 6. Липаза. Гидролизует эфирные связи липидов, имеет гидрофильную и гидрофобную части и действует на границе раздела: вода-жир, ее действие усиливается желчью. 7. Фосфолипаза. Гидролизует эфирные связи фосфолипидов, активируется трипсином. 8. Рибонуклеаза и дезоксирибонуклеаза - гидролизуют ДНК и РНК до нуклеотидов. Кишечный сок состоит из жидкой и плотной частей. Жидкая часть (pH = 7,2-7,5) содержит 98% воды и 2% сухого остатка (Na+, K+, Mg2+, Cl-, НСО3-). Уровень pH находится в прямой зависимости от скорости секреции сока и при интенсивной секреции достигает 8,6. Плотная часть - в основном ферменты (около 20). 1. Энтерокиназа (является структурным белком мембраны энтероцитов и катализирует превращение трипсиногена в трипсин, запуская каскад протеолитических превращений и активирование всех панкреатических проферментов). 2. Лейцинаминопептидаза и аланинаминопептидаза. Первый не обладает строгой субстратной специфичностью, гидролизует любые пептиды. Второй преимущественно катализирует отщепление аланина от N-конца пептида. 3. Дипептидазы. Глицин-глицин-дипептидаза, гидролизующая соответствующий дипептид до 2-х остатков глицина. Пролиназа гидролизует пептидную связь, в образовании которой принимает участие COOH-группа пролина. Пролидаза гидролизует дипептиды, в которых N-пролин связан кислотно-амидной связью. 4. Катепсины - расщепляют белки в дистальном отделе тонкой кишки, где есть слабокислая среда, обусловленная действием микрофлоры. 5. Щелочная фосфатаза - гидролизует моноэфиры ортофосфорной кислоты (в pH >7). 6. Кислая фосфатаза - выполняет ту же функцию, но в кислой среде. 7. Нуклеаза - деполимеризует НК. 8. Нуклеотидаза - дефосфорилирует мононуклеотиды. 9. Фосфолипаза и липаза – гидролиз фосфолипидов и липидов. 10. Холестеринэстераза - расщепляет эфиры холестерина. 11. Сахараза - расщепляет сахарозу и мальтозу. 12. Лактаза - гидролизует лактозу. 13. Олиго-1,6-гликозидаза - завершает гидролиз амилопектина и гликогена. 14. Амилаза - в незначительных количествах. 4. Значение градиента pH соков ЖКТ в переваривании белков. Механизмы переваривания белков и всасывания аминокислот в ЖКТ. Роль pH различных отделов ЖКТ. Механизмы переваривания белков
Продуктами переваривания белков в желудочно-кишечном тракте является смесь из аминокислот, и олигопептидов Олигопептиды, образованные в процессе гидролиза белков в просвете кишечника, в дальнейшем гидролизуются специфическими олигопептидазами (экзопептидазы, дипептидазы), локализованными в мембранах щеточной каемки энтероцитов. Конечные продукты пристеночного пищеварения — свободные аминокислоты, ди- и трипептиды. Механизмы всасывания аминокислот 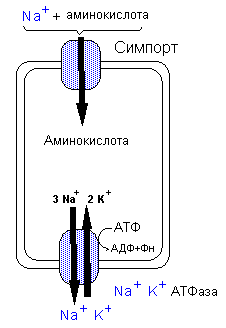 Аминокислоты частично всасываются подобно Гл, вместе с ионами Na+(вторично активный транспорт), частично путем облегченной диффузии. Аминокислоты частично всасываются подобно Гл, вместе с ионами Na+(вторично активный транспорт), частично путем облегченной диффузии. В механизмах поступления аминокислот в клетки важная роль отводится глутатиону. Одним из механизмов переноса аминокислот через клеточные мембраны является процесс, получивший название гамма-глутамиловый цикл. В основе его лежит реакция катализируемая гамма -глутамилтранспептидазой Этот ферментявляется структурным компонентом мембран и обеспечивает взаимодействие глутатиона с поступающей в клетку аминокислотой. Реакция с аминокислотой высвобождает цистеил-глицин из глутатиона, а образующийся дипептид (гамма-глутамил-аминокислота) транспортируется в клетку и гидролизуется там с высвобождением переносимой аминокислоты. Глутамат при этом превращается 5-оксопролин, а цистеил-глицин распадается до аминокислот. Последующие реакции включают энергозависимую регенерацию глутатиона, включающую превращение 5-оксопролина в глутаминовую кислоту (1 моль АТФ) и синтез трипептида в две последовательные реакции (2 моля АТФ). Этот процесс, таким образом, требует больших энергетических затрат, но обладает высокой скоростью и емкостью. Наиболее активен этот механизм при реабсрорбции аминокислот эпителием канальцев почек. 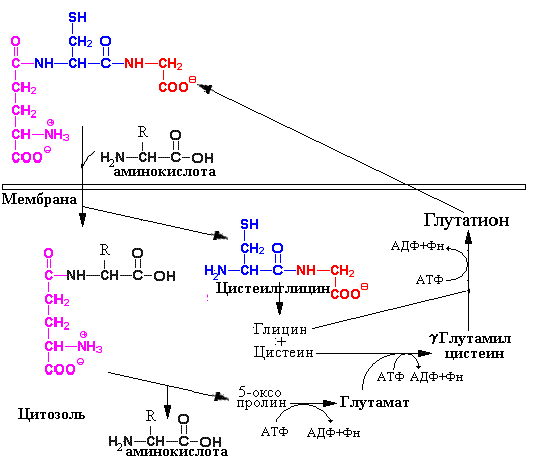 Схема участия глутатиона в механизме транспорта аминокислот через мембраны (гамма –глутаминовый цикл) Медиаторы и гормоны ЖКТ - гистамин, серотонин, секретин, холецистокинин, гастроингибирующий пептид, соматостатин, глюкагон, энкефалины и др.
6. Гниение белков в толстом кишечнике. Обезвреживание продуктов гниения в печени. Часть аминокислот не всасывается и подвергается процессам гниения с участием микрофлоры в толстом кишечнике. Продукты гниения аминокислот могут всасываться и попадают в печень, где подвергаются реакциям обезвреживания. За счет деятельности микрофлоры толстого кишечника а/к подвергаются гниению с образованием ядовитых продуктов: при распаде серусодержащих а/к (цистина, цистеина и метионина) образуются H2S и метилмеркаптан (CH3SH). Диаминокислоты, в частности орнитин и лизин, подвергаются декарбоксилированию с образованием протеиногенных аминов (трупных ядов).  При разрушении фенилаланина, тирозина, триптофана, образуются соответствующие биогенные амины: фенилэтиламин, триптамин, серотонин. При разрушении этих же аминокислот могут образовываться крезол, фенол, скатол, индол, бензол. 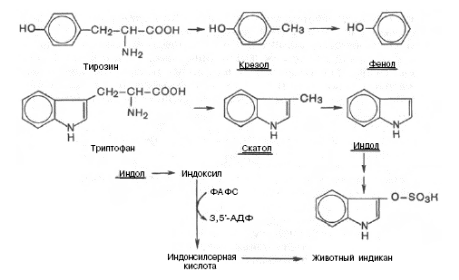 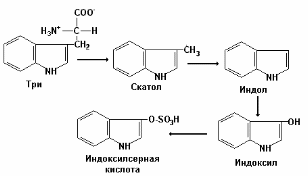 Все эти вещества гидрофобны и обладают мембранотропным действием (поражают мембраны клеток печени, эритроцитов, легких). Продукты распада аминокислот поступают в печень, где подвергаются детоксикации. В печени эти продукты обезвреживаются путем конъюгации с серной или глюкуроновой кислотой с образованием нетоксичных парных кислот (фенолсерная, скатоксилсерная). 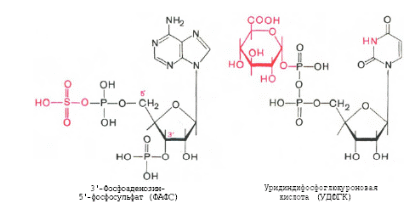 Происходит это так: в печени содержатся специфические ферменты - арилсульфотрансфераза и УДФ-глюкуронилтрансфераза, которые катализируют перенос остатка серной кислоты из ее связанной формы-ФАФС (фосфоаденозин-фосфосульфат) и остатка глюкуроновой кислоты из ее связанной формы-УДФГК (уридиндифосфоглюкуроновой кислоты) на любой из указанных выше продуктов. Продукты реакции нетоксичные так называемые парные кислоты (например, фенолсерная кислота, скатоксилсерная), выделяются с мочой. Диагностическое значение индикана: он характеризует содержимое кишечника. Содержание индикана увеличивается при запорах, непроходимости кишечника, при перитонитах и парезах кишечника. В этих случаях индикан появляется в крови и выделяется с мочой в повышенных количествах. Увеличение его концентрации в крови наблюдается на ранних стадиях почечной недостаточности. Эндогенный пул аминокислот в тканях - пути формирования и утилизации. Белки организма постоянно находятся в обороте. Оборот белка - это время синтеза и распада белка. В отличие от распада липидов и углеводов, распад белка не находится под контролем гормонов, но зависит от энергетического статуса клетки: распад осуществляется под влиянием протеаз, которые чувствительны к концентрации ионов Ca2+. (концентрация Ca2+ = 10-7 моль в клетке, 10-3 моль вне клетки). При нарушении энергообмена Ca-зависимая АТФ-аза не работает и Ca накапливается в клетке, что приводит к активации протеаз и усиленному распаду белка (протеолизу). Изотопными методами было установлено, что общий метаболический пул а/к на 2/3 состоит из эндогенных а/к, и на 1/3 из экзогенных. Причем исключительно важное значение имеет именно эндогенный пул; который пополняется: 1) за счет гидролиза и протеолиза старых белков; 2) за счет частичного протеолиза прогормонов и протоферментов (система комплемента); 3) за счет мутировавших дефектных белков; 4) за счет новосинтезированных заменимых а/к. 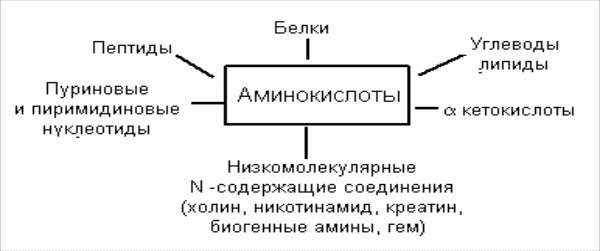 Пути утилизации аминокислот. Биосинтез белка (в основном); Синтез олигопептидов; Синтез биогенных аминов; NH3; Порфирины; Мочевина; Креатин, креатинфосфат; Азотистые основания; Холин, этаноламин; Аминоспирты (глюкозамин); Никотинамид; Гем; Гормоны; Глутатион; Желчные кислоты; Реакции обезвреживания и энергообмена; Каждые сутки в организм человека всасывается примерно 100 граммов аминокислот, которые поступают в кровь. Еще 400 граммов аминокислот поступает ежесуточно в кровь в результате распада собственных белков тела. Все эти 500 г аминокислот представляют собой метаболический пул аминокислот. Из этого количества 400 граммов используется для синтеза белков тела человека, а оставшиеся 100 г ежедневно распадаются до конечных продуктов: мочевины, CO2 . В процессе распада образуются также необходимые организму метаболиты, способные выполнять функции гормонов, медиаторов различных процессов и другие вещества (например: меланины, гормоны адреналин и тироксин). Для белков печени период полураспада составляет 10 дней. Для белков мышц этот период составляет 80 дней. Для белков плазмы крови - 14 дней, печени - 10 дней. Но есть белки, которые распадаются быстро (для a2-макроглобулина и инсулина период полураспада - 5 мин). 4. ПРАКТИЧЕСКАЯ ЧАСТЬ ЗАНЯТИЯ: а) проведение повторного инструктажа по технике безопасности; б) выполнение лабораторных работ. Лабораторные работы: №1. Количественное определение общей кислотности, общей, свободной и связанной соляной кислоты в одной пробе желудочного сока. №2. Обнаружение патологических компонентов желудочного сока. Грицук А.И. Практическая биохимия: Учебное пособие. ч.1. – Гомель, 2002. – С. 66–72. 5. ХОД ЗАНЯТИЯ: 5.1 Проведение устного теоретического опроса. 5.2 Проведение письменного контроля по теоретическим знаниям. 5.3 Выполнение лабораторных работ. 5.4 Выводы по лабораторным работам. Подведение итогов. 1 2 |
