Билет 1. Билет 1 Постройте диаграмму молекулярных
 Скачать 133.52 Kb. Скачать 133.52 Kb.
|
|
Билет 1 1. Постройте диаграмму молекулярных орбиталей (МО) H3+ (структура правильного треугольника), если известно, что данная система имеет две вырожденные разрыхляющие МО. Молекулярный ион водорода H3+ содержит три протона и два электрона. Электростатическое отталкивание трёх протонов компенсируется двумя электронами. Методом кулоновского взрыва показано, что протоны молекулярного иона водорода H3+ находятся в вершинах равностороннего треугольника с межъядерным расстоянием 1,25 ± 0,2Å[4]. Точного решения волнового уравнения Шрёдингера, описывающего поведение электронов для систем, содержащих два электрона, не существует. Широко используемая приближённая теория молекулярных орбиталей не учитывает кулоновскую электронную корреляцию — электростатическое отталкивание электронов. Можно считать, что при учёте кулоновской электронной корреляции центры электронной плотности электронов будут равноудалены друг от друга, а также равноудалены от ядер молекулярного иона водорода H3+. В центре молекулярного графа H3+ существует «кулоновская дыра». В молекулярном ионе H3+ реализуется двухэлектронная трёхцентровая химическая связь.  2. Почему энергия ван-дер-Ваальсова взаимодействия между молекулами уменьшается с ростом температуры ? К каким физическим последствиям это приводит? Слабые взаимодействия между нейтральными молекулами, проявляющиеся на расстояниях, превосходящих размеры частиц, были впервые обнаружены голландским ученым Ван-дер-Ваальсом. В связи с этим силы, вызывающие подобного рода взаимодействия, называют вандерваальсовыми силами. Силам Ван-дер-Ваальса приписывают электростатическую природу. Обычно в зависимости от природы системы выделяют три составляющие вандерваальсовых сил: ориентационную, индукционную и дисперсионную. Ориентационная составляющая (или диполь-дипольная) сил Ван-дер-Ваальса представляет собой электростатическое взаимодействие соответствующим образом ориентированных диполей. Энергия ориентационного взаимодействия резко возрастает с увеличением электрического момента диполя молекул и уменьшается с ростом температуры, так как при этом тепловое движение нарушает ориентацию молекул. В смесях, содержащих полярные и неполярные молекулы, возникает взаимодействие между молекулами, обусловленное электростатическим притяжением между диполями полярных молекул и наведенными (индуцированными) диполями неполярных молекул. Последние возникают в результате поляризации под действием электрических полей диполей, окружающих данную полярную молекулу. Этот эффект называется индукционной составляющей сил Ван-дер-Ваальса. Энергия индукционного взаимодействия Еинй возрастает с увеличением электрического момента диполя и не зависит от температуры, так как наведение диполей определяется напряженностью всего поля и происходит при любой пространственной ориентации молекул. 3. Верно ли в общем случае утверждение «…из двух химических процессов реакция с более отрицательным значением энергии Гиббса протекает быстрее…»? Почему? Энергией Гиббса реакции называется изменение энергии Гиббса ∆G при протекании химической реакции. Энергия Гиббса химической реакции характеризует возможность её самопроизвольного протекания при постоянных давлении и температуре. Если ∆G<0, то реакция может протекать самопроизвольно, при ∆G>0 самопроизвольное протекание реакции невозможно, если же ∆G=0, система находится в состоянии равновесия. При постоянстве температуры и давления химические реакции могут самопроизвольно протекать только в таком направлении, при котором энергия Гиббса системы уменьшается (ΔG < 0). Чем меньше G, тем сильнее стремление к протеканию данного процесса и тем дальше он от состояния равновесия. Поэтому чем меньше энергия Гиббса, тем быстрее проходит реакция. 4. Сколько молей хлороводорода следует растворить в одном литре воды, чтобы значение pH полученного раствора соляной кислоты стало равно 2. 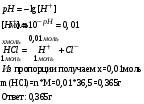 |
