Документ Microsoft Word. Билет 1 Строение атома
 Скачать 295.59 Kb. Скачать 295.59 Kb.
|
|
Гидролиз солей. Гидролиз солей - это химическое взаимодействие ионов соли с ионами воды, приводящее к образованию слабого электролита. Если рассматривать соль как продукт нейтрализации основания кислотой, то можно разделить соли на четыре группы, для каждой из которых гидролиз будет протекать по-своему. Соль, образованная сильным основанием и сильной кислотой (KBr, NaCl, NaNO3), гидролизу подвергаться не будет, так как в этом случае слабый электролит не образуется. Реакция среды остается нейтральной. В соли, образованной слабым основанием и сильной кислотой (FeCl2, NH4Cl, Al2(SO4)3, MgSO4) гидролизу подвергается катион: FeCl2 + HOH =>Fe(OH)Cl + HCl Fe2+ + 2Cl- + H+ + OH- => FeOH+ + 2Cl- + Н+ В результате гидролиза образуется слабый электролит, ион H и другие ионы. рН раствора < 7 ( раствор приобретает кислую реакцию). Соль, образованная сильным основанием и слабой кислотой (КClO, K2SiO3, Na2CO3, CH3COONa) подвергается гидролизу по аниону, в результате чего образуется слабый электролит, гидроксид ион и другие ионы. K2SiO3 + НОH =>KHSiO3 + KОН 2K+ +SiO32- + Н+ +ОH- => НSiO3- + 2K+ + ОН- рН таких растворов > 7 ( раствор приобретает щелочную реакцию). Соль, образованная слабым основанием и слабой кислотой ( СН3СООNН4, (NН4)2СО3, Al2S3), гидролизуется и по катиону, и по аниону. В результате образуется малодиссоциирующие основание и кислота. рН растворов таких солей зависит от относительной силы кислоты и основания. Мерой силы кислоты и основания является константа диссоциации соответствующего реактива. Реакция среды этих растворов может быть нейтральной, слабокислой или слабощелочной: Аl2S3 + 6HOH =>2Аl(ОН)3 + 3Н2S 2Al3+ + 3S2- + 6H+ + 6OH- =>2Аl(ОН)3 + 6Н+ +S2- рН =7 Гидролиз многокислотных солей и многоосновных кислот проходит ступенчато. Например, гидролиз хлорида железа (II) включает две ступени: 1-ая ступень FeCl2 + HOH =>Fe(OH)Cl + HCl Fe2+ + 2Cl- + H+ + OH- =>Fe(OH)+ + 2Cl- + H+ 2-ая ступень Fe(OH)Cl + HOH =>Fe(OH)2 + HCl Fe(OH)+ + Cl- + H+ + OH- =>Fe(ОН)2 + Н+ + Cl- Гидролиз - процесс обратимый. Повышение концентрации ионов водорода и гидроксид-ионов препятствует протеканию реакции до конца. Параллельно с гидролизом проходит реакция нейтрализации, когда образующееся слабое основание (Мg(ОН)2, Fe(ОН)2 ) взаимодействует с сильной кислотой, а образующаяся слабая кислота ( СН3СООН, Н2СО3 ) - со щелочью. Гидролиз протекает необратимо, если в результате реакции образуется нерастворимое основание и (или) летучая кислота: Al2S3 + 6H2O =>2Al(OH)3 + 3H2S Билет №21 Гальванический элемент. ГАЛЬВАНИЧЕСКИЙ ЭЛЕМЕНТ – источник электрического тока, в котором вследствие электрохимической реакции выделяется электрическая энергия. Состоит из отрицательных (чаще из цинка) и положительных (из меди, угля или окиси металла) электродов, погруженных в жидкий или пастообразный раствор электролита. Между электродом и электролитом всегда возникает некоторая разность потенциалов, зависящая от электрода и состава электролита. Появление электродного потенциала объясняется тем, что вещество электрода под воздействием химической энергии растворяется в электролите и положительные ионы переходят в электролит. Преобладание положительных и отрицательных зарядов на электроде в прилегающем к нему пограничном слое вызывает появление двойного электрического слоя и электрического поля на границе электрода. 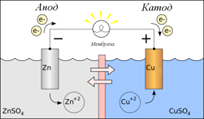 Билет №22. Ряд напряжений металлов Li, K, Ba, Ca, Na, Mg, Al, Mn, Cr, Zn, Fe, Co, Sn, Pb, H, Cu, Hg, Ag, Au >> Ослабление восстановительных свойств, ослабление активности металлов >>>>> <<< Ослабление окислительных свойства, усиление активности металлов <<<<< В частности, пользуясь злектрохимическим рядом напряжения металлов, можно определить, какие металлы вытесняют другие из растворов их солей (Более активные, - те, которые левее, вытесняют менее активные). Какие металлы будут реагировать с разбавленным раствором серной кислоты, соляной кислотой и некоторыми другими. (Это металлы, стоящие в ряду напряжения до Н) Ряд напряжений используется на практике для сравнительной оценки химической активности металлов в реакциях с водными растворами солей и кислот и для оценки катодных и анодных процессов при электролизе: Металлы, стоящие левее, являются более сильными восстановителями, чем металлы, расположенные правее: они вытесняют последние из растворов солей. Например, взаимодействие Zn + Cu2+ → Zn2+ + Cu возможно только в прямом направлении. Металлы, стоящие в ряду левее водорода, вытесняют водород при взаимодействии с водными растворами кислот-неокислителей; наиболее активные металлы (до алюминия включительно) — и при взаимодействии с водой. Металлы, стоящие в ряду правее водорода, с водными растворами кислот-неокислителей при обычных условиях не взаимодействуют. При электролизе металлы, стоящие правее водорода, выделяются на катоде; восстановление металлов умеренной активности сопровождается выделением водорода; наиболее активные металлы (до алюминия) невозможно при обычных условиях выделить из водных растворов солей. Билет №23 Электролиз. Этот окислительно-восстановительный процесс протекает на электродах при прохождении постоянного электрического тока через растворы или расплавы электролитов. На отрицательно заряженном электроде - катоде происходит электрохимическое восстановление частиц (атомов, молекул, катионов), а на положительно заряженном электроде - аноде идет электрохимическое окисление частиц (атомов, молекул, анионов). Примеры электролиза расплавов: 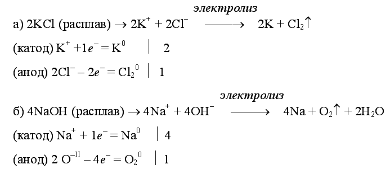 Электролиз воды проводится всегда в присутствии инертного электролита (для увеличения электропроводности очень слабого электролита - воды): В зависимости от инертного электролита электролиз проводится в нейтральной, кислотной или щелочной среде. При выборе инертного электролита необходимо учесть, что никогда не восстанавливаются на катоде в водном растворе катионы металлов, являющихся типичными восстановителями (например Li+, Cs+, K+, Ca2+, Na+, Mg2+, Al3+) и никогда не окисляется на аноде кислород O−II анионов оксокислот с элементом в высшей степени окисления (например ClO4−, SO42−, NO3−, PO43−, CO32−, SiO44−, MnO4−), вместо них окисляется вода Примеры электролиза растворов солей: (на аноде окисляются анионы Сl−, а не кислород O−II молекул воды, так как электроотрицательность хлора меньше, чем кислорода, и следовательно, хлор отдает электроны легче, чем кислород) (на катоде восстанавливаются катионы Cu2+, а не водород HI молекул воды, так как медь стоит правее водорода в ряду напряжений, то есть легче принимает электроны, чем HI в воде). Таким образом, электролиз - это окислительно-восстановительная реакция, которая протекает под действием и при участии электрического тока. Уравнения электрохимических реакций отражают те процессы, которые без помощи электрического тока протекать не могут. Билет №24 Электрохимическая коррозия Разрушение металла под воздействием возникающих в коррозионной среде гальванических элементов называют электрохимической коррозией. Всегда требуется наличие электролита (Конденсат, дождевая вода и т. д.), с которым соприкасаются электроды. Водородная и кислородная коррозия Если происходит восстановление ионов H3O+ или молекул воды H2O, говорят о водородной коррозии или коррозии с водородной деполяризацией. Восстановление ионов происходит по следующей схеме: 2H3O+ + 2e− → 2H2O + H2 или 2H2O + 2e− → 2OH− + H2 Если водород не выделяется, что часто происходит в нейтральной или сильно щелочной среде, происходит восстановление кислорода и здесь говорят о кислородной коррозии или коррозии с кислородной деполяризацией: O2 + 2H2O + 4e− → 4OH− Коррозионный элемент может образовываться не только при соприкосновении двух различных металлов. Коррозионный элемент образуется и в случае одного металла, если, например, структура поверхности неоднородна Химическая коррозия — взаимодействие поверхности металла с коррозионно-активной средой, не сопровождающееся возникновением электрохимических процессов на границе фаз. В этом случае взаимодействия окисление металла и восстановление окислительного компонента коррозионной среды протекают в одном акте. Например, образование окалины при взаимодействии материалов на основе железа при высокой температуре с кислородом: 4Fe + 3O2 → 2Fe2O3 При электрохимической коррозии ионизация атомов металла и восстановление окислительного компонента коррозионной среды протекают не в одном акте и их скорости зависят от электродного потенциала металла (например, ржавление стали в морской воде).. Билет №25 Окисли́тельно-восстанови́тельные реа́кции— это встречно-параллельные химические реакции, протекающие с изменением степеней окисления атомов, входящих в состав реагирующих веществ, реализующихся путём перераспределения электронов между атомом-окислителем и атомом-восстановителем. В процессе окислительно-восстановительной реакции восстановитель отдаёт электроны, то есть окисляется; окислитель присоединяет электроны, то есть восстанавливается. Причём любая окислительно-восстановительная реакция представляет собой единство двух противоположных превращений — окисления и восстановления, происходящих одновременно и без отрыва одного от другого. При окисле́нии вещества в результате отдачи электронов увеличивается его степень окисления. Атомы окисляемого вещества называются донорами электронов, а атомы окислителя — акцепторами электронов. Окислитель, принимая электроны, приобретает восстановительные свойства, превращаясь в сопряжённый восстановитель: окислитель + e− ↔ сопряжённый восстановитель. При восстановлении атомы или ионы присоединяют электроны. При этом происходит понижение степени окисления элемента. Примеры: восстановление оксидов металлов до свободных металлов при помощи водорода, углерода, других веществ; Окислительно-восстановительная пара Окислитель и его восстановленная форма, либо восстановитель и его окисленная форма составляет сопряжённую окислительно-восстановительную пару, а их взаимопревращения являются окислительно-восстановительными полуреакциями. В любой окислительно-восстановительной реакции принимают участие две сопряжённые окислительно-восстановительные пары, между которыми имеет место конкуренция за электроны, в результате чего протекают две полуреакции: одна связана с присоединением электронов, т.е. восстановлением, другая — с отдачей электронов, т.е. окислением. Окисление: Восстановление: |
