Навигация по странице:Билет № 8Билет № 9Билет № 10Эффективные заряды атомов в молекулахИонная связь, как крайний случай поляризации ковалентной связиБилет № 11Ионная связь, её свойства, отличие от ковалентной связиБилет № 12Билет № 13Кристаллическое состояние; ионная, атомная, молекулярная, металлическая кристаллические решеткиБилет № 14Зависимость скорости от концентрации реагирующих веществФакторы, влияющие на скорость реакцииБилет № 15Константа химического равновесияБилет № 16Энтальпия, энтропия, энергия ГиббсаБилет № 17Кислоты, основания, соли с точки зрения теории диссоциации.Билет № 18Степень диссоциации, константа диссоциацииБилет № 19
|
Документ Microsoft Word. Билет 1 Строение атома
Билет № 7
Виды химической связи
Ионная связь – частный случай ковалентной, когда образовавшаяся электронная пара полностью принадлежит более электроотрицательному атому, становящемуся анионом. Основой для выделения этой связи в отдельный тип служит то обстоятельство, что соединения с такой связью можно описывать в электростатическом приближении, считая ионную связь обусловленной притяжением положительных и отрицательных ионов. Взаимодействие ионов противоположного знака не зависит от направления, а кулоновские силы не обладают свойством насыщености. Поэтому каждый ион в ионном соединении притягивает такое число ионов противоположного знака, чтобы образовалась кристаллическая решетка ионного типа. В ионном кристалле нет молекул. Каждый ион окружен определенным числом ионов другого знака (координационное число иона). Ионные пары могут существовать в газообразном состоянии в виде полярных молекул. В газообразном состоянии NaCl имеет дипольный момент 3∙10–29 Кл∙м, что соответствует смещению 0,8 заряда электрона на длину связи 0,236 нм от Na к Cl, т. е. Na0,8+Cl0,8–.
Металлическая связь возникает в результате частичной делокализации валентных электронов, которые достаточно свободно движутся в решетке металлов, электростатически взаимодействуя с положительно заряженными ионами. Силы связи не локализованы и не направлены, а делокализированные электроны обусловливают высокую тепло- и электропроводность.
Водородная связь. Ее образование обусловлено тем, что в результате сильного смещения электронной пары к электроотрицательному атому атом водорода, обладающий эффективным положительным зарядом, может взаимодействовать с другим электроотрицательным атомом (F, O, N, реже Cl, Br, S). Энергия такого электростатического взаимодействия составляет 20–100 кДж∙моль–1. Водородные связи могут быть внутри- и межмолекулярными. Внутримолекулярная водородная связь образуется, например, в ацетилацетоне и сопровождается замыканием цикла.
Ковалентная связь
Ковалентная связь– наиболее общий вид химической связи, возникающий за счет обобществления электронной пары посредством обменного механизма, когда каждый из взаимодействующих атомов поставляет по одному электрону, или по донорно-акцепторному механизму, если электронная пара передается в общее пользование одним атомом (донором) другому атому (акцептору).
Классический пример неполярной ковалентной связи (разность электроотрицательностей равна нулю) наблюдается у гомоядерных молекул: H–H, F–F. Энергия двухэлектронной двухцентровой связи лежит в пределах 200–2000 кДж∙моль–1.
Механизмы образования ковалентной связи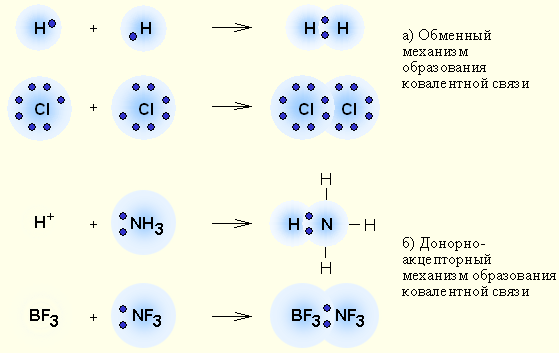
Выделяют два механизма образования ковалентной связи: обменный («на паритетных началах») и донорно-акцепторный.
В случае обменного механизма каждый из двух атомов, образующих связь, предоставляет по одному неспаренному электрону для общей электронной пары.
В случае донорно-акцепторного механизма одна частица (донор) предоставляет собственную неподеленную электронную пару, а вторая частица (акцептор) — свободную орбиталь.
Билет № 8
Характеристика ковалентной связи: длина, энергия, полярность
Основные параметры ковалентных связей, которые определяют ее прочность и характер разрыва в реакциях, являются длина, полярность и энергия.
Длина связи – расстояние между центрами атомов, связанных ковалентной связью.
В пределах (слева направо) малых периодов длина связи какого-либо атома с другими уменьшается с увеличением заряда ядра атома. Внутри группы с увеличением заряд ядра длина связи возрастает (сверху вниз).
Чем больше разность ЭО элементов, тем больше полярность, тем меньше длина связи. В периодах полярность увеличивается слева направо. В группах длина связи сверху вниз увеличивается, что ведет к уменьшению прочности связи.
Полярные связи.
Если 2 одинаковых атома связаны ковалентной связью, то электронная плотность рапсределяется между обоими атомами равномерно CH3—CH3. Если атомы имеют разную электроотрицательность, то связывающая пара электронов будет располагаться ближе к более электрооотрицательному атому.
Электроотрицательность (ЭО) – способность атома притягивать электроны собственной электроотрицательной оболочкой. Чем больше ЭОэлемента, тем сильнее притяжение между ядром и внешним электроном.
Смещение электронной плотности ковалентной связи к более электронному атому называется полярной связью.
Полярность обозначается стрелками : → для σ связей и 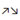 для π связей. для π связей.
Символами δ и δ обозначаются частичные заряды на атомах
Пример: Н→ Cl Br→Cl
Степень разделения зарядов может быть охарактеризована дипольным моментом связи. Он соответствует величине разделенного заряда, умноженной на расстояние между атомами и измеряется в дебалях (D).
1 D = 10-18e*нм
Энергия связи.
Энергия, требуемая для разрыва ковалетной связи до двух нейтральных атомов, называется энергией диссоциации связи.(Е) кДж/моль
Чем больше энергия связи, тем прочнеее связь. Энергия, необходимая для разрыва ковалентной связи, равна количеству энергии, выделяющейся при образовании этой связи.
Свойства ковалентной связи: направленность, насыщаемость; валентные углы
Ковалентная связь обладает рядом важных свойств. К их числу относятся: насыщаемость и направленность.
Насыщаемость - характерное свойство ковалент�ной связи. Она проявляется в способности атомов образо�вывать ограниченное число ковалентных связей. Это свя�зано с тем, что одна орбиталь атома может принимать участие в образовании только одной ковалентной хими�ческой связи. Данное свойство определяет состав молеку�лярных химических соединений. Так, при взаимодейст�вии атомов водорода образуется молекула Н2, а не Н3. С точки зрения МВС третий атом водорода не может присо�единиться, так как спин его электрона окажется парал�лельным спину одного из спаренных электронов в молеку�ле. Способность к образованию того или иного числа кова�лентных связей у атомов различных элементов ограни�чивается получением максимального числа неспаренных валентных электронов.
Направленность - свойство ковалентной связи, определяющее геометрическую структуру молекулы. Причина направленности связи заключается в том, что перекрывание электронных орбиталей возможно только при их определенной взаимной ориентации, обеспечиваю�щей наибольшую электронную плотность в области их перекрывания. В этом случае образуется наиболее проч�ная химическая связь.
Направление ковалентных связей характеризуется валентными углами - углами между линиями, соединяющими связываемые атомы. Графическая формула химической частицы не несет информации о валентных углах. Например, в сульфат-ионе SO42− валентные углы между связями сера−кислород равны 109,5o, а в тетрахлоропалладат-ионе [PdCl4]2− − 90o. Совокупность длин связей и валентных углов в химической частице определяет ее пространственное строение. Для определения валентных углов используют экспериментальные методы изучения структуры химических соединений. Оценить значения валентных углов можно теоретически, исходя из электронного строения химической частицы.
Билет № 9
Гибридизация
Гибридизация атомных орбиталей – изменение формы и энергии орбиталей атома при образовании ковалентной связи для достижения более эффективного перекрывания орбиталей.
Различные орбитали, не сильно отличающиеся энергиями, образуют соответствующее число гибридных орбиталей. Число гибридных орбиталей равно числу атомных орбиталей, участвующих в гибридизации. Гибридные орбитали одинаковы по форме электронного облака и по энергии. По сравнению с атомными орбиталями они более вытянуты в направлении образования химических связей и поэтому обуславливают лучшее перекрывание электронных облаков.
Типы гибридизации
Существуют множество типов гибридизаций: sp, sp2, sp3, sp2d, sp3d, sp3d2, sp3d3, sp3d4. Но чаще всех остальных используются только sp, sp2, sp3.
sp-гибридизация - это гибридизация, в которой участвуют атомные орбитали одного s- и одного p-электронов. 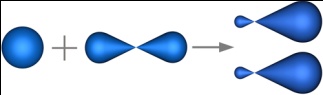
В процессе гибридизации образуются 2 гибридные орбитали, которые ориентируются друг к другу под углом 180°.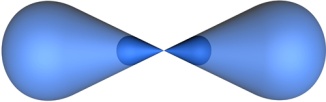
sp2-гибридизация – гибридизация, в которой участвуют атомные орбитали одного s- и двух p-электронов. 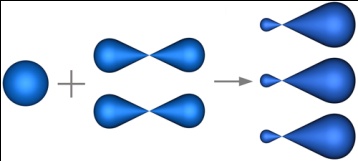
В результате гибридизации образуются три гибридные sp2 орбитали, расположенные в одной плоскости под углом 120° друг к другу. 
sp3-гибридизация – гибридизация, в которой участвуют атомные орбитали одного s- и трех p-электронов. 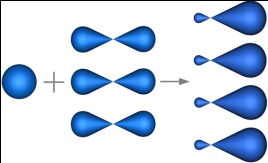
Четыре sp3-гибридные орбитали симметрично ориентированны в пространстве под углом 109°28'. 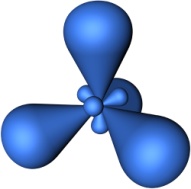
Билет № 10
Полярная и неполярная ковалентные связи
Различают две основные разновидности ковалентной связи: а) неполярную и б) полярную.
а) Ковалентная неполярная связь образуется между атомами неметалла одного и того лее химического элемента. Такую связь имеют простые вещества, например, О2; N2; C12. Можно привести схему образования молекулы водорода: 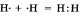 (на схеме электроны обозначены точками). (на схеме электроны обозначены точками).
б) Ковалентная полярная связь образуется между атомами различных неметаллов.
Схематично образование ковалентной полярной связи в молекуле НС1 можно изобразить так: 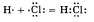
Общая электронная плотность оказывается смещенной в сторону хлора, в результате чего на атоме хлора возникает частичный отрицательный заряд , а на атоме водорода - частичный положительный. Таким образом, молекула становится полярной: 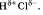
Эффективные заряды атомов в молекулах
Эффективный заряд атома, характеризует разность между числом электронов, принадлежащих данному атому в хим. соед., и числом электронов своб. атома. Для оценок Э. з. а. используют модели, в которых экспериментально определяемые величины представляют, как ф-ции точечных неполяризуемых зарядов, локализованных на атомах; напр., дипольный момент двухатомной молекулы рассматривают как произведение Э. з. а. на межатомное расстояние. В рамках подобных моделей Э. з. а. можно рассчитать, используя данные оптич. или рентгеновской спектроскопии, ЯМР и др. Однако, поскольку электронная плотность в хим. соед. делокализована и границ между атомами не существует, нельзя описать разл. характеристики соед. одним набором Э. з. а.; значения этого показателя, определенные разными эксперим. методами, могут не совпадать. Э. з. а. можно определить также на основе квантовохим. расчетов.
Э. з. а., определенные в рамках к.-л. одной модели или в однотипных расчетах, используют для корреляции с различными физ.-хим. характеристиками соед., установления реакц. центров в молекулах, оценки степени ионности хим. связи.
Ионная связь, как крайний случай поляризации ковалентной связи
Предельным случаем ковалентной полярной связи яв�ляется ионная связь. Если электроотрицательности атомов различаются очень сильно (например, атомов щелочных металлов и галогенов), то при их сближении валентные электроны одного атома полностью переходят на второй атом. В результате этого перехода оба атома становятся ионами и принимают электронную структуру ближайшего благородного газа. Например, при взаимо�действии атомов натрия и хлора, они превращаются в ионы Na+ и Сl-, между которыми возникает электроста�тическое притяжение. Ионная связь может быть описа�на в рамках методов ВС и МО, однако обычно ее рас�сматривают с помощью классических законов электро�статики.
Молекулы, в которых существует в чистом виде ион�ная связь, встречаются в парообразном состоянии ве�щества. Ионные кристаллы состоят из бесконечных рядов, чередующихся положительных и отрицательных ионов, связанных электростатическими силами. При растворении ионных кристаллов или их плавлении в раствор или расплав переходят положительные и отрицательные ионы.
Следует отметить, что ионные связи обладают большой прочностью, поэтому для разрушения ионных кристаллов необходимо затратить большую энергию. Этим объясня�ется тот факт, что ионные соединения имеют высокие тем�пературы плавления.
В отличие от ковалентной связи ионная не обладает свойствами насыщаемости и направленности. Причина этого состоит в том, что электрическое поле, создаваемое ионами, имеет сферическую симметрию и действует оди�наково на все ионы. Поэтому количество ионов, окру�жающих данный ион, и их пространственное расположе�ние определяются только величинами зарядов ионов и их размерами.
Билет № 11
Виды химической связи
Ионная связь – частный случай ковалентной, когда образовавшаяся электронная пара полностью принадлежит более электроотрицательному атому, становящемуся анионом. Основой для выделения этой связи в отдельный тип служит то обстоятельство, что соединения с такой связью можно описывать в электростатическом приближении, считая ионную связь обусловленной притяжением положительных и отрицательных ионов. Взаимодействие ионов противоположного знака не зависит от направления, а кулоновские силы не обладают свойством насыщенности. Поэтому каждый ион в ионном соединении притягивает такое число ионов противоположного знака, чтобы образовалась кристаллическая решетка ионного типа. В ионном кристалле нет молекул. Каждый ион окружен определенным числом ионов другого знака (координационное число иона). Ионные пары могут существовать в газообразном состоянии в виде полярных молекул. В газообразном состоянии NaCl имеет дипольный момент
3∙10–29 Кл∙м, что соответствует смещению 0,8 заряда электрона на длину связи 0,236 нм от Na к Cl, т. е. Na0,8+Cl0,8–.
Металлическая связь возникает в результате частичной делокализации валентных электронов, которые достаточно свободно движутся в решетке металлов, электростатически взаимодействуя с положительно заряженными ионами. Силы связи не локализованы и не направлены, а делокализированные электроны обусловливают высокую тепло- и электропроводность.
Водородная связь. Ее образование обусловлено тем, что в результате сильного смещения электронной пары к электроотрицательному атому атом водорода, обладающий эффективным положительным зарядом, может взаимодействовать с другим электроотрицательным атомом (F, O, N, реже Cl, Br, S). Энергия такого электростатического взаимодействия составляет 20–100 кДж∙моль–1. Водородные связи могут быть внутри- и межмолекулярными. Внутримолекулярная водородная связь образуется, например, в ацетилацетоне и сопровождается замыканием цикла.
Ковалентная связь – наиболее общий вид химической связи, возникающий за счет обобществления электронной пары посредством обменного механизма, когда каждый из взаимодействующих атомов поставляет по одному электрону, или по донорно-акцепторному механизму, если электронная пара передается в общее пользование одним атомом (донором) другому атому (акцептору).
Классический пример неполярной ковалентной связи (разность электроотрицательностей равна нулю) наблюдается у гомоядерных молекул: H–H, F–F. Энергия двухэлектронной двухцентровой связи лежит в пределах 200–2000 кДж∙моль–1.
Ионная связь, её свойства, отличие от ковалентной связи
Предельным случаем ковалентной полярной связи яв�ляется ионная связь. Если электроотрицательности атомов различаются очень сильно (например, атомов щелочных металлов и галогенов), то при их сближении валентные электроны одного атома полностью переходят на второй атом. В результате этого перехода оба атома становятся ионами и принимают электронную структуру ближайшего благородного газа. Например, при взаимо�действии атомов натрия и хлора, они превращаются в ионы Na+ и Сl-, между которыми возникает электроста�тическое притяжение. Ионная связь может быть описа�на в рамках методов ВС и МО, однако обычно ее рас�сматривают с помощью классических законов электро�статики.
Молекулы, в которых существует в чистом виде ион�ная связь, встречаются в парообразном состоянии ве�щества. Ионные кристаллы состоят из бесконечных рядов чередующихся положительных и отрицательных ионов, связанных электростатическими силами. При растворении ионных кристаллов или их плавлении в раствор или расплав переходят положительные и отрицательные ионы.
Следует отметить, что ионные связи обладают большой прочностью, поэтому для разрушения ионных кристаллов необходимо затратить большую энергию. Этим объясня�ется тот факт, что ионные соединения имеют высокие тем�пературы плавления.
В отличие от ковалентной связи ионная не обладает свойствами насыщаемости и направленности. Причина этого состоит в том, что электрическое поле, создаваемое ионами, имеет сферическую симметрию и действует оди�наково на все ионы. Поэтому количество ионов, окру�жающих данный ион, и их пространственное расположе�ние определяются только величинами зарядов ионов и их размерами.
Металлическая связь
Металлическая связь — химическая связь, обусловленная наличием относительно свободных электронов. Характерна для металлов, сплавов и интерметаллических соединений.
Так как металлы являются кристаллическими веществами, число валентных электронов атома металла недостаточно для образования связей со всеми его соседями (так как соседей много). Поэтому в металлах небольшое число электронов одновременно связывает большое число атомных ядер, а сами электроны могут перемещаться в металле. Иначе говоря, в металлах имеет место сильно делокализованная химическая связь.
Согласно одной из теорий металл можно рассматривать как плотно упакованную структуру из положительно заряженных ионов, связанных друг с другом коллективизированными электронами (электронный газ). Свободно движущиеся электроны обусловливают высокую электро- и теплопроводность металла.
Вследствие нелокализованности металлической связи для ее описания лучше всего подходит теория кристаллических орбиталей
Билет № 12
Межмолекулярное взаимодействие. Природа межмолекулярных взаимодействий. Виды межмолекулярного взаимодействия
Межмолекулярное взаимодействие — взаимодействие, не приводящее к разрыву или образованию новых химических связей. Силы притяжения, действующие между молекулами на больших расстояниях (от 5-8 до 100 Å), называются силами Ван-дер-Ваальса и представляют собой кулоновские силы, возникающие между электронами и ядрами двух молекул.
При небольшом смещении отрицательных и положительных зарядов в нейтральной молекуле она перестает быть неполярной, превращаясь в электрический диполь. Имеются мо�лекулы, обладающие постоянным электрическим дипольным мо�ментом и называющиеся полярными. При сближении они стре�мятся развернуться так, чтобы их обращенные друг к другу стороны были заряжены разноименно. В этом случае суммарная сила притяжения между зарядами больше, чем суммар�ная сила отталкивания, поэтому полярные молекулы притягивают�ся. Эти электростатические силы иногда называют дипольно-ориентационными.
Если молекулы не имеют постоянного дипольного момента, то при помещении во внешнее электрическое поле они его при�обретают. Во внешнем электрическом поле положительные заряды молекулы несколько смещаются в направлении поля, а отрица�тельные – в противоположном направлении. Поляризация может быть обусловлена также деформацией электронной оболочки не�полярной молекулы под влиянием электрического поля полярной (индуцированный диполь), что всегда приводит к понижению энер�гии системы и притяжению молекул. Такие силы межмолекулярного взаимодействия называют поляризационными (индукционными). Межмолекулярное взаимодействие может быть связано также с пе�реносом электронного заряда с одной молекулы на другую. Перенос заряда происходит при перекрывании электронных оболочек моле�кул, если их сродство к электрону различно. Перенос заряда можно рассматривать как предельный случай поляризации.
При сближении неполярных молекул электрические поля со�ставляющих их зарядов быстро меняются во времени и лишь в среднем компенсируют друг друга в различных точках простран�ства. Поэтому при сближении молекулы поляризуют друг друга, причем обращенные друг к другу стороны поляризованных моле�кул обладают зарядами противоположного знака.
В результате взаимно поляризованные молекулы притягивают друг друга. Такие силы межмолекулярного взаимодействия назы�ваются дисперсионными (лондоновскими). Они действуют между любыми атомами и молекулами независимо от их строения.
Таким образом, различают три вида сил Ван-дер-Ваальса: электростатические (дипольно-ориентационные), поляризационные (индукционные) и дисперсионные.
Водородная связь
Водородная связь возникает между молекулами, в ко�торых атом водорода связан с атомом элемента, облада�ющего высокой электроотрицательностью. Так, атом водорода, образующий в молекуле НХ прочную ковалентную связь с атомом X, может образовывать водо�родную связь с атомом X (или Y) другой молекулы. Во�дородную связь принято изображать пунктиром: X - Н …У. Обычно энергия водородной связи (8-80 кДж/моль) значительно уступает энергии химической связи, но на�много больше энергии ван-дер-ваальсова взаимодействия (1-5 кДж/моль). Исключением является силь�ная водородная связь в ионе (FHF) (250 кДж/моль).
Возникновение водородной связи обусловлено двумя причинами:
1. Атом водорода, связанный полярной ковалентной свя�зью с атомом X, фактически не имеет электронов и способен легко внедряться в электронные облака других частиц.
2. Обладая вакантной s-орбиталью, атом водорода может принимать неподеленную электронную пару атома Y, образуя с ним донорно-акцепторную связь.
Билет № 13
Конденсированное состояние вещества
Конденсированное состояние вещества (конденсированное тело) - понятие, объединяющее твёрдые тела и жидкости в противопоставлении их газу. Атомные частицы (атомы, молекулы, ионы) в конденсированном теле связаны между собой. Ср. энергии теплового движения частиц не хватает на самопроизвольный разрыв связи, поэтому конденсированное тело сохраняет свой объём. Мерой связи атомных частиц служит теплота испарения (в жидкости) и теплота возгонки (в твёрдом теле).
Кристаллическое состояние; ионная, атомная, молекулярная, металлическая кристаллические решетки
Кристаллическими веществами называют вещества, которые обладают трехмерной кристаллической решеткой. Это значит, что атомы в таких веществах расположены друг относительно друга в определенной закономерности, которую называют кристаллической решеткой. Вещества, имеющие кристаллическую решетку, – твердые. Такие вещества называют кристаллами.
Ионными называют кристаллические решетки, в узлах которых находятся ионы. Их образуют вещества с ионной связью. Ионные кристаллические решетки имеют соли, некоторые оксиды и гидроксиды металлов. Связи между ионами в кристалле очень прочные и устойчивые. Поэтому вещества с ионной решеткой обладают высокой твѐрдостью и прочностью, тугоплавки и нелетучи.
Атомными называют кристаллические решетки, в узлах которых находятся отдельные атомы, которые соединены очень прочными ковалентными связями. Кристаллическая решетка алмаза. В природе встречается немного веществ с атомной кристаллической решеткой. К ним относятся бор, кремний, германий, кварц, алмаз. Вещества имеют высокие температуры плавления, обладают повышенной твердостью. Алмаз - самый твердый природный материал.
Молекулярными называют кристаллические решетки, в узлах которых располагаются молекулы. Химические связи в них ковалентные, как полярные, так и неполярные. Связи в молекулах прочные, но между молекулами связи не прочные. Кристаллическая решетка I2. Кристаллическая решетка СО2. Вещества имеют малую твѐрдость, плавятся при низкой температуре, летучие, при обычных условиях находятся в газообразном или жидком состоянии
Металлическими называют решетки, в узлах которых находятся атомы и ионы металла. Для металлов характерны физические свойства: пластичность, ковкость, металлический блеск, высокая электро- и теплопроводность.
Кристаллические решетки веществ – это упорядоченное расположение частиц (атомов, молекул, ионов) в строго определенных точках пространства. Точки размещения частиц называют узлами кристаллической решетки. В зависимости от типа частиц, расположенных в узлах кристаллической решетки, и характера связи между ними различают 4 типа кристаллических решеток: ионные, атомные, молекулярные, металлические.
Билет № 14
Скорость химической реакции
Скорость реакции - это величина, показывающая как изменяется концентрация одного из веществ в единицу времени. Чтобы ускорить достижение состояния равновесия, требуется увеличить скорость реакции. Основными способами увеличения скорости реакции является повышение температуры, изменение концентрации, введение катализатора.
Зависимость скорости от концентрации реагирующих веществ
При повышении концентрации хотя бы одного из реагирующих веществ скорость химической реакции возрастает в соответствии с кинетическим уравнением.
Порядок реакции
Порядок реакции определяется как сумма показателей степеней n1 и n2 в уравнении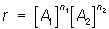 выражающем зависимость скорости реакции r от концентраций [A1] и [А2] исходных веществ (k — константа скорости). Реакции с n1+ n2 = 1, 2 и т.д. называются реакциями 1-го, 2-го и т.д. порядков. Отдельный показатель степени в уравнении (1) называется порядком реакции по соответствующему веществу. выражающем зависимость скорости реакции r от концентраций [A1] и [А2] исходных веществ (k — константа скорости). Реакции с n1+ n2 = 1, 2 и т.д. называются реакциями 1-го, 2-го и т.д. порядков. Отдельный показатель степени в уравнении (1) называется порядком реакции по соответствующему веществу.
Факторы, влияющие на скорость реакции
Концентрация, природа реагирующих веществ, наличие катализатора, температура, давление, площадь поверхности реагирующих веществ.
Билет № 15
Химическое равновесие, факторы, влияющие на смещение равновесия
Химическое равновесие — состояние химической системы, в котором обратимо протекает одна или несколько химических реакций, причём скорости в каждой паре прямая-обратная реакция равны между собой. Для системы, находящейся в химическом равновесии, концентрации реагентов, температура и другие параметры системы не изменяются со временем.
В состоянии равновесия скорости прямой и обратной реакции становятся равными.
Факторы, влияющие на химическое равновесие:
1) температура. При увеличении температуры химическое равновесие смещается в сторону эндотермической (поглощение) реакции, а при понижении в сторону экзотермической (выделение) реакции.
2) давление. При увеличении давления химическое равновесие смещается в сторону меньшего объёма веществ, а при понижении в сторону большего объёма. Этот принцип действует только на газы, т.е. если в реакции участвуют твердые вещества, то они в расчет не берутся.
3) концентрация исходных веществ и продуктов реакции.
При увеличении концентрации одного из исходных веществ химическое равновесие смещается в сторону продуктов реакции, а при увеличении концентрации продуктов реакции-в сторону исходных веществ.
Константа химического равновесия
Количественной характеристикой химического равновесия является константа равновесия, которая может быть выражена через равновесные концентрации Сi, парциальные давления Pi или мольные доли Xi реагирующих веществ. Для некоторой реакции соответствующие константы равновесия выражаются следующим образом: 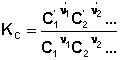
Т.о., константа равновесия есть отношение констант скорости прямой и обратной реакции. Отсюда вытекает физический смысл константы равновесия: она показывает, во сколько раз скорость прямой реакции больше скорости обратной при данной температуре и концентрациях всех реагирующих веществ, равных 1 моль/л.
Билет № 16
Термодинамические параметры химических процессов
Термодинамические параметры - физические величины, характеризующие состояние термодинамической системы: температура, давление, внутренняя энергия, энтропия, энтальпия, энергия Гиббса.
Энтальпия, энтропия, энергия Гиббса
Энтальпия - это свойство вещества, указывающее количество энергии, которую можно преобразовать в теплоту. H = U + pV
Энтропия - термодинамическая функция состояния, которая служит мерой беспорядка (неупорядоченности) системы. Возможность протекания эндотермических процессов обусловлена изменением энтропии, ибо в изолированных системах энтропия самопроизвольно протекающего процесса увеличивается ΔS> 0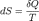
Энергия Гиббса - это величина, показывающая изменение энергии в ходе химической реакции и дающая таким образом ответ на принципиальную возможность протекания химической реакции; это термодинамический потенциал следующего вида: 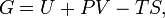
Билет № 17
Электролитическая диссоциация
Электролитическая диссоциация, полный или частичный распад молекул растворенного вещества на катионы и анионы. Электролитической диссоциацией называют также распад на катионы и анионы ионных кристаллов при растворении или расплавлении. Электролитическая диссоциация, как правило, происходит в полярных растворителях.
Кислоты, основания, соли с точки зрения теории диссоциации. Основания. Название "основание" первоначально было отнесено к веществам, которые в реакциях с кислотами образуют соли. К основаниям принадлежат гидроксиды многих металлов.
Примеры: NaOH - гидроксид натрия (едкий натр), KOH - гидроксид калия (едкое кали), Ca(OH)2 - гидроксид кальция (гашёная известь). Основания, которые хорошо растворяются в воде, называются щелочами, К ним относятся гидроксиды щелочных и щелочно-земельных металлов. С точки зрения теории электролитической диссоциации основания - это вещества, диссоциирующие в водном растворе с образованием анионов одного вида - гидроксид - ионов ОН-. В общем виде уравнение электролитической диссоциации основания имеет вид: Основание -> Катион основания + Гидроксид – ион. Кислоты. Кислоты исторически получили своё название из-за кислого вкуса водных растворов таких веществ, как хлороводород или уксусная кислота. С точки зрения теории электролитической диссоциации кислоты - это вещества, диссоциирующие в водном растворе с образованием катионов одного вида - катионов водорода Н+.
В общем виде уравнение электролитической диссоциации кислоты имеет вид: Кислота -> Катион водорода + Анион кислотного остатка.
Соли. С точки зрения теории электролитической реакции соли - это вещества, которые в водном растворе диссоциируют с образованием катионов основания и анионов кислотного остатка. В общем виде уравнение электролитической диссоциации солей имеет следующий вид: Соль -> Катион основания + Анион кислотного остатка
Билет № 18
Сильные и слабые электролиты
Сильные и слабые электролиты. В зависимости от степени диссоциации различают электролиты сильные и слабые. Электролиты со степенью диссоциации больше 30% обычно называют сильными, со степенью диссоциации от 3 до 30% — средними, менее 3% — слабыми электролитами.
К сильным электролитам относятся почти все соли, некоторые кислоты (НСl, HBr, HI, НNО3, НсlO4, Н2SO4(разб.)) и некоторые основания (LiОН, NaOH, КОН, Са(ОН)2, Sr(OH)2, Ва(ОН)2). К слабым электролитам относится большинство кислот (особенно органических) и оснований.
Степень диссоциации, константа диссоциации
Степенью диссоциации называется отношение числа молекул, распавшихся на ионы (N'), к общему числу растворенных молекул (N):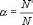
Более точной характеристикой диссоциации электролита является константа диссоциации, которая от концентрации раствора не зависит.
Выражение для константы диссоциации можно получить, если записать уравнение реакции диссоциации электролита АК в общем виде:
A K A + K+.
Поскольку диссоциация является обратимым равновесным процессом, то к этой реакции применим закон действующих масс, и можно определить константу равновесия как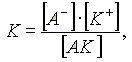
Билет № 19
Диссоциация воды Реакции, применяемые в аналитической химии, протекают, как правило, в водных растворах. Вода является одним из наименее диссоциированных веществ. Чистая вода очень плохо проводит электрический ток. Однако вода все же диссоциирует на водородные и гидроксидные ионы: 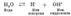
При температуре 22 °С в каждом литре воды 1 • 10
7 моля диссоциировано на ионы. Ионное произведение воды Произведение концентраций ионов Н+ и ОН- величина постоянная:[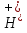 ] [ ] [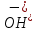 ] = const. Если изменить один из сомножителей, то обязательно должен измениться и другой, для того, чтобы произведение осталось постоянным. Если, например, к чистой воде добавить столько кислоты, чтобы концентрация ионов водорода увеличилась в 100 раз, то, чтобы произведение [ ] = const. Если изменить один из сомножителей, то обязательно должен измениться и другой, для того, чтобы произведение осталось постоянным. Если, например, к чистой воде добавить столько кислоты, чтобы концентрация ионов водорода увеличилась в 100 раз, то, чтобы произведение [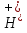 ] [ ] [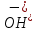 ] осталось равным 1 • 10"14, концентрация гидроксид-ионов должна понизиться в 100 раз. Следовательно, если увеличить концентрацию ионов Н+, то концентрация ионов ОН- уменьшится во столько же раз, и наоборот. ] осталось равным 1 • 10"14, концентрация гидроксид-ионов должна понизиться в 100 раз. Следовательно, если увеличить концентрацию ионов Н+, то концентрация ионов ОН- уменьшится во столько же раз, и наоборот.
Водородный показатель Водородный показатель, pH- мера активности (в очень разбавленных растворах она эквивалентна концентрации) ионов водорода в растворе, и количественно выражающая его кислотность, вычисляется как отрицательный (взятый с обратным знаком) десятичный логарифм активности водородных ионов, выраженной в молях на литр: 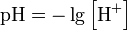
Билет № 20.
|
|
|
 Скачать 295.59 Kb.
Скачать 295.59 Kb.


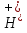 ] [
] [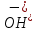 ] = const. Если изменить один из сомножителей, то обязательно должен измениться и другой, для того, чтобы произведение осталось постоянным. Если, например, к чистой воде добавить столько кислоты, чтобы концентрация ионов водорода увеличилась в 100 раз, то, чтобы произведение [
] = const. Если изменить один из сомножителей, то обязательно должен измениться и другой, для того, чтобы произведение осталось постоянным. Если, например, к чистой воде добавить столько кислоты, чтобы концентрация ионов водорода увеличилась в 100 раз, то, чтобы произведение [