Биохимия мышечного сокращения. Биохимия мышечного сокращения
 Скачать 1.05 Mb. Скачать 1.05 Mb.
|
|
Биохимия мышечного сокращения. Содержание Введение 3 1.Строение мышц 4 2.Химический состав мышечной ткани 10 3.Мышечное сокращение 12 4.Источники энергии для мышечной работы 14 Заключение 18 Список литературы 19 ВведениеПодвижность является характерным свойством всех форм жизни. Направленное движение имеет место при расхождении хромосом в процессе клеточного деления, активном транспорте молекул, перемещении рибосом в ходе белкового синтеза, сокращении и расслаблении мышц. Мышечное сокращение - наиболее совершенная форма биологической подвижности. В основе любого движения, в том числе и мышечного, лежат общие молекулярные механизмы. У человека различают несколько видов мышечной ткани. Поперечнополосатая мышечная ткань составляет мышцы скелета (скелетные мышцы, которые мы можем сокращать произвольно). Гладкая мышечная ткань входит в состав мышц внутренних органов: желудочно-кишечного тракта, бронхов, мочевыводящих путей, кровеносных сосудов. Эти мышцы сокращаются непроизвольно, независимо от нашего сознания. B данной главе мы рассмотрим строение и процессы сокращения и расслабления скелетных мышц, поскольку именно они представляют наибольший интерес для биохимии спорта. Строение мышцПри изучении скелетных мышц с помощью светового микроскопа в них обнаружили поперечную исчерченность; отсюда их название поперечнополосатые. B скелетной мышце выделяют сухожильную головку, которой мышца начинается на кости, мышечное брюшко, состоящее из волокон, и сухожильный хвост, которым мышца заканчивается на другой кости (рис. 1). Мышечное волокно - структурная единица мышцы. Известны три типа мышечных волокон: белые быстро сокращающиеся (VT), промежуточные (FR) и медленно сокращающиеся (ST). Биохимически они различаются механизмами энергетического обеспечения мышечного сокращения. Их иннервируют разные мотонейроны, чем обусловлены неодновременность включения в работу и различная скорость сокращения волокон. Разные мышцы имеют разное сочетание типов волокон. Каждая мышца состоит из нескольких тысяч мышечных волокон, объединяемых соединительными прослойками и такой же оболочкой. Мышца представляет собой многокомпонентный комплекс. Чтобы разобраться в строении мышцы следует изучить все уровни ее организации и структуры, входящие в ее состав (схема 1). 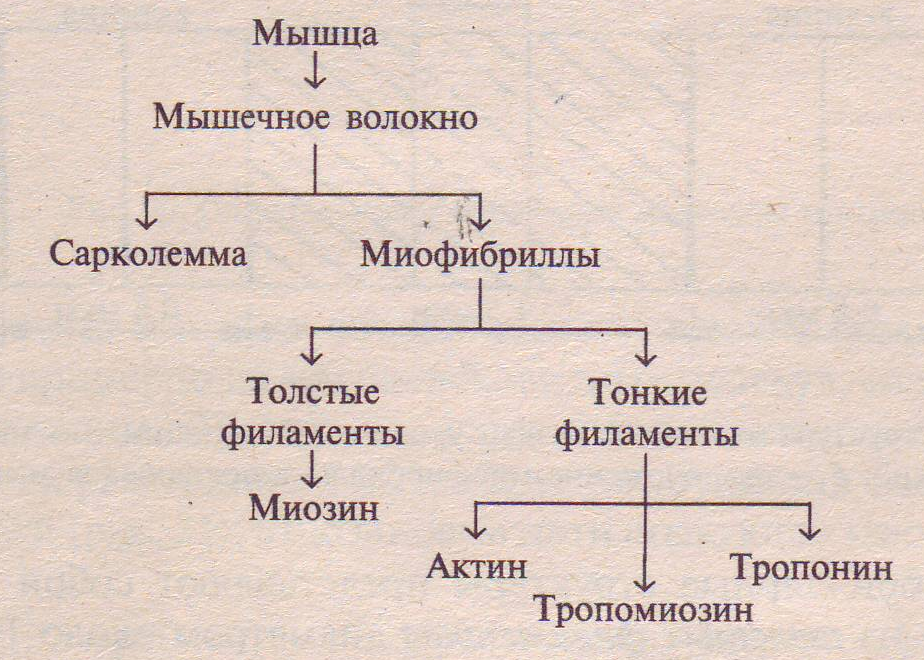 Схема 1. Уровни структурной организации мышцы Строение мышечного волокна. Мышечные волокна построены из продольно расположенных миофибрилл диаметром около 1 мкм, в которых видны чередующиеся темные и светлые диски. Темные диски обладают двойным лучепреломлением и называются А-(анизотропными) дисками; светлые диски, необладающие двойным лучепреломлением, называются I-(изотропными) дисками (рис. 2). В середине диска I расположена плотная линия Z, которая пронизывает все волокно, как бы удерживая миофибриллы в пучке и одновременно упорядочивая расположение А- и I-дисков многих миофибрилл. Пучок миофибрилл от одной до другой Z-линии называется саркомером. Диски А имеют в середине более светлую полосу - зону Н, пересекаемую более темной М-зоной. В одной миофибрилле может содержаться до 1000-1200 саркомеров. Каждый саркомер включает: 1) сеть поперечных трубочек, ориентированных под углом 90° к продольной оси волокна и соединяющихся с наружной поверхностью клетки; 2) саркоплазматический ретикулум, составляющий 8-10% объема клетки; 3) несколько митохондрий. Миофибриллярные структуры представляют собой агрегаты, состоящие из толстых филаментов диаметром около 14 нм и из расположенных между ними тонких филаментов диаметром 7-8 нм. Филаменты располагаются таким образом, что тонкие входят своими концами в промежутки между толстыми. Диски I состоят только из тонких филаментов, а диски А- из филаментов двух типов. Зона Н содержит только толстые филаменты, линия Z скрепляет тонкие филаменты между собой. Между толстыми и тонкими филаментами расположены поперечные мостики (спайки) толщиной около 3 нм, расстояние между этими мостиками 40 нм. Толстые филаменты состоят из белка миозина. Общая структура миозина показана на рисунке 3. Палочковидная молекула миозина состоит из двух идентичных основных цепей (по 200 кДа) и четырех легких цепей (по 20 кДа), общая масса миозина около 500 кДа. Миозин состоит из глобулярной, образующей две головки, части, присоединенной к очень длинному стержню. Стержень представляет собой двухцепочечную а-спирализованную суперспираль. Молекулы миозина объединяются, образуя филаменты, состоящие примерно из 400 палочковидных молекул, связанных друг с другом таким образом, что пары головок миозиновых молекул ложатся на расстоянии 14,3 нм друг от друга; они располагаются по спирали (рис. 4). Миозиновые нити стыкуются «хвост к хвосту». Миозин выполняет три биологически важные функции: • При физиологических значениях ионной силы и рН молекулы миозина спонтанно образуют волокно. • Миозин обладает каталитической активностью, т. e. является ферментом. В 1939 г. В.А. Энгельгардт и М.Н. Любимова обнаружили, что миозин способен катализировать гидролиз АТФ. Эта реакция является непосредственным источником свободной энергии, необходимой для мышечного сокращения. • Миозин связывает полимеризованную форму актина - основного белкового компонента тонких миофибрилл. Именно это взаимодействие, как будет показано ниже, играет ключевую роль в мышечном сокращении. Тонкие филаменты состоят из актина, тропомиозина и тропонина. Основным компонентом тонких филаментов является актин - водорастворимый глобулярный белок с молекулярной массой 42 кДа; эта форма актина обозначается как G-актин. В мышечном волокне актин находится в полимеризованной форме, которая обозначается как F-актин. Тонкие филаменты мышцы образованы двунитчатыми актиновыми структурами, связанными между собой нековалентными связями. Тропомиозин представляет собой палочкообразную молекулу с молекулярной массой 70 кДа, состоящую из двух разных a-спиральных полипептидных цепей, закрученных относительно друг друга. Эта сравнительно жесткая молекула располагается в желобке спиральной цепочки F-актина; ее протяженность соответствует 7 G-актиновым мономерам. Третий компонент тонких филаментов - тропонин (Тн), молекулярная масса которого около 76 кДа. Он представляет собой сферическую молекулу, состоящую из трех разных субъединиц, получивших название в соответствии с выполняемыми функциями: тропомиозинсвязывающей (Тн-Т), ингибирующей (Тн-I) и кальцийсвязывающей (Тн-С). Каждый компонент тонких филаментов соединяется с двумя другими нековалентными связями: B мышце, где все рассмотренные компоненты собраны вместе в тонком филаменте (рис. 5), тропомиозин блокирует присоединение миозиновой головки к находящемуся рядом F-актиновому мономеру. Кальций, связываясь с Тн-С, значительно изменяет конформацию белка, увеличивая степень взаимодействия между субъединицами тропонина и одновременно ослабляя связь между Тн-I и F-актином. Это приводит к перемещению молекулы тропомиозина по желобку тонкого филамента. Результатом такого движения является открытие миозинсвязывающего центра на поверхности актина. Актив-тропомиозин-тропонинмиозиновый комплекс характеризуется как Са Рассмотрев сократительные элементы мышцы, перейдем к изучению других элементов, которые выполняют важные функции в мышечном сокращении. Мышечное волокно состоит из клеток, окруженных электровозбудимой мембраной - сарколеммой, которая, как и любая другая мембрана, имеет липопротеиновую природу (толщина бимолекулярного слоя около 10 нм). Сарколемма отгораживает внутреннее содержимое мышечного волокна от межклеточной жидкости. Подобно другим мембранам, сарколемма имеет избирательную проницаемость для различных веществ. Через нее не проходят высокомолекулярные вещества (белки, полисахариды и др.), но проходят глюкоза, молочная и пировиноградная кислоты, кетоновые тела, аминокислоты и короткие пептиды. Перенос через сарколемму носит активный характер (осуществляется с помощью посредников), что позволяет накапливать внутри клетки некоторые вещества в большей концентрации, чем снаружи. Избирательная проницаемость сарколеммы играет большую роль в возникновении возбуждения в мышечном волокне. Сарколемма проницаема для катионов калия, которые накапливаются внутри мышечного волокна. В то же время она содержит «ионный насос», выводящий из клетки катионы натрия. Концентрация катионов натрия в межклеточной жидкости выше, чем концентрация катионов калия внутри клетки; кроме того, во внутренних зонах волокна содержится значительное количество органических анионов. Все это приводит к возникновению на наружной поверхности сарколеммы избытка положительных, а на внутренней - отрицательных зарядов. Разность зарядов приводит к возникновению мембранного потенциала, который в состоянии покоя мышечного волокна равен 90-100 мВ и является необходимым условием возникновения и проведения возбуждения. Внутриклеточная жидкость называется саркоплазмой. В саркоплазме локализованы органические вещества, минеральные соли, а также субклеточные частицы: ядра, митохондрии, рибосомы, функция которых заключается в регуляции обмена веществ в мышечном волокне путем воздействия на синтез специфических мышечных белков. Внутри саркоплазмы находится система продольных и поперечных трубочек, мембран, пузырьков, носящая название саркоплазматический ретикулум (SR). Толщина мембран SR около 6 нм. Саркоплазматический ретикулум делит саркоплазму на отдельные отсеки, в которых протекают различные биохимические процессы. Пузырьки и трубочки оплетают каждую миофибриллу. Через трубочки, связанные с наружной клеточной мембраной, возможен прямой обмен веществами между клеточными органеллами и межклеточной жидкостью. Трубочки могут служить и для распространения волны возбуждения от наружной мембраны волокна к внутренним его зонам. Мембраны пузырьков, прилегающих к миофибриллам, содержат белки, связывающие катионы кальция. Значение саркоплазматического ретикулума очень велико. Он связан непосредственно с сокращением и расслаблением мышцы, регулируя освобождение катионов кальция в мышечном волокне. Кроме того, к части саркоплазматического ретикулума прикреплены рибосомы, назначением которых является синтез белков. B той части ретикулума, где нет рибосом, синтезируется ряд необходимых мышечному волокну веществ: липидов, кликогена. Одним из важнейших структурных компонентов мышечного волокна являются митохондрии. Число митохондрий в мышечном волокне очень велико, и располагаются они цепочками вдоль миофибрилл, тесно прилегая к мембранам ретикулума. Как и у всякой клетки (оговоримся, что применение этого термина к мышечному волокну не совсем корректно), у мышечного волокна есть ядра, которые располагаются под сарколеммой. Ядро отделено от саркоплазмы двумя мембранами, одну из которых (внутреннюю) можно назвать ядерной, а вторая (наружная) является оболочкой ядра, переходящей в мембрану ретикулума. Пространство между этими двумя мембранами сообщается с канальцами саркоплазматического ретикулума. Внутри ядра находится ядрышко и хроматин. B состав хроматина входит ДНК, белки и низкомолекулярные РНК. В ДНК закодирована информация о структуре всех белков, синтезируемых в мышечном волокне. B мышечном волокне есть и лизосомы, в которых локализованы гидролитические ферменты, расщепляющие белки, липиды и полисахариды. При очень интенсивной мышечной работе происходит нарушение мембран лизосом (либо увеличение их проницаемости) и в саркоплазму выходят ферменты, расщепляющие локализовaнные в ней биополимеры. Но это явление - не дисфункция. Химический состав мышечной тканиХимический состав мышц млекопитающих представлен в таблице 1. Как видно из таблицы 72-80% массы мышцы составляет вода. Большую часть сухого остатка (16-21%) образуют белки, остальное - органические вещества и минеральные соли. Таблица 1 Химический состав мышц млекопитающих (по Збарскому)
Распределение белков в клетке выглядит так: в миофибриллах - 4% всех мышечных белков, в саркоплазме - 30%, в митохондриях - 14%, в сарколемме - 15%, в ядрах и других клеточных органеллах - около 1%. Кроме основных сократительных белков, характеристика которых была дана выше, следует отметить еще два: миостромин и миоглобин. Миостромин участвует в образовании сарколеммы и линии Z. Миоглобин - белок, по строению и функции подобный гемоглобину; первичная структура миоглобина приведена выше. В отличие от гемоглобина он не обладает четвертичной структурой; однако сродство миоглобина к кислороду намного выше, чем у гемоглобина. B мышцах человека содержится дипептид карнозин (аланилгистидин), который принимает участие в ферментативном переносе фосфатных групп и оказывает стимулирующее влияние на передачу импульсов с нерва на мышцу, а также участвует в восстановлении утомленных мышц. Из органических веществ небелковой природы отметим АТФ, креатинфосфат и гликоген. АТФ является главным источником энергии для мышечного сокращения, креатинфосфат - первый резерв ресинтеза АТФ; гликоген - основной запасной источник энергии в мышце. Фосфатиды и холестерин входят в состав различных мембран мышечного волокна. Свободные аминокислоты используются биосинтезе мышечных белков. B мышце содержится ряд промежуточных продуктов обмена углеводов. К ним относятся, прежде всего, пировиноградная и молочная кислоты, а также ферменты гликолиза. Из минеральных веществ в мышцах имеются главным образом катионы К Мышечное сокращениеB основе мышечного сокращения лежат два процесса: • спиральное скручивание сократительных белков; • циклически повторяющееся образование и диссоциация комплекса между цепью миозина и актином. Мышечное сокращение инициируется приходом потенциала действия на концевую пластинку двигательного нерва, где выделяется нейрогормон ацетилхолин, функцией которого является передача импульсов. Сначала ацетилхолин взаимодействует с ацетилхолиновыми рецепторами, что приводит к распространению потенциала действия вдоль сарколеммы. Все это вызывает увеличение проницаемости сарколеммы для катионов Na Генерация силы (укорочение) обусловлена характером взаимодействия между миозином и актином. На миозиновом стержне имеется подвижный шарнир, в области которого происходит поворот при связывании глобулярной головки миозина с определенным участком актина. Именно такие повороты, происходящие одновременно в многочисленны участках взаимодействия миозина и актина, являются причиной втягивания актиновых филаментов (тонких нитей) в H-зону. Здесь они контактируют (при максимальном укорочении) или даже перекрываются друг с другом. Энергию для этого процесса поставляет гидролиз АТФ. Когда АТФ присоединяется к головке молекулы миозина, где локализован активный центр миозиновой АТФазы, связи между тонкой и толстой нитями не образуется. Появившийся катион кальция нейтрализует отрицательный заряд АТФ, способствуя сближению с активным центром миозиновой АТФазы. В результате происходит фосфорилирование миозина, т. e. миозин заряжается энергией, которая используется для образования спайки с активом и для продвижения тонкой нити. После того как тонкая нить продвинется на один «шаг», АДФ и фосфорная кислота отщепляются от актомиозинового комплекса. Затем к миозиновой головке присоединяется новая молекула АТФ, и весь процесс повторяется со следующей головкой молекулы миозина. Затрата АТФ необходима и для расслабления мышц. После прекращения действия двигательного импульса Са B этих условиях эластические силы стромы, деформированной в момент сокращения, берут верх, и мышца расслабляется. При этом тонкие нити извлекаются из пространства между толстыми нитями диска A, зона H и диск I приобретают первоначальную длину, линии Z отдаляются друг от друга на прежнее расстояние. Мышца становится тоньше и длиннее. Скорость гидролиза АТФ при мышечной работе огромна: до 10 мк моль на 1 г мышцы за 1 мин. Общие запасы АТФ невелики, поэтому для обеспечения нормальной работы мышц АТФ должна восстанавливаться с той же скоростью, с какой она расходуется. Источники энергии для мышечной работыПокоящаяся мышца, подобно другим тканям, для поддержания постоянства своего состава и непрерывного протекания метаболических процессов, требует постоянного обеспечения АТФ. B то же время мышца сильно отличается от других тканей тем, что ее потребность в энергии в форме АТФ при сокращений мышцы может почти мгновенно возрастать в 200 раз. Содержание АТФ в мышце относительно постоянно: около 0,25% массы мышцы. Большая концентрация АТФ приводит к угнетению миозиновой АТФазы, что препятствует образованию спаек между миозином и актином, а следовательно - мышечному сокращению. С другой стороны, концентрация АТФ не может быть ниже 0,1%, поскольку при этом перестает действовать кальциевый насос в пузырьках саркоплазматического ретикулума, и мышца будет сокращаться вплоть до полного исчерпания запасов АТФ и развития ригора - стойкого непреходящего сокращения. Запасов АТФ в мышце достаточно на 3-4 одиночных сокращения. Следовательно, необходимо постоянное и весьма интенсивное восполнение АТФ - ее ресинтез. Ресинтез АТФ при мышечной деятельности может осуществляться как в ходе реакций, идущих в анаэробных условиях, так и за счет окислительных превращений в клетках, связанных с потреблением кислорода. В скелетных мышцах выявлены три вида анаэробных процессов, в ходе которых возможен ресинтез АТФ, и один аэробный. Рассмотрим все процессы ресинтеза АТФ в мышце и порядок их включения. Креатинкиназная реакция. Первым и самым быстрым процессом ресинтеза АТФ является креатинкиназная реакция. Креатинфосфат (Кф) - макроэргическое вещество, которое при исчерпании запасов АТФ в работающей мышце отдает фосфорильную группу на АДФ: Кф + АДФ ↔ К + АТФ Катализирует этот процесс креатинкиназа, которая относится к фосфотрансферазам (по названию фермента назван рассматриваемый процесс). АТФ и креатин находятся рядом и вблизи от сократительных элементов мышечного волокна. Как только уровень АТФ начинает снижаться, немедленно запускается креатинкиназная реакция, обеспечивающая ресинтез АТФ. Скорость расщепления Кф в работающей мышце прямо пропорциональна интенсивности выполняемой работы и величине мышечного напряжения. B первые секунды после начала работы, пока концентрация Кф высока, высока и активность креатинкиназы. Почти все количество АДФ, образовавшейся при распаде АТФ, вовлекается в этот процесс, блокируя тем самым другие процессы ресинтеза АТФ в мышце. После того как запасы Кф в мышцах будут исчерпаны примерно на 1/3, скорость креатинкиназной реакции будет снижаться; это вызовет включение других процессов ресинтеза АТФ. Креатинкиназная реакция обратима. Во время мышечной работы преобладает прямая реакция, пополняющая запасы АТФ, в период покоя - обратная реакция, восстанавливающая концентрацию Кф в мышце. Однако ресинтез Кф возможен от части и по ходу длительной мышечной работы, совершаемой в аэробных условиях. Креатинкиназная реакция играет основную роль в энергообеспечении кратковременных упражнений максимальной мощности - бег на короткие дистанции, прыжки, метание, тяжелоатлетические упражнения. Гликолиз. Следующий путь ресинтеза АТФ - гликолиз. Ферменты, катализирующие реакции гликолиза, локализованы на мембранах саркоплазматического ретикулума и в саркоплазме мышечных клеток. Гликогенфосфорилаза и гексокиназа - ферменты гликогенолиза и первой реакции гликолиза - активируются при повышении в саркоплазме содержания АДФ и фосфорной кислоты. Энергетический эффект гликолиза невелик и составляет всего 2 моль АТФ на 1 моль глюкозо-1-фосфата, полученного при фосфоролизе гликогена. Кроме того, следует учесть, что примерно половина всей выделяемой энергии в данном процессе превращается в тепло и не может использоваться при работе мышц; при этом температура мышц повышается до 41-42°С. Конечным продуктом гликолиза является молочная кислота. Накапливаясь в мышцах, она вызывает изменение концентрации ионов водорода во внутриклеточной среде, т. e. происходит сдвиг рН среды в кислую область. B слабокислой среде происходит активация ферментов цепи дыхания в митохондриях, с одной стороны, и угнетение ферментов, регулирующих сокращение мышц (АТФазы миофибрилл) и скорость ресинтеза АТФ в анаэробных условиях, с другой. Но, прежде чем перейти к рассмотрению процесса ресинтеза АТФ в аэробных условиях, отметим, что гликолиз играет важную роль в энергообеспечении упражнений, продолжительность которых составляет от 30 до 150 с. К ним относятся бег на средние дистанции, плавание на 100 и 200 м, велосипедные гонки на треке и др. За счет гликолиза совершаются длительные ускорения по ходу упражнения и на финише дистанции. Ресинтез АТФ в аэробных условиях. Аэробным процессом ресинтеза АТФ служит окисление глюкозы до оксида углерода (IV) и воды. Сопоставляя энергетические эффекты гликолиза и полного распада глюкозы в аэробных условиях, можно констатировать, что второй процесс отличается наибольшей производительностью. Общий выход энергии при аэробном процессе в 19 раз превышает таковой при гликолизе. Обратим внимание на тот факт, что АТФ, образующаяся в митохондриях при окислительном фосфорилировании, недоступна АТФазам, локализованным в саркоплазме мышечных клеток, так как внутренняя мембрана митохондрий непроницаема для заряженных нуклеотидов. Поэтому существует система активного транспорта АТФ из матрикса митохондрий в саркоплазму. Сначала транслоказа осуществляет перенос АТФ из матрикса через внутреннюю мембрану в межмембранное пространство, где АТФ вступает во взаимодействие с креатином, проникающим из саркоплазмы. Это взаимодействие катализирует митохондриальная креатинкиназа, которая локализована во внешней мембране митохондрий. Образующийся креатинфосфат снова переходит в саркоплазму, где отдает снятый с АТФ остаток фосфорной кислоты на саркоплазматическую АДФ. Эффективность образования АТФ в процессе окислительное фосфорилирования зависит от снабжения мышцы кислородом. B работающей мышце запасы кислорода невелики: небольшое количество кислорода растворено в саркоплазме, часть кислород находится в связанном с миоглобином мышц состоянии. Основное количество кислорода, нужного мышце для аэробного ресинтез АТФ, доставляется через систему легочного дыхания и кровообращения. Для образования 1 моль АТФ в процессе окислительного фосфорилирования требуется 3,45 л кислорода; такое количество кислорода потребляется в покое за 10-15 мин, а при интенсивной мышечной деятельности - за 1 мин. Миокиназная реакция происходит в мышце при значительном увеличении концентрации АДФ в саркоплазме, когда возможности других путей почти исчерпаны или близки к тому. Суть этой реакции состоит в том, что при взаимодействии 2 молекул АДФ образуется 1 молекула АТФ: АДФ + АДФ Условия для включения миокиназной реакции возникают при выраженном мышечном утоплении. Поэтому миокиназную реакцию следует рассматривать как «аварийный» механизм. Миокиназная реакция мало эффективна, так как из двух молекул АДФ образуется только одна молекула АТФ. Возникшая в результате миокиназной реакции АМФ может путем дезаминирования превращаться в инозинмонофосфат, который не является участником энергетического обмена. Однако увеличение концентрации АМФ в саркоплазме оказывает активирующее действие на ряд ферментом гликолиза, что приводит к повышению скорости анаэробного ресинтеза АТФ. В данном случае миокиназная реакция выполняет роль своеобразного метаболического усилителя, способствующего передаче сигнала от АТФазы миофибрилл на АТФ-синтезирующие системы клетки. ЗаключениеМышечные ткани – это группа тканей организма различного происхождения, объединяемых по признаку сократимости: поперечнополосатая (скелетная и сердечная), гладкая, а также специализированные сократимые ткани – эпителиально-мышечная и нейроглиальная, входящая в состав радужки глаза. Поперечнополосатая скелетная мышечная ткань возникает из миотомов, входящих в состав элементов сегментированной мезодермы – сомитов. Гладкая мышечная ткань человека и позвоночных животных развивается в составе производных мезенхимы, так же как и ткани внутренней среды. Однако для всех мышечных тканей характерно сходное обособление в составе эмбрионального зачатка в виде клеток веретенообразной формы – мышцеобразовательных клеток, или миобластов. Сокращение мышечного волокна заключается в укорочении миофибрилл в пределах каждого саркомера. Толстые (миозиновые) и тонкие (актиновые) нити, в расслабленном состоянии связанные только концевыми отделами, в момент сокращения осуществляют скользящие движения навстречу друг другу. Выделение необходимой для сокращения энергии происходит в результате превращения АТФ в АДФ под влиянием миозина. Ферментная активность миозина проявляется при условии оптимального содержания Са2+, которые накапливаются в саркоплазматической сети. Список литературыБиохимия. Учеб.для ин-в ФК/под ред. Н.Н. Яковлева.- М.: Физкультура и спорт, 1974. Биохимия: учеб. Для ин-в ФК/ под ред. Меньшикова В.В., Волкова Н.И..- М.: Физкультура и спорт, 1986. Кнорре Д.Г., Мызина С.Д. Биологическая химия: учеб.для ст-в хим.биол. и мед.спец. вузов. – М.: высш.шк., 1998. Проскурина И. К. Биохимия: Учеб. пособие для студ. высш. учеб. Заведений. – Изд-во ВЛАДОС-ПРЕСС, 2003. – 164 с. Филиппович Ю.Б. Основы биохимии: Учеб.для ст-в хим. И биол.спец. пед. Унив-в и ин-в. – 3-е изд., перер. И доп. – М.: высш.школа, 1993 |
