Гемостаз. биохимия свертывания
 Скачать 0.84 Mb. Скачать 0.84 Mb.
|
|
Ф КГМУ 4/3-04/03 ИП №6 от 14 июня 2007г. КАРАГАНДИНСКИЙ ГОСУДАРСТВЕННЫЙ МЕДИЦИНСКИЙ УНИВЕРСИТЕТ КАФЕДРА БИОХИМИИ МЕТОДИЧЕСКОЕ ПОСОБИЕ МОДУЛЬ «КРОВЬ И КРОВЕТВОРНАЯ СИСТЕМА» ТЕМА: «БИОХИМИЯ СВЕРТЫВАНИЯ» Дисциплина: Bioh 2202 биологическая химия Специальность 5B130100 - Общая медицина Курс: 3 Объемных учебных часов: 4 ч. Составители: Бейникова И.В. Караганда 2017 Обсуждена и утверждена на заседании кафедры________________ Дата «___» «____» _____год Протокол №__________ Структура тромбоцитов. Нестимулированные тромбоциты – мелкие дисковидные двояковыпуклые безъядерные постклеточные структуры, образованные в результате фрагментации участков цитоплазмы мегакариоцитов, циркулирующие в крови в течение 5-10 дней и фагоцитирующиеся преимущественно макрофагами селезенки. Тромбоцит окружен плазмолеммой, содержащей многочисленные рецепторы к АДФ, адреналину, тромбину и фактору Виллебранда (GPIb/IX), коллагену (GPIa/IIa), фактору Xа, фибриногену (GPIb/IIa), фибронектину и ламинину (GPIс/IIa). Тромбоцит включает в себя периферическую часть – гиаломер, содержащий систему канальцев, открывающихся в инвагинации плазмолеммы (осуществляют экзоцитоз содержимого гранул тромбоцитов), и систему микротрубочек, образованных комплексом Гольджи, частично сконцентрированных по периферии цитоплазмы (поддерживают каркас клетки) или разбросанных по всей цитоплазме (накапливают и выделяют Ca++, вырабатывают простагландины), а также актиновые миофиламенты, расположенных между микротрубочками; центральную часть – грануломер, содержащий митохондрии, гликоген, рибосомы, комплекс Гольджи и гранулы нескольких типов: α – гранулы содержат фибриноген, фибронектин, тромбоспондин, тромбоглобулин, тромбоцитарный фактор роста (PDGF), эндотелиальный фактор роста (EDGF), трансформирующий фактор роста (TGF-β), факторы свертывания V, VIII и фактор Виллебранда (ФВ), XIII, протеин S; δ – гранулы содержат АДФ, АТФ, Ca++, Mg++, пирофосфат, гистамин, серотонин; λ – гранулы (лизосомы) – содержат гидролитические энзимы; пероксисомы – содержат каталазу. Повреждение эндотелия сосудов сопровождается последовательностью процессов гемостаза: адгезия тромбоцитов, агрегация тромбоцитов (формирование белого, тромбоцитарного тромба); адгезия и агрегация тромбоцитов определяют первичный или сосудисто-тромбоцитарный гемостаз; гемокоагуляция (формирование красного, фибринового тромба), описывает коагуляционный или плазменный гемостаз; ретракция тромба, фибринолиз. 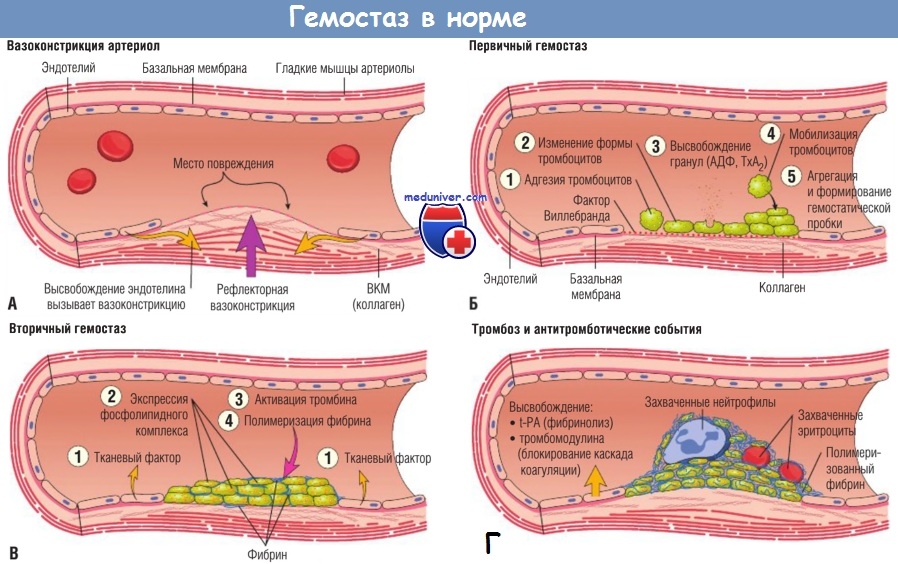
Первичный или сосудисто-тромбоцитарный гемостаз. Интактный эндотелий сосудов обладает тромборезистентностью благодаря отрицательному (одноименному) заряду на поверхности эндотелиоцитов и тромбоцитов (вызывает их взаимное отталкивание), выработке антиагрегантных и антикоагулятных веществ: эндотелиальный ингибитор агрегации тромбоцитов – простациклин (простагландин J, PGJ2), оксид азота (NO), гепарин, тромбомодулин (активатор протеина С), тканевой активатор плазминогена (t-PA). При повреждении эндотелия обнажается коллаген, к которому при участии факторов, выделяющихся как тромбоцитами, так и эндотелиоцитами, прикрепляются тромбоциты. Благодаря катехоламинам, выделившимся из тромбоцитов и эндотелиоцитов, происходит ваконстрикция сосудов, способствующий остановке кровотечения и сужения раневой поверхности. Поврежденный эндотелий вырабатывает вещества, обладающие проагрегантной и прокоагулятной активностью: тканевой тромбопластин (фактор III, ТФ), фактор Виллебранда (ФВ), фактор V, тромбина (фактор II), фибриногена (фактор I), ингибиторы активатора плазминогена (PAI-1 и PAI-2), интерлейкин-1, фактор некроза опухоли, эндотелин-1. Адгезия тромбоцитов – прилипание их к эндотелию сосуда в месте повреждения благодаря коннектированию с коллагеном через фибронектин и ламинин, опосредованному взаимодействием фактора Виллебранда и ионами Ca++ с гликопротеинами мембраны тромбоцита. Адгезия тромбоцитов сопровождается их стимулированием под влиянием тромбина и коллагена. Стимуляция тромбоцитов – детерминируется изменением их формы и размера, приобретением ими секреторной и метаболической активности. Стимулированные тромбоциты увеличиваются и распластываются по краям раневой поверхности, приобретают длинные отростки (псевдоподии). В центре и в псевдоподиях инициируется полимеризация актина микрофиламентов, сопровождающаяся сокращением микротубулярного кольца и сосредоточением внутриклеточных органелл в центре клетки, перемещением большинства микротрубочек и гранул в псевдоподии и инициацией ими секреторной и метаболической активности. Секреторная активность заключается в экзоцитозе содержимого гранул через систему канальцев в окружающую микросреду, а метаболическая активность – в активации фосфолипазы, циклооксигеназы и тромбоксансинтетазы с образованием арахидоновой кислоты, превращением ее в тромбоксаны (TxA2) через систему простагландинов (PGH2 и PGG2), способствующих ваконстрикции сосудов и агрегации тромбоцитов, а также в синтезе тромбоцитактивирующего фактора, усиливающего агрегацию тромбоцитов и вызывающего хемотаксис нейтрофилов. 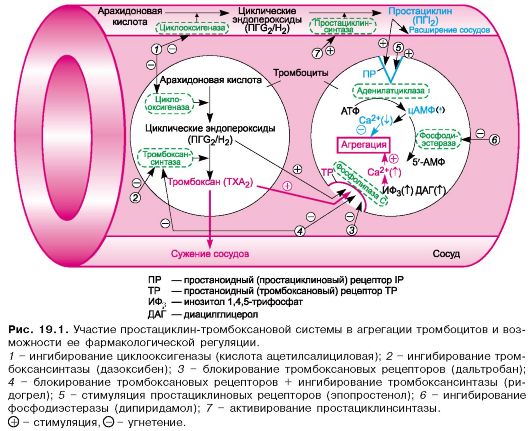 Агрегация тромбоцитов – слипание их друг с другом с образованием тромбоцитарных конгломератов (первичная гемостатическая пробка) детерминируется секрецией АДФ, серотонина, гистамина, адреналина, тромбина, тромбоксана А2 и фактора агрегации тромбоцитов как стимулированными тромбоцитами, так и другими участниками гемостаза (эндотелиоцитами, гранулоцитами и моноцитами крови). Тромбоцитарные конгломераты прошиваются фибриновыми мостиками, стабилизируемыми тромбоспондином. 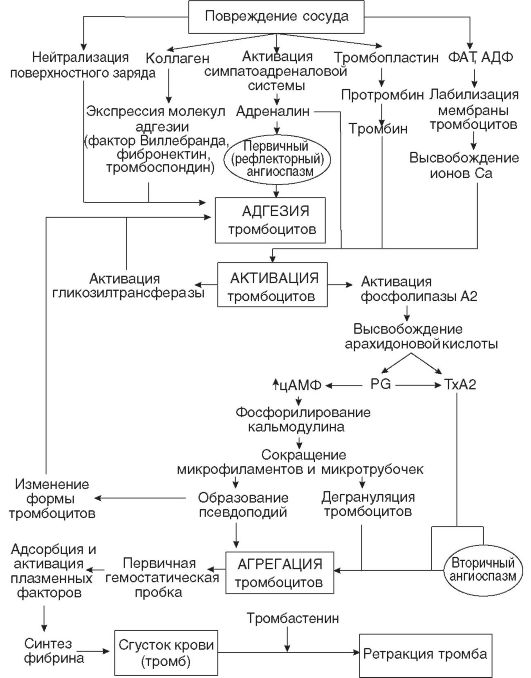 Коагуляционный или плазменный гемостаз. Гемокоагуляция – это сложный многоступенчатый процесс, сопровождающийся формированием вторичной гемостатической пробки путем активации каскадных аутокаталитических энзиматических механизмов. Заключительным этапом гемокоагуляции является формирование трехмерной сети фибрина с вовлечением форменных элементов крови, происходящим под влиянием тромбина. Все плазменные протеазы, за исключением ф.III, ф.IV, ф.VIII, синтезируются гепатоцитами и в норме присутствуют в крови в виде неактивных предшественников. Для синтеза ф.II, ф.VII, ф.IX, ф.X и протеина С необходима витамин К-зависимая γ-глутаматкарбоксилаза. Структурные аналоги витамина К – дикумарин и варфарин – ингибируют γ-глутаматкарбоксилазу. Активация свертывающей системы проходит по внешнему и внутреннему механизмам в зависимости от вызвавших ее причин: внешний – при повреждении эндотелия сосудов, внутренний – при присутствии аномальных (чужеродных, антигенных) поверхностей (белков) на внутренней стенке сосуда или при резком спазме сосуда под действием катехоламинов. Свертывание крови по внешнему механизму начинается при выделении тканевого тромбопластина (ф.IIIа, ТФ) из поврежденных эндотелиоцитов, который вызывает активацию ф.VIIа в присутствии ионов Ca++. Образованный комплекс при наличии ионов Ca++ активирует ф.X (протромбиназа). Свертывание крови по внутреннему механизму реализуется самоактивацией ф.XII (инициируется изменением заряда эндотелиоцита) при адсорбции прекалликреина и высомолекулярного кининогена в пределах аномальной поверхности эндотелия сосуда (в результате воспаления, атеросклеротических изменений, разрушения клетки). Калликреин активирует ф.XII и отщепляет кинин от брадикинина, который многократно активирует ф.XIIа и катализирует активацию ф.XI. Ф.XIа активирует ф.IX при участии ионов Ca++. Ф.IXа также в присутствии ионов Ca++ и ф.VIII активирует ф.X (протромбиназа). Ф.VIII (антигемофильный фактор) имеет доменное сходство с фактором V. Ф.VIII в норме циркулирует в крови будучи связанным с ФВ (фактором Виллебранда). Проявление ф.VIII своей активности происходит после отсоединения его от ФВ при действии тромбина. Таким образом, значение существования комплекса Ф.VIII+ФВ заключается в донесении ф.VIII до участка повреждения и стабилизации белка. Благодаря внешнему и внутреннему каскадам сериновых протеаз (активации факторов свертывания происходит частичным протеолизом) образуется тромбиназа (активный фактор Стюарта-Пауэра, ф.Xа). Тромбиназа осуществляет частичный протеолиз протромбина в тромбин (ф.IIа) на фосфолипидах агрегированных тромбоцитов в присутствии ионов Ca++ и ф.V. Тромбин гидролизует молекулы фибриногена в молекулы растворенных фибрин-мономеров (ф.Iа), отщепляя отрицательно заряженные концевые пептиды у 6 цепей фибриногена между аргинином и глутаминовой кислотой, соединенных между собой дисульфидными мостиками. Множество фибрин-мономеров при участии трансглутаминазы (ф.XIII) и ионов Ca++, образующей поперечные сшивки между радикалами лизина и глутамина, превращаются в нерастворимый фибрин-полимер – трехмерная сетчатая структура, которая способна задерживать в себе форменные элементы крови с образование кровяного сгустка. 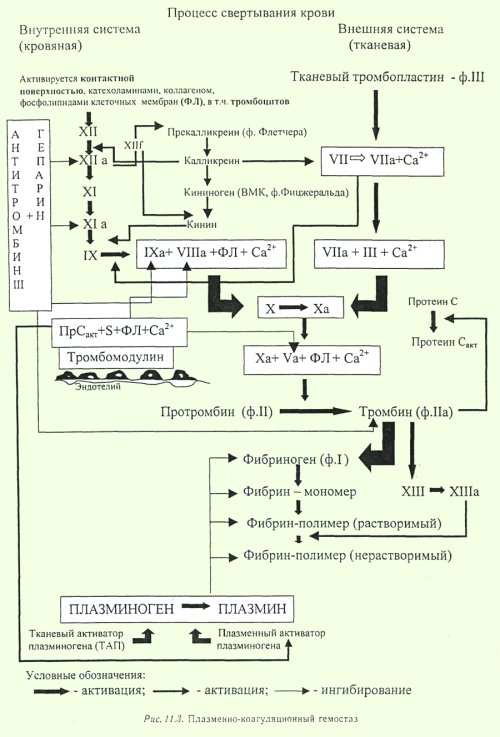 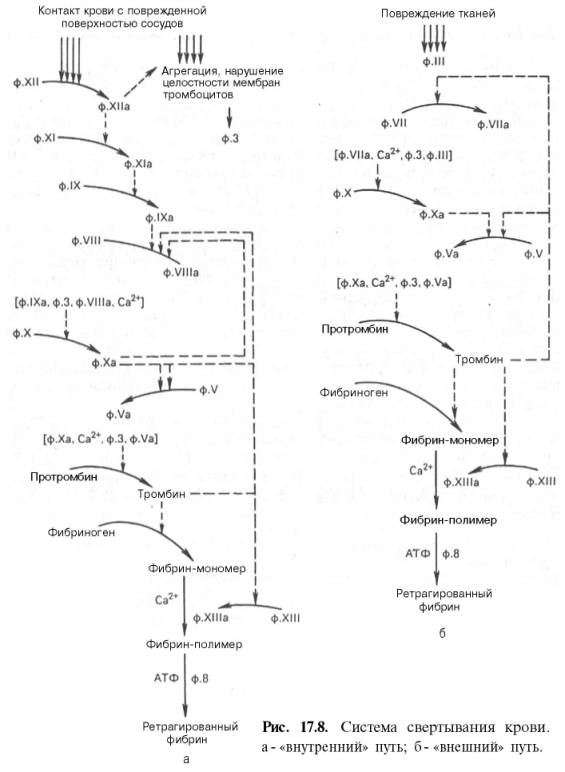 Продукция фибриногена инициируется повреждением тканей, воспалением, состояниями острой фазы. Тромбин, помимо образования фибрина, катализирует продукцию прокоагуляционных и антикоагуляционных факторов, ускоряет агрегацию тромбоцитов и миграцию лейкоцитов в месте повреждения, а также стимулируют репарацию тканей и регулируют сосудистый тонус. 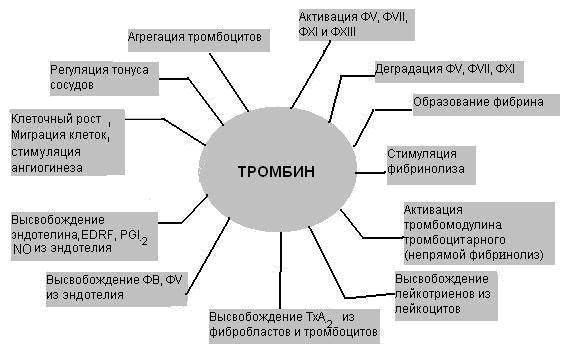 Ретракция тромба – сжимание тромба благодаря тромбостенину (ф.8 тромбоцитов), влияющему на цитоскелетный сократительный аппарат тромбоцитов и выжимающему плазму из кровяного сгустка. Фибринолиз – разрушение фибринового тромба после регенерации эндотелия сосудов под влиянием плазмина (фибринолизина) и гидролитических ферментов λ – гранул тромбоцитов. Предшественник плазмина – плазминоген – синтезируется в печени, почках и эозинофилах. Активация плазминогена регулируется его активаторами и ингибиторами. К активаторам плазминогена относятся ф.XIа, ф.XIIа, прекаллекреин и высокомолекулярный кининоген, тканевой активатор плазминогена (t-PA), урокиназа, стрептокиназа, стафилокиназа. К ингибиторам плазминогена относятся ингибитор активатора плазминогена (PAI) α2-антиплазмин, α2-макроглобулин, α1-антитрипсин, антитромбин III, ингибитор эстеразы С1. Тканевой активатор плазминогена (ТАП, t-PA) продуцируется эндотелиоцитами, моноцитами, мегакариоцитами и мезотелиоцитами, является сериновой протеазой, циркулирует в крови в комплексе со своим ингибитором (ингибитор активатора плазминогена – ИАП, PAI), имеет сродство с фибрином. При взаимодействии ТАП с плазминогеном преобразует плазминоген в плазмин, который расщепляет фибрин на отдельные фракции с обнажением лизиновых остатков, к которым в последующем присоединяется урокиназа. Плазмин в кровотоке быстро инактивируется ингибиторами, но сохраняет свою активность в фибриновом сгустке. Урокиназа обнаруживается в моче, относится к сериновым протеазам, синтезируется фибробластами, моноцитами/макрофагами и эндотелиоцитами, потенцирует действие ТАП, способствует разрушению межклеточного матрикса и миграции клеток. Изначально продуцируется одноцепочечная урокиназа, которая при взаимодействии с плазмином превращается в двухцепочечную урокиназу. Индуцирование действия ТАП также вызывает стрептокиназа (продуцируется стрептококками) и стафилокиназа (продуцируется Staphylococcus aureus). Ингибиторы активатора плазминогена (PAI-1, PAI-2, PAI-3). PAI-1 – основной ингибитор тканевого активатора плазминогена и двухцепочечной урокиназы (но не одноцепочечной). Продуцируется эндотелиоцитами, мегакариоцитами (депонируется в тромбоцитах) и мезотелиоцитами, является серпином. Продукция PAI-1 стимулируется тромбином, трансформирующим фактором роста β, тромбоцитарным фактором роста, интерлейконом-1, фактором некроза опухоли α, инсулиноподобным фактором роста, глюкокортикоидами. PAI-2 – основной ингибитор двухцепочечной урокиназы. Антикоагуляционная или противосвертывающая система. Одновременно с локальной активации свертывающей системы происходит повышение концентрации факторов противосвертывающей системы, самоограничивающей гемостаз и предотвращает его генерализацию. Большинство ингибиторов сериновых протеаз относятся к классу серпинов, механизм ингибирования которых базируется на взаимодействии между субстратсвязывающим участком активированного фактора гемостаза и активным центром ингибитора, в результате блокируется активный центр фермента (без гидролиза) и сериновая протеаза временно (обратимо) теряет свою протеолитическую активность. К серпинам относятся антитромбин III, гепариновый кофактор II, протеаза нексин-I, С1-ингибитор, протеин C и протеин S, α1-антитрипсин. Антитромбин III (АТ III) является основным ингибитором тромбина, ф.Xа, ф.IXа, ф.XIа, ф.XIIа в присутствии гепарина или гепарансульфата. Гепарин связывается с лизиновыми остатками активного центра ингибитора (антитромбина III), что способствует повышению доступности аргининового активного центра кофактора ингибитора (гепарина) для присоединения тромбина и других сериновых протеаз с последующей их инактивацией. После образования комплекса АТ III+тромбин гепарин диссоциирует из него для последующей инициации новых комплексов. Антитромбин III синтезируется в печени и называется также гепариновым кофактором I. Гепариновый кофактор II (ГК II) ингибирует исключительно тромбин в присутствии гепарина или дерматансульфата. Гепариновый кофактор II синтезируется в печени, его эффект менее выражен, чем у антитромбина III. Протеаза нексин-I (ПН-I) предотвращает связывание тромбина с мембранными гликопротеинами клеток. α1-антитрипсин нейтрализует ф.XIа и активированный протеин С. С1-ингибитор блокирует ф.XIIа и калликреин. Протеин C (ПС) является витамин К-зависимым ингибитором, синтезируемый гепатоцитами, циркулирует в крови в неактивной форме, активируется небольшой концентрацией тромбина в соединении с тромбомодулином в присутствии ионов Ca++, в таком комплексе тромбин проявляет свои антикоагуляционные свойства. Активированный протеин С в присутствии своего кофактора протеина S и ионов Ca++ и вызывает протеолиз аргининовых связей факторов ф.Vа и ф.VIIIа. Протеин S также является витамин К-зависимым, синтезируется гепатоцитами и эндотелиоцитами. Инактивация ф.Vа и ф.VIIIа способствует утрате коагулянтной активности ф.Xа и тромбина. Кроме того, активированный протеин С подавляет продукцию эндотелиоцитами ингибитора активатора плазминогена (PAI-1), тем самым стимулирует фибринолитическую активность. Ингибитор пути тканевого фактора (ИПТФ) является ф.Xа-зависимым ингибитором, относится к классу кунинов, механизм ингибирования которых основан на образовании прочного (необратимого) стехиометрического комплекса между сериновой протеазой с последующим гидролизом ингибитора. ИПТФ синтезируется эндотелиоцитами, мононуклеарами и гепатоцитами. ИПТФ последовательно соединяется с ф.Xа и с комплексом ТФ+ф.VIIа с последующей гидролизом всего комплекса. 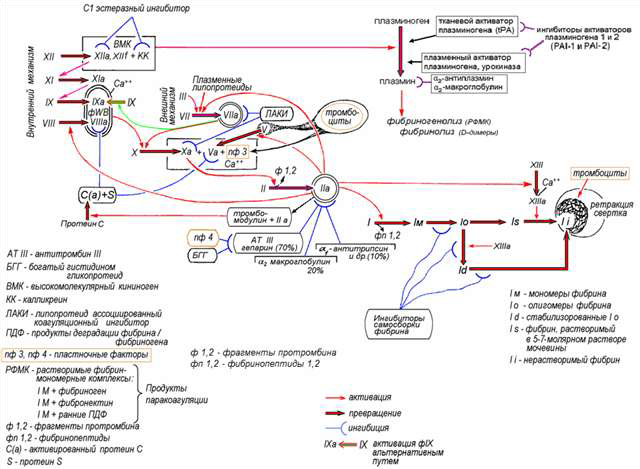 Гемофилии. 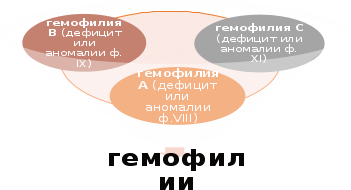 Все 3 типа гемофилии связаны с наследственной недостаточностью или аномалиями факторов свертывания, наследуется сцеплено с X-хромосомой. Поэтому все сыновья больных гемофилией здоровы, однако дочери обязательно являются носителями дефектной хромосомы. У женщин-носителей клинических проявлений не наблюдается, у мужчин острота патологических проявлений болезни будет зависеть от процента снижения активности данных факторов, характеризуется выраженной кровоточивостью: кровоизлияниями в суставы (гемартрозы), под кожу и мышцы (гематомы), посттравматическими и послеоперационными кровотечениями, вызывающими обширные гематомы, сдавливающие нервы и сосуды с возможным развитием гангрены конечностей и деструктивным изменениям органов и тканей. Синдром диссеминированного внутрисосудистого свертывания (ДВС-синдром). ДВС-синдром – приобретенное тромбогеморрагическое нарушение, спровоцированное чрезмерным образованием тромбина и плазмина в периферическом кровотоке. Тромбин вызывает распространенное отложение фибриновых сгустков в микроциркуляторном русле с чрезмерным напряжением и истощением свертывающего, калликреин-кининового, фибринолитического потенциалов, со значительным потреблением (агрегацией) тромбоцитов и специфических факторов свертывания. Плазмин в результате протеолиза фибрина и факторов свертывания утяжеляет развитие постгеморрагических осложнений ДВС. Таким образом, ключевым звеном в развитии ДВС-синдрома является тромбинемия. Острое течение ДВС-синдрома сопровождается последовательно развивающимися стадиями: I – гиперкоагуляция и агрегация тромбоцитов, II – нарастание коагулопатии и выявление тромбоцитопении, разнонаправленность изменения коагуляционных тестов; III – глубокая гипокоагулемия, достигающая полной несвертываемости крови, IV – восстановительная – при благоприятном исходе заболевания или осложненная – при неблагоприятном развитии процесса. 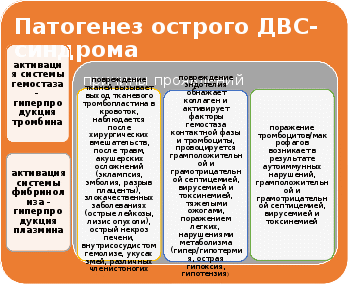  Клинические проявления ДВС-синдрома характеризуются повышенным образованием фибриновых тромбов, которые вызывают обструкцию микроциркуляторного русла и с последующим развитием полиорганной недостаточности в результате нарастания гипоксии и ацидоза тканей, дистрофии и дисфункции органов. Истощение потребления факторов системы гемостаза и фибринолиза приводит к одновременному и последовательному развитию частых тромбозов со склонностью к массивным кровотечениям, вызывающим геморрагический некроз тканей, стремительно нарастает олигурия вплоть до анурии. При хроническом течении ДВС-синдрома необходимо учитывать: состояние системы гемостаза, выраженность и локализацию тромбозов и геморрагий, выраженность и продолжительность гемодинамических расстройств, наличие и степень гипоксии и поражения внутренних органов при нарушении их микроциркуляции, степень анемизации, сдвиги электролитного баланса и кислотно-щелочного равновесия.
Маршалл В. Дж., Бангерт С.К. Клиническая биохимия. – Москва: БИНОМ. – 2015 г. – 408 с. Таганович А.Д., Олецкий Э.И., Котович И.Л. Патологическая биохимия. – Москва: БИНОМ. – 2013 г. – 448 с. Шиффман Фред Дж. Патофизиология крови. – Москва: БИНОМ. – 2009 г. – 448 с. | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
