Навигация по странице:Особенности строения простых и сложных белков на примере альбумина, глобинов плазмы, гемоглобина и миоглобина.Четвертичная структураФизико-химические свойства белков – заряд, набухание, растворимость, изоэлектрическая точка, высаливание, онкотическое давление, коагуляция, коацервация, вязкость.Изоэлектрическая точкаОнкотическое давлениеКоацервация3. Нарушение и восстановление структуры белка – фолдинг, денатурация и ренатурация.4. Биологические свойства белков – лигандность, нативность, специфичность, регулируемость и кооперативность.Специфичность7. Принципы классификации ферментов. Характеристика каждого класса ферментов.8. Специфичность действия ферментов.9. Значение кофакторов и коферментов. Витамины – как субстраты для образования коферментов, краткая10. Механизм действия ферментов12. Действие температуры и рН на ферментативную активность.13. Регуляция активности ферментов. Понятие об ингибировании и классификация видов ингибирования. Характеристика ингибирования по графическим зависимостям в координатах двойных обратных величин.14. Аллостерическая регуляция.18. Энзимодиагностика, энзимопатии и энзимотерапия.
|
Биохимия экзамен. бх. Биологическая химия биохимия полости рта Раздел Белки и ферменты
«Биологическая химия – биохимия полости рта»
Раздел «Белки и ферменты»
Белки – особенности строения полипептидной цепи. Уровни организации белковой молекулы. Особенности строения простых и сложных белков на примере альбумина, глобинов плазмы, гемоглобина и миоглобина. Принцип доменного строения белков.
Белки или протеины – линейные неразветвленные биополимеры, мономерами которых являются α-аминокислоты. В основе структурной организации белковых молекул лежит образование пептидных связей между аминокислотами
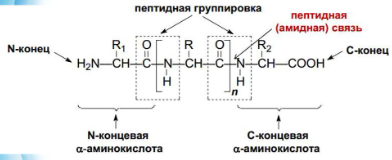
Каждый индивидуальный белок характеризуется специфичной аминокислотной последовательностью, которая называется первичной структурой белка.
Вторичная структура белков – это способ укладки полипептидной цепи в более компактную структуру за счѐт образования водородных связей между атомами пептидных групп.
Вторичная структура представлена α- спиралями, β-складчатыми слоями и нерегулярными участками.
α-Спираль – это палочкообразная структура, в которой пептидные связи расположены внутри, а боковые радикалы аминокислот – снаружи. α-Спирали стабилизированы водородными связями, которые параллельны оси спирали и возникают между первым и пятым аминокислотными остатками
β-Складчатый слой–это плоские структуры, в которых полипептидная цепь стабилизирована внутри-и межмолекулярными водородными связями и имеет форму сложенного «гармошкой» листа
Нерегулярные вторичные структуры или беспорядочные клубки –образуют специфическую для каждого белка конформацию, состоящую из петлеобразных и кольцеобразных структур. Их значение состоит в компактизации белковой молекулы и правильной организации третичной структуры.
Третичная структура – способ укладки полипептида в трехмерном пространстве. Функционально активную конформацию называют нативной структурой белка. По форме третичной структуры белки делятся на глобулярные (имеющие элипсовидную форму)и фибриллярные (нитевидные, вытянутые)
Четвертичная структура – пространственное взаиморасположение нескольких полипептидных цепей, объединѐнных слабыми взаимодействиями.
Домен – это часть молекулы протеина, которая стабильна вне зависимости от остальной цепи или может перемещатся относительно целого белка как самостоятельная единица. Они имеют самостоятельную третичную структуру, аналогичную глобулярным белкам
Физико-химические свойства белков – заряд, набухание, растворимость, изоэлектрическая точка, высаливание, онкотическое давление, коагуляция, коацервация, вязкость.
Суммарный заряд макромолекулы определяется соотношением ионизированных катионных и анионных групп. Белки – это полиэлектролиты и полиамфолиты. Так как на поверхности макромолекулы образуется двойной электрический слой.
Набухание-проникновение растворителя в полимерное вещество, сопровождаемое увеличением массы и объема. (белки проявляют гидрофильные свойства, при набухании образуют студни)
Растворимость белков зависит от молекулярной массы, формы, заряда и т.д., кроме того от природы растворителя, присутствия в нем растворенных низкомолекулярных веществ. По способности белков растворятся в воде, они делятся на две группы:
1) Растворимые белки (белки цитоплазмы, митохондриального матрикса, межклеточной жидкости и др.).
2) Нерастворимые белки (мембраносвязанные белки, фибриллярные белки: кератин, коллаген и др.).
Растворимость белков проходит в два этапа – набухание и растворение.
Изоэлектрическая точка -значение рН среды, при котором белок приобретает суммарный нулевой заряд
Высаливание-это процесс осаждения белков растворами солей высокой концентрации
Механизм: добавляемые катионы и анионы разрушают гидратную оболочку и одновременно, нейтрализуют заряд белка
Онкотическое давление- аномально высокое значение осмотического давления ВМС в крови.
Коагуляция – способность белков частично или полностью терять растворимость и переходить в гелеобразную фазу.
Коацервация- процесс расслоения на две фазы – жидкую и гелеобразную
Вязкость-(Аномальная вязкость растворов – связана с сильными межмолекулярными взаимодействиями между растворенными белками.)
3. Нарушение и восстановление структуры белка – фолдинг, денатурация и ренатурация.
Фолдинг белков – процесс свѐртывания полипептидной цепи в трѐхмерную пространственную биологически активную структуру, т.е. процесс, в ходе которого белок приобретает вторичную, третичную и, в некоторых случаях, четвертичную структуру.
Вначале формируются локальные вторичные структуры, затем происходит взаимодействие между удалѐнными участками цепи. Этот процесс протекает до момента формирования доменов, и гидрофобного ядра. В конце белок принимает структуру, которая обеспечивает биологическую активность.
Денатурация – процесс разрушения четвертичной, третичной и частично вторичной структуры белковой молекулы, что приводит к потере нативных свойств. Процесс денатурации обусловлен разрушением большого числа слабых связей и взаимодействий и утратой высокоспецифичной структуры белковой молекулы. Денатурация может быть необратимой и обратимой.
Явление восстановления нативной структуры и биологической активности белков называют ренатурацией. Ренатурация характерна для термостабильных белков микроорганизмов термальных источников.
4. Биологические свойства белков – лигандность, нативность, специфичность, регулируемость и кооперативность.
Лигандность – способность белка или фермента образовывать нековалентные взаимодействия с определѐнными веществами – лигандами. Процесс является обратимым и биоспецифичным. Комплементарное связывание белка с лигандом обеспечивается за счѐт активного центра белка В ферментативных реакциях лиганды называются субстратами.
Нативность– для выполнения своей функции белок должен находиться в природном состоянии, иметь определѐнную структуру в трѐхмерном пространстве, которая обеспечивает эффективное взаимодействие с лигандами.
Специфичность – соответствие лигандов (субстратов) активному центру белка (фермента). Специфичность может быть абсолютной и относительной.
Регулируемость – сродство лигандов к белкам в значительной мере зависит как от внешних факторов, а также от конформации молекулы протеина. Меняя трехмерную структуру белка, можно изменять скорость и степень связывания молекул на несколько порядков. Этот эффект реализуется при действии низкомолекулярных регуляторов, которые называются эффекторы.
Кооперативность – свойство четвертичных белков и ферментов менять сродство к молекулам лигандов из-за конформационных изменений в мультимерном комплексе. То есть изменения в одной субъединице влияют на свойства всех остальных белков в надмолекулярной структуре.
5. Классификации белков по биологической роли, по устойчивости к действию температуры, по форме молекул, по химическому строению и аминокислотному составу. Свойства и биологическая роль сложных белков.
По биологическим функциям
Структурная функция.
Вещество соединительной ткани и межклеточный матрикс формируют такие белки, как коллаген, эластин, кератин, или белковоуглеводные комплексы – протеогликаны. Белки непосредственно участвуют в построении мембран и цитоскелета – спектрин , гликофорин.
Ферментативная функция. Подавляюще количество известных ферментов имеют белковую природу
Гормональная (регуляторная) функция. (инсулин и глюкагон, все гормоны гипоталамуса и гипофиза )
Рецепторная функция. Эта функция заключается в избирательном связывании гормонов, биологически активных веществ и медиаторов на поверхности мембран или внутри клеток.
Транспортная функция. Только белки осуществляют перенос веществ в крови ( липопротеины, гемоглобин, гаптоглобин, трансферрин ) Транспорт веществ через мембраны осуществляют белки – транспортеры и транслоказы ( глюкозные транспортеры и белковые каналы, переносящие аминокислоты.)
Резервная функция. (при длительном голодании используются белки мышц, лимфоидных органов,
эпителиальных тканей и печени.)
Сократительная функция. (тубулин, актин, миозин).
Генно-регуляторная функция. (Гистоны, протамины и негистоновые белки )
Антитоксическая функция. (Белки связывают многие токсические вещества)
Энергетическая функция. (Белки, в состоянии голода, могут
служить субстратом для получения энергии, так при окислении 1 г белка
выделяется 17,6 кДж (4,1 ккал) энергии, что эквивалентно такому же
количеству углеводов. Также белки преобразуются в другие топливные
молекулы (глюкозу, кетоновые тела).
Защитная функция. Белки выполняют защитную функцию,
предупреждая инфекционный процесс и сохраняя устойчивость организма. К
таким протеинам относятся иммуноглобулины крови, факторы системы
комплемента (фактор Р или пропердин), при повреждении тканей работают
белки свертывающей системы крови – например, фибриноген, протромбин,
антигемофильный глобулин. Механическую защиту в составе слизистых
оболочек и кожи осуществляют коллаген, муцин и протеогликаны.
6. Ферменты – особенности строения молекул и специфические отличия от небиологических катализаторов. Роль активного и аллостерического центров. Изоферменты и мультиэнзимные комплексы – особенности строения и функционирования.
Ферменты (энзимы) – белки, рибосомы или комплексы РНК-белки, являющиеся биокатализаторами и ускоряющие химические реакции, за счѐт изменения механизма реакции и понижения энергии активации реагентов.
Ферменты характеризуются следующими свойствами, имеющими сходство с химическими катализаторами:
1. не расходуются и не образуются в процессе реакции;
2. катализируют только энергетически возможные реакции;
3. не изменяют свободную энергию субстратов и продуктов реакции;
4. не смещают равновесия реакции, и не ускоряют его наступление.
Между ферментами и химическими катализаторами имеются следующие различия:
1. Ферменты являются белками и поэтому катализируют реакции в «мягких» условиях (давление 1 атм., температура 37 °С и около нейтральное значение рН)16
2. Ферменты обладают физико-химическими свойствами, характерными для белков.
3. Для ферментов характерна более высокая эффективность, чем для неорганических катализаторов. Например, энергия активации разложения пероксида водорода 2Н2О2 → 2Н2О + О2 равна 75,2 кДж/моль. При добавлении неорганического катализатора (Pt) энергия активации снижается до 50,2 кДж/моль. Фермент каталаза снижает энергию активации до 8,3 кДж/моль.
4. Активность фермента регулируется и контролируется на генетическом уровне (на этапе синтеза белка-фермента и его фолдинга) и посредством низкомолекулярных соединений (эффекторов).
5. Ферменты обладают специфичностью, то есть способны катализировать реакции только с определѐнными субстратами или химическими связями.
6. В организме человека, высших животных и растений основная часть метаболических процессов осуществляется полиферментными (мультиэнзимными) комплексами. В результате происходит многоэтапный процесс превращения исходных субстратов с минимальным ростом энтропии и потерей энергии, что увеличивает эффективность их работы.
Под специфичностью ферментов понимают их избирательное взаимодействие с определѐнными субстратами, что отличает их от небиологических катализаторов. Специфичность основана на комплементарности структуры субстрата и активного центра фермента.
Выделяют четыре вида специфичности:
1)Абсолютная специфичность – фермент катализирует превращения только одного субстрата.
Например, уреаза расщепляет только мочевину, глюкокиназа фосфорилирует только D-глюкозу.
2)Относительная специфичность – фермент расщепляет определѐнный тип связи.
Например, липаза гидролизует сложноэфирные связи нейтральных жиров, при этом жирнокислотный состав не влияет на этот процесс (если нейтральный жир в просвете кишечника остаѐтся в жидком эмульгированном состоянии).
3) Относительная групповая специфичность – фермент расщепляет определѐнный тип связи, но в еѐ образовании участвуют определѐнные функциональные группы. Такие ферменты обычно работают в процессе пищеварения.
Например, пищеварительные ферменты, гидролизующие пептидную связь в белках, относятся к протеиназам (относительная специфичность), но среди них пепсин расщепляет пептидную связь, образованную аминогруппой ароматических аминокислот; трипсин – пептидную связь, образованную карбоксильной группой основных аминокислот, а химотрипсин – карбоксильной группой ароматических аминокислот.
4) Стереохимическая специфичность – фермент катализирует превращение только определѐнного стереоизомера.
Пример стереохимической специфичности – гидратация фумарата (фумаровой кислоты) ферментом фумаразой.
+Примером стереохимической специфичности также является работа аспартазы, которая осуществляет отщепление (или присоединение) молекулы аммиака от аспарагиновой до фумаровой кислоты.
Активный центр – участок молекулы фермента, образованный боковыми радикалами аминокислот, осуществляющий связывание субстрата и его каталитическое превращение.
Активный центр представляет собой полость или канал внутри белковой молекулы энзима, структура которого обеспечивает отсутствие или ограничение поступления молекул воды, за счѐт чего и становится возможным осуществление ферментативной реакции. В составе активного центра выделяют участки субстрат-связывающий (якорный) и каталитический, обеспечивающие ферментативное превращение субстрата
Кроме активного центра у ряда ферментов имеется регуляторный или аллостерический центр, который в молекуле фермента, как правило, пространственно отделен от активного центра. К аллостерическому центру присоединяются вещества эффекторы, которые изменяют пространственную структуру энзима, за счѐт чего меняется сродство активного центра к субстрату и скорость ферментативной реакции. Ферменты, имеющие аллостерический центр, называются аллостерическими.
7. Принципы классификации ферментов. Характеристика каждого класса ферментов.
Выделяют 7 классов ферментов, отличающихся особенностями осуществляемых реакций, сродством к различным типам связей и прочими особенностями.
Класс 1 – Оксидоредуктазы – ферменты, катализирующие окислительно-восстановительные реакции с участием двух субстратов (окислителя – акцептора и восстановителя – донора восстановительных эквивалентов (протонов и электронов)). Их систематическое название составляют по форме: «донор: акцептор-оксидоредуктаза». Например, лактатдегидрогеназа имеет следующее систематическое название – лактат: НАД+-оксидоредуктаза. Класс оксидоредуктаз включает 22 подкласса, в качестве важнейших можно выделить следующие подклассы:
- дегидрогеназы и редуктазы – учувствуют в отщеплении или присоединении молекулы водорода. В качестве акцептора восстановительных эквивалентов от органического субстрата выступают коферменты – НАД+, НАДФ+, ФАД или ФМН:
- оксидазы – переносят электроны и протоны на молекулярный кислород или катализируют окисление субстратов молекулярным кислородом в качестве акцептора электронов без его включения в молекулу субстрата;
- пероксидазы – синтезируют пероксид водорода для частичного или полного окисления органических субстратов или разрушают молекулы пероксидов (органических и неорганических);
- оксигеназы: монооксигеназы (гидроксилазы) внедряют в субстрат один атом кислорода (из О2) в форме гидроксигруппы, и диоксигеназы – включают двухатомную молекулу кислорода в окисляемый субстрат.
Класс 2 – Трансферазы – осуществляют межмолекулярный перенос функциональных групп или групп атомов от молекулы донора на молекулу акцептора. Они подразделяются в зависимости от переносимой группы. Название этих ферментов составляют по формуле «донор: акцептортранспортируемая группа-трансфераза».
Коферментами чаще всего являются активные формы витаминов: (В6) пиридоксальфосфат, коэнзим А (В5), тетрагидрофолиевая кислота (Вс), метилкобаламин (В12). Класс подразделяется на 9 подклассов в зависимости от строения переносимых групп; к важнейшим подклассам трансфераз относят:
- аминотрансферазы – осуществляют перенос аминогруппы с αаминокислоты на α-кетокарбоновую кислоту, в результате образуются новые амино- и кетокислоты:
- ацилтрансферазы – ферменты, переносящие ацильный остаток (остаток карбоновой кислоты) на субстрат;
- метил-трансферазы – осуществляют перенос одноуглеродного фрагмента;
- гликозилтрансферазы – переносят остатки активированных моносахаридов; - киназы (фосфотрансферазы) – переносят фосфатные группы от макроэргов (чаще от АТФ) на субстраты;
Класс 3 – Гидролазы – катализируют реакции гидролиза (расщепления ковалентной связи с присоединением молекулы воды по месту разрыва). Подразделяют в зависимости от расщепляемой связи на 13 подклассов. Ввиду сложности многих субстратов у ряда ферментов сохранены тривиальные названия, например, пепсин, трипсин. Коферменты отсутствуют.
Гидролазы широко представлены ферментами желудочно-кишечного тракта (пепсин, трипсин, липаза, амилаза и другие) и лизосомальными ферментами. Осуществляют распад макромолекул, образуя легко адсорбируемые мономеры. Подклассы:
Эстеразы – гидролизуют сложноэфирные связи (к ним принадлежат, например, липазы);
- Фосфатазы – гидролизуют фосфоэфирную связь с отщеплением фосфорной кислоты от субстрата;
- Гликозидазы – гидролизуют О- и N-гликозидные связи; - Протеазы и пептидазы – осуществляют гидролиз пептидных связей у белков и пептидов; - Нуклеазы – катализируют гидролиз связей в нуклеиновых кислотах.
Класс 4 – Лиазы (синтазы) – класс ферментов, который отщепляет группы от субстратов по негидролитическому (без участия воды) и неокислительному механизмам, часто с образованием двойных связей или циклических структур. Также могут осуществлять присоединение низкомолекулярных веществ по двойной связи. Коферментами в ферментах класса являются пиридоксальфосфат, тиаминдифосфат, а в качестве кофакторов выступают ионы магния и кобальта.
Ферменты делятся на подклассы в зависимости от природы атакуемой связи:
- углерод-углерод лиазы – образуют или атакуют связи между атомами углерода
- углерод-кислород лиазы;
- углерод-азот лиазы;
- углерод-сера лиазы; - углерод-галоген лиазы; - фосфор-кислород лиазы; - углерод-фосфор лиазы.
Класс 5 – Изомеразы – катализируют образование структурных, оптических и стереоизомеров за счѐт внутримолекулярного превращения веществ. К их коферментам относятся пиридоксальфосфат, дезоксиаденозилкобаламин, глутатион, фосфаты моносахаридов (глюкозо1,6-дифосфат) и др.
Выделяют подклассы изомераз в зависимости от типа реакции. Например:
- рацемазы – осуществляют обратимое превращение L- и Dстереоизомеров;
- эпимеразы – изменяют конфигурацию при одном из хиральных атомов углерода, например, взаимопревращение α- и β-изомеров;
- внутримолекулярные оксидоредуктазы, например ферменты, катализирующие взаимопревращение альдоз в кетозы;
- внутримолекулярные трансферазы или мутазы – переносят функциональные группы внутри молекулы;
Класс 6 – Лигазы (синтетазы) – катализируют соединение двух молекул, сопряжѐнное с использованием энергии высокоэнергетических связей (например, АТФ). Коферментами этого класса являются нуклеотидные (УТФ) и биотиновые (витамин Н) производные и активные формы фолиевой кислоты.
Выделяют 6 подклассов по виду образуемой связи: углерод-кислород (C–O), углерод-сера (C–S), углерод-азот (C–N), углерод-углерод (C–C), фосфор-кислород (Р–О) и азот-металл (N–Me).
Класс 7 – Транслоказы – отдельный класс ферментов, катализирующих перенос ионов или молекул через мембраны или их разделение в мембранах. Этот класс энзимов сформировался из ранее принадлежащих другим классам ферментов.
Выделяют 6 подклассов транслоказ, разделение основано на типе переносимой через мембрану частицы.
- ферменты, катализирующие транслокацию катионов водорода или протонов (H+);
- ферменты, катализирующие транслокацию неорганических катионов и их хелатов;
- ферменты, катализирующие транслокацию неорганических анионов;
- ферменты, катализирующие транслокацию аминокислот и пептидов;
- ферменты, катализирующие транслокацию углеводов и их производных;
- ферменты, катализирующие транслокацию иных соединений.
К ферментам этого класса не относятся каналы (поры), изменяющие конформацию между открытым и закрытым состоянием, в ответ на какое либо воздействие, а так же транспортеры, которые не зависят от ферменткатализируемых реакций.
8. Специфичность действия ферментов.
Под специфичностью ферментов понимают их избирательное взаимодействие с определѐнными субстратами, что отличает их от небиологических катализаторов. Специфичность основана на комплементарности структуры субстрата и активного центра фермента.
Выделяют четыре вида специфичности: Абсолютная специфичность – фермент катализирует превращения только одного субстрата. Например, уреаза расщепляет только мочевину, глюкокиназа фосфорилирует только D-глюкозу.
Относительная специфичность – фермент расщепляет определѐнный тип связи. Например, липаза гидролизует сложноэфирные связи нейтральных жиров, при этом жирнокислотный состав не влияет на этот процесс (если нейтральный жир в просвете кишечника остаѐтся в жидком эмульгированном состоянии).
Относительная групповая специфичность – фермент расщепляет определѐнный тип связи, но в еѐ образовании участвуют определѐнные функциональные группы. Такие ферменты обычно работают в процессе пищеварения. Например, пищеварительные ферменты, гидролизующие пептидную связь в белках, относятся к протеиназам (относительная специфичность), но среди них пепсин расщепляет пептидную связь, образованную аминогруппой ароматических аминокислот; трипсин – пептидную связь, образованную карбоксильной группой основных аминокислот, а химотрипсин – карбоксильной группой ароматических аминокислот.
Стереохимическая специфичность – фермент катализирует превращение только определѐнного стереоизомера.
Пример стереохимической специфичности – гидратация фумарата (фумаровой кислоты) ферментом фумаразой:
Примером стереохимической специфичности также является работа аспартазы, которая осуществляет отщепление (или присоединение) молекулы аммиака от аспарагиновой до фумаровой кислоты:
9. Значение кофакторов и коферментов. Витамины – как субстраты для образования коферментов, краткая характеристика биохимической роли витаминов В1, В2, В3(РР), В5, Вс, В12, С, Н.
Все ферменты относятся к глобулярным белкам, причем каждый фермент выполняет специфическую функцию, обусловленную присущей ему глобулярной структурой. Однако активность многих ферментов проявляется только в присутствии небелковых соединений – КОФАКТОРОВ
Кофакторы играют очень важную роль в ферментативном катализе.
- Они способствуют либо изменению трѐхмерной структуры белкафермента, что улучшает взаимодействие фермента с субстратом, либо изменению структуры субстрата.
- Коферменты (простетические группы), как правило, выступают в качестве дополнительных субстратов ферментативной реакции. Они могут быть донорами или акцепторами определѐнных химических группировок (например, метильной группы, аминогруппы) и электронов.
Органические кофакторы обычно называют коферментами.
Сложные белки-энзимы состоят из белковой части – апофермента и небелковой части – кофактора или кофермента.
Кофермент (кофактор) с белковой молекулой (апоферментом) формируют молекулу холофермента, обладающую каталитической активностью.
В зависимости от прочности связи апофермента и небелкового фактора в холоферменте различают коферменты и простетические группы.
Коферменты связаны с апоферментом нековалентными связями и потому легко от него диссоциируют. Простетические группы связаны с апоферментом ковалентно.
Коферментами могут быть вещества невитаминной природы, которые синтезируются в клетках, например, аминокислоты, пептиды (глутатион, селеноглутатион), нуклеотиды, гем, порфирины, S-аденозилметионин (SAM), липоевая кислота, коэнзим А (HSKoA), коэнзим Q (убихинол)
• Витамины входят в состав коферментов, то есть являются небелковыми компонентами сложных ферментов (витамины группы В),
• Стимулируют биосинтез физиологически активных белков (вит.А, группы D, К и др.),
• Катализируют окислительно – восстановительные реакции (вит.А, С,Q),
• Участвуют в образовании клеточных гормонов (витамины группы F)
10. Механизм действия ферментов и модели взаимодействия с субстратами.
Любые химические реакции протекают, подчиняясь двум основным законам термодинамики: закону сохранения энергии и закону энтропии. Согласно этим законам, общая энергия химической системы и еѐ окружения остаѐтся постоянной, при этом химическая система стремится к снижению упорядоченности (увеличению энтропии). Для преодоления энергетических барьеров и увеличения скорости химического процесса ферменты изменяют механизм и снижают энергию активации медленных (лимитирующих) стадий.
В ферментативных реакциях выделяют три основных этапа, описывающихся схемой:
, где Е – энзим (фермент), S – субстрат, Р – продукт.
I этап – присоединение молекулы субстрата к активному центру фермента посредством слабых взаимодействий и образование ферментсубстратного комплекса (ES). Изменение энергии активации на этом незначительно (рис. 19). Для этого этапа важно сближение и правильная ориентация фермента и субстрата, что повышает эффективность дальнейших преобразований. Кроме того, встраивание субстрата в активный центр приводит к удалению гидратной оболочки с молекулы субстрата, и создаются совершенно иные условия для проведения реакции в безводной среде. В сумме эти факторы приведят к ускорению реакции в 10*4 раз.
Рис. 19. Изменение свободной энергии катализируемой и не катализируемой ферментом реакции.
II этап – преобразование фермент-субстратного комплекса в один или несколько последовательных (промежуточных) комплексов, с образованием в активном центре конечного продукта реакции (EP). Для этого этапа характерно образование переходных состояний, срок существования которых крайне мал (10–14-10–13 с). При этом важным фактором является стабилизация переходного состояния вследствие взаимодействия между функциональными группами субстрата и аминокислот активного центра энзима. Энергия взаимодействия фермента с субстратом называется энергией связывания, и она обеспечивает не только стабилизацию фермент-субстратного комплекса, но и является основным источником свободной энергии, позволяющей снизить энергию активации реакции (рис. 19)
Механизмы действия ферментов на этом этапе объясняются эффектом деформации субстрата, кислотно-основным и ковалентным катализом. Эффект деформации субстрата объясняет действие гидролаз, лиаз и трансфераз. После связывания с активным центром молекула субстрата изменяет свою геометрию и растягивается относительно структур активного центра. В результате длина связей увеличивается, их прочность, и энергия разрыва уменьшается.
Если в активном центре энзима происходит перенос протонов (Н+) в безводной среде, то структура молекулы субстрата также в значительной мере изменяется (за счѐт перераспределения электронных плотностей и зарядов). Этот ферментативный кислотно-основный катализ более эффективен, чем обмен протонов с кислотами и основаниями в растворе (так как вода выступает конкурентом за катионы водорода). При связывании субстрата с активным центром фермента на него оказывают влияние электрофильные и нуклеофильные группы радикалов аминокислот каталитического участка (а также кофакторы), что вызывает перераспределение электронной плотности на участках субстрата, атакуемого кислотно-основными группами.
Возможен и процесс обратимого переноса функциональных групп от молекул субстрата к аминокислотным остаткам фермента с образованием и разрушением ковалентных связей – ковалентный катализ. Ковалентный катализ подразумевает наличие реакционных групп в активном центре энзима, чаще всего нуклеофильного типа, которые вступают во временные ковалентные связи с субстратом в ходе катализа (таким способом реализуется протеолитическое действие, например, химотрипсина).
Второй этап лимитирует скорость всего катализа. Скорость катализируемого процесса очень чувствительная к величине энергии активации, так уменьшение примерно на 5,7 кДж/моль приводит к увеличению скорости в 10 раз (например, изменение Еа соответствующее образованию всего одной водородной связи, может ускорить реакцию в миллион раз). На этом этапе возможно разделение реакции на 2-3 стадии, каждая из которых требует меньшей энергии активации, чем, если бы процесс осуществлялся в одну стадию (рис. 19). При такой разбивке суммарная величина энергии активации будет такой же, как и при одностадийном процессе, но энергетический барьер будет гораздо меньшим. В результате всех механизмов катализа второго этапа скорость реакции может увеличиться до 10*10 раз.
III этап – отделение продукта реакции от фермента (Е + Р). Стадия непродолжительная и определяется скоростью диффузии продуктов реакции в окружающую среду. Фермент освобождается без изменений.
Суммарное повышение скорости катализируемой реакции может достигать 1014-1016 раз. Взаимодействие субстрата с активным центром фермента объясняют следующие теории:
1. Модель «ключ-замок», предложенная в 1890 г. Э. Фишером, предполагает, что субстрат имеет полное геометрическое соответствие активному центру энзима, то есть эти структуры полностью комплементарны друг другу. Данная модель позволяет описывать взаимодействие субстратов с энзимами, имеющими абсолютную специфичность, однако большинство ферментов имеют групповую специфичность.
2. Модель индуцированного соответствия, предложенная в 1958 г. Д. Кошландом, предполагает, что активный центр фермента изменяет конформацию при присоединении субстрата. Кроме того, происходит и перестройка молекул субстрата, что объясняет групповое действие ферментов.
Рис. 20. Модели взаимодействия активного центра (АЦ) фермента с субстратом.
11. Зависимость скорости ферментативной реакции от концентрации фермента и субстрата. Уравнение Михаэлис-Ментен, его биохимическая характеристика. Значение константы Михаэлис (КМ) для силы взаимодействия фермент-субстратного комплекса.
Зависимость скорости от количества фермента – линейная, то есть чем больше молекул энзима, тем скорость выше. Однако количество фермента часто невозможно определить в абсолютных величинах, поэтому на практике пользуются условными величинами, характеризующими активность фермента. Одна международная единица активности (МЕ)18 соответствует такому количеству фермента, которое катализирует превращение 1 мкмоль субстрата за 1 мин при оптимальных условиях проведения ферментативной реакции: ⁄ Оптимальные условия индивидуальны для каждого фермента и зависят от температуры среды, рН раствора, при отсутствии активаторов и ингибиторов.
В 1973 г. была принята новая единица активности ферментов: 1 катал (кат), соответствующий такому количеству катализатора, которое превращает 1 моль субстрата за 1 с.19
Следует отметить, что в клетке концентрация ферментов всегда на несколько порядков меньше, чем их субстратов, и находится под жестким контролем генома. По этой причине данный фактор изменяется в ограниченных пределах в ходе жизни клеток и организма.
Зависимость скорости ферментативной реакции от концентрации субстрата представлена на рис. 21.
На гиперболической кривой графика выделяют три участка. При низкой концентрации субстрата скорость реакции прямо пропорциональная
Согласно модели Михаэлис–Ментен было предложено уравнение, описывающее взаимосвязь скорости ферментативной реакции в зависимости от концентрации субстрата: , где v – скорость реакции при данной концентрации субстрата, vmax – максимальная скорость реакции, [S] – концентрация субстрата, Km – константа Михаэлиса. В зависимости от концентрации субстрата, можно рассчитать эффективность ферментативной реакции. Одним из важнейших следствий уравнения Михаэлиса–Ментен20 является величина константы Михаэлиса, которая равна половине максимальной скорости реакции ( ) (рис. 21). Для ряда ферментов этот показатель экспериментально определѐн и его значение заключается в оценке сродства субстрата (аффинности) к ферменту. Высокое значение Km свидетельствует о слабом связывании субстрата с активным центром энзима, напротив, низкое значение константы характеризует высокую аффинность (сродство) субстрата к ферменту. Обычно значение Km энзима близко к значению концентрации его субстрата в клетке. Фермент, субстрат которого имеет очень низкую концентрацию в клетке, обычно характеризуется более низким значением Km, чем фермент, субстрат которого имеет более высокую концентрацию. Оптимальной является концентрация субстрата от 0,1 Km до 10 Km, при которой нет утраты контроля со стороны субстрата за скоростью ферментативной реакции.
12. Действие температуры и рН на ферментативную активность.
Зависимость активности ферментов от температуры Повышение температуры до определѐнных пределов оказывает влияние на скорость ферментативной реакции, подобно влиянию температуры на любую химическую реакцию. С повышением температуры ускоряется движение молекул, что приводит к повышению вероятности взаимодействия реагирующих веществ. Кроме того, температура может повышать энергию реагирующих молекул, что также приводит к ускорению реакции. Однако скорость химической реакции, катализируемая ферментами, имеет свой температурный оптимум, который для большинства ферментов человека составляет 37-38 °С. Однако при температурах выше 40-45 °С активность ферментов начинает снижаться, что связано с тепловой инактивацией и денатурацией структуры белков при высоких температурах (рис. 26). Несмотря на то что критической для человека считают 42 °С, ряд ферментов в пробирке могут выдержать и более высокую температуру. Такие ферменты называют термостабильными. Например, щелочная фосфатаза плаценты (но не других органов) выдерживает 60-минутное нагревание при температуре 60 °С без какой-либо потери каталитической активности. Знание такой закономерности позволяет при анализе активности щелочной фосфатазы крови дифференцировать плацентарный фермент от энзимов печени и других органов.
Рис. 26. Зависимость скорости ферментативной реакции от температуры.
Выделенные в чистом виде ферменты наиболее стабильны при низких температурах, поэтому ферментные препараты, используемые в медицине, обычно хранят при температуре 2-8 °С. Влияние рН на активность ферментов Известно, что изменение рН влияет на степень ионизации функциональных групп аминокислотных остатков белка. Именно поэтому изменение рН обычно сопровождается изменением каталитической активности ферментов, хотя известны ферменты, сохраняющие свою активность в широком диапазоне рН.
Рис. 27. Зависимость активности ферментов от значений рН.
В большинстве случаев ферменты наиболее активны в узком диапазоне значений рН, получившем название оптимума рН (рис. 27), отклонение от
которого сопровождается резким снижением их каталитической активности. Чаще всего оптимум рН ферментов организма человека находится в области нейтральных значений, а также в слабощелочной (рН 7,0-8,0) или слабокислой (рН 5,0-6,0) среде. Вместе с тем в организме человека есть ферменты, оптимум рН которых находится в сильнокислой (пепсин) или щелочной (аргиназа и др.) среде. В то время как рН желудочного сока может соответствовать оптимуму рН пепсина, то внутриклеточная среда далеко не всегда обеспечивает оптимум рН для работы ряда ферментов, например аргиназы. Именно поэтому в клетке ферменты могут функционировать в условиях, далѐких от идеальных, а рН среды является важным фактором, влияющим на каталитическую активность ферментов.
13. Регуляция активности ферментов. Понятие об ингибировании и классификация видов ингибирования. Характеристика ингибирования по графическим зависимостям в координатах двойных обратных величин.
14. Аллостерическая регуляция.
15. Ковалентная модификация.
16. Частичный протеолиз.
17. Белок-белковое взаимодействие.
18. Энзимодиагностика, энзимопатии и энзимотерапия. |
|
|
 Скачать 86.45 Kb.
Скачать 86.45 Kb.