Бланк выполнения задания 1
 Скачать 38.17 Kb. Скачать 38.17 Kb.
|
Бланк выполнения задания № 1Цель – ознакомиться с одним из методов определения молярной массы эквивалента металла, основанном на способности металла вытеснять водород из кислоты Ме + nН+ = Меn+ + 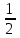 nН2 nН2 1. Результаты эксперимента:
2. Расчеты: 2.1. Приведём объём выделившегося водорода к н. у. (Ро = 760 мм. рт. ст., То = 273 К): 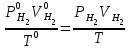 , , 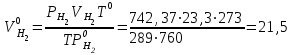 мл мл2.2. Рассчитайте молярную массу эквивалента металла: 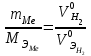 , , 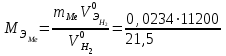 =12,19 г/моль =12,19 г/мольгде 11200 – молярный объём эквивалента водорода (н. у.), мл. 2.3. По молярной массе эквивалента металла методом подбора валентностей определим, какой металл был использован в опыте: 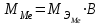 , где В – валентность металла , где В – валентность металла– при В = 1 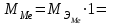 12,19 г/моль 12,19 г/моль– при В = 2 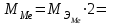 24,38 г/моль 24,38 г/моль– при В = 3 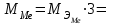 36,57 г/моль 36,57 г/моль– при В = 4 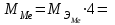 48,76 г/моль 48,76 г/мольИз периодической таблицы выберем металл, имеющий наиболее близкое к одному из расчетных значений значение молярной массы. Это магний, двухвалентный металл с молярной массой 24,31 г/моль. 2.4. Рассчитаем относительную ошибку эксперимента: 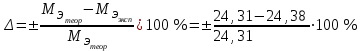 = ±0,29% ≈ ±0,3% = ±0,29% ≈ ±0,3%Вывод к работе. Волюмометрический метод определения молярной массы эквивалента металла, основанный на способности металла вытеснять водород из кислоты, даёт достаточно точные результаты (±0,3%). |

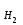 = Р - h
= Р - h