лаба по определению эквивалентной массы металла. Бланк выполнения задания 1. Лабораторная работа 1 Определение молярной массы эквивалента металла
 Скачать 34.49 Kb. Скачать 34.49 Kb.
|
Лабораторная работа № 1 «Определение молярной массы эквивалента металла».Цель – ознакомиться с одним из методов определения молярной массы эквивалента металла, основанном на способности металла вытеснять водород из кислоты Ме + nН+ = Меn+ + 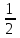 nН2 nН2 Экспериментальная часть Опыт. Определение молярной массы эквивалента металла по объёму вытесненного водорода из раствора кислоты Определение произвели с помощью прибора (рис. 1), состоящего из измерительной бюретки (1) на 25…50 мл, двухколенной пробирки Оствальда (2) и уравнительной склянки или бюретки (3). Бюретки укрепляются в штативе и заполняются водой. В исходном состоянии жидкость в сосудах 1 и 3 должна находиться на одном уровне. 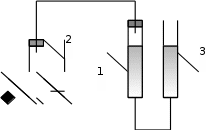 Рис. 1. Схема прибора для определения молярной массы эквивалента металла: 1 – измерительная бюретка, 2 – двухколенная пробирка Оствальда, 3 – уравнительная бюретка. В одно из колен пробирки Оствальда (2) поместили навеску металла, полученную у лаборанта. В другое колено на 1/4 часть его объёма налили раствор соляной кислоты. Плотно закрыли пробирку Оствальда (2) пробкой и закрепили её в штативе. Проверили прибор на герметичность, для чего уравнительный сосуд (3) подняли на 10…15 см и закрепили в этом положении. Прибор герметичен, т.к уровень жидкости в нём остается постоянным. Установили бюретку (1) и сосуд (3) таким образом, чтобы жидкость в них находилась на одном уровне. Отметили положение уровня жидкости (мениска) в бюретке (1) – V1. Осторожно повернули пробирку (2) так, чтобы кислота перелилась в колено, где находится металл. После полного растворения металла привели положение жидкости в бюретке (1) и сосуде (3) к одному уровню. Точно отметили положение мениска жидкости в бюретке (1) – V2. Определили объём выделившегося водорода. Отметили показания термометра и барометра. Давление насыщенного водяного пара выписали из таблицы 3 при температуре опыта, равного 25 оС 1. Результаты эксперимента:
2. Расчеты: 2.1. Привели объём выделившегося водорода к н. у. (Ро = 760 мм. рт. ст., То = 273 К): 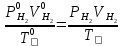 , , 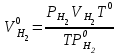 = =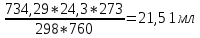 2.2. Рассчитали молярную массу эквивалента металла: 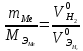 , , 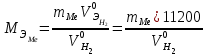 = =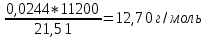 , ,где 11200 – молярный объём эквивалента водорода (н. у.), мл. 2.3. По молярной массе эквивалента металла методом подбора валентностей определили, какой металл был использован в опыте: 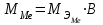 , где В – валентность металла , где В – валентность металла– при В = 1 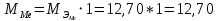 – при В = 2 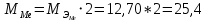 – при В = 3 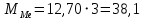 – при В = 4 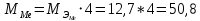 Из периодической таблицы выписали металл, имеющий наиболее близкое к одному из расчетных значений значение молярной массы (для молярной массы с валентностью металла, равной 1 из первой группы нет подходящих вариантов; при валентности, равной 2, – во 2-ой группе близкое значение к экспериментальному значению имеет магний – 24,3; – в 3-ей и 4-ой группе нет подходящих вариантов) 2.4. Рассчитали относительную ошибку эксперимента: 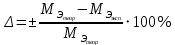 = =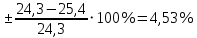 Вывод: ознакомились с одним из методов определения молярной массы эквивалента металла, основанном на способности металла вытеснять водород из кислоты, провели расчеты по полученным экспериментальным данным. Данный металл – магний. Погрешность составила 4,53%, что подтверждает правильность и достоверность, проведенного эксперимента. |

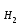 = Р - h
= Р - h