Бланк выполнения задания 4. Бланк выполнения задания 4
 Скачать 29.49 Kb. Скачать 29.49 Kb.
|
Бланк выполнения задания № 4Определить, до какого объема надо разбавить 500 мл 20%-го раствора NаСl (плотность 1,152 г/мл), чтобы получить 4,5%-ный раствор (плотность 1,029 г/мл) m(NaCl) = p *V*c = 1.152* 500 * 0.2 = 115.2 г - масса соли m (4.5% p) = 115.2*100/4.5 = 2560 г масса 4,5% раствора V = m / p = 2560 / 1.029 = 2488 мл Ответ: до объема 2 488 мл Рассчитать рН 0,5 % раствора НСN. Плотность раствора считать равной 1 г/мл HCN↔H+ + CN- С = 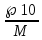 M (HCN) = 27 г/моль СHCN= 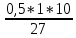 = 0, 1852 моль/л = 0, 1852 моль/лα = 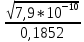 = 6 * 10-5 = 6 * 10-5Н+ = c *α – концентрация ионов водорода Н+ = 0,1852 * 6 * 10-5= 1 * 10-5= 0,00001 моль/л pH= - lg H+ pH= - lg 0,00001 = - (-5) = 5 Ответ pH = 5 (слабокислая среда) Составить уравнение окислительно-восстановительной реакции с использованием метода электронного баланса; рассчитать массу восстановителя, необходимую для взаимодействия с окислителем, объемом V и концентрацией С.
Na2SO3 + KMnO4 + H2O = Na2SO4 + MnO2 + KOH В ионном виде уравнение принимает вид: SO32- + MnO4— + H2O = MnO2 + SO42- + OH— Окислителем является MnO4—, а восстановителем SO32-. В нейтральной и слабощелочной среде MnO4— принимает 3 электрона и восстанавливается до MnО2. SO32-— окисляется до SO42-, отдав 2 электрона. Полуреакции имеют следующий вид: MnO4— + 2H2O + 3e— = MnО2 + 4OH— |2 окислитель, процесс восстановления Mn(7+)+3e=Mn(4+) SO32- + 2OH—— 2e— = SO42- + H2O |3 восстановитель, процесс окисления| S(4+)-2e=S(6+) 2Mn (7+) +3S (4+) =2Mn (4+) +3S (6+) 2KMnO4+3Na2SO3+H2O=2MnO2+3Na2SO4+2KOH m(Na2SO3) =0,5*275*(2*23+32+3*16) *3/2=26,0 г Ответ: Масса окислителя = 26 г Вычислить концентрацию ионов никеля в растворе, при которой ЭДС гальванического элемента, составленного из никелевого и стандартного кадмиевого электродов, равна нулю Ек-Еа=0 по условию E=E°+(0,059/z) *lg [Mez+] - ур. Нернста при 298К ECd2+/ Cd=-0,403 В – анод E°Ni2+/Ni = -0.250 В – катод -0,250+(0,059/2) *lg[Ni2+] -(-0,403)=0 [Ni2+] =6,51*10^-6 моль/л Ответ: 6,51*10^-6 моль/л Рассчитать нормальность раствора АgNО3, если для выделения всего серебра из 80 мл этого раствора потребовалось пропустить ток силой 0,8 А в течение 20 минут. Написать уравнения электродных процессов Закон Фарадея m=Q*Э/F, где m- масса выделившегося в-ва, Q- количество электричества, Э - эквивалент, F- число Фарадея. m/Э=Q/F, m/Э - количество эквивалентов. Нормальность раствора будет равна m/(Э*V)=0,8*20*60/(96485*0,08)=0,124 Ответ: 0,8*20*60/(96485*0,08)=0,124 Для защиты стальных изделий от коррозии используют, в частности, покрытия другими металлами, например, никелирование, цинкование, меднение. Объяснить, в каком из указанных случаев нарушение целостности покрытия в большей степени влияет на разрушение стали. Ответ обосновать. Написать уравнения коррозионных процессов в атмосферных условиях Атмосферная коррозия обусловлена воздействием атмосферного кислорода и воды (в виде паров или плёнки). Один из способов защиты железа от атмосферной коррозии – покрытие его слоем менее активного металла. Для предупреждения коррозии и защиты от неё используются разнообразные методы: электрохимическая защита, применение химически стойких сплавов, обработка коррозионной среды, металлические и неметаллические покрытия, обработка поверхности металла. Материалами для металлических защитных покрытий могут быть как чистые металлы (Zn, Cd, Al, Ni, Cu, Cr, Ag и др.), так и их сплавы (бронза, латунь и др.). По характеру поведения металлических покрытий при коррозии их подразделяют на катодные и анодные. Катодными называются покрытия, в которых металл покрытия менее активен, т.е. имеет более положительное значение стандартного электродного потенциала, чем защищаемый металл. Катодные покрытия на стали образуют медь, никель, олово и др. В случае механического повреждения такого покрытия возникает гальваническая пара, в которой анодом является железо, а катодом - металл покрытия. Анодные покрытия из металла - стандартный электродный потенциал которого меньше, чем электродный потенциал защищаемого металла, это Цинк. Меднение. На воздухе во влажной атмосфере медь легко окисляется, покрываясь слоем оксидов и основных солей, поэтому в качестве самостоятельного покрытия без дополнительной обработки не применяется ни для защиты стальных деталей от коррозии, ни для декоративных целей. По электрохимическим свойствам медь по отношению к железу является катодным покрытием и поэтому не может защитить железо от коррозии. Вследствие этого наиболее широкое распространение электролитические осадки меди получили в качестве подслоя, наносимого перед никелированием и хромированием стали и цинковых сплавов. Как самостоятельное покрытие медь применяется при углеродистой цементации и в гальванопластике для получения металлических копий. В настоящее время электроосаждение меди стали широко применять для получения функциональных покрытий в радиоэлектронной промышленности при производстве печатных плат. Никелирование. Покрытие никелем используют для защиты от коррозии и для декоративной отделки деталей автомобилей, велосипедов, различных приборов, хирургических инструментов, предметов домашнего обихода и т.д. Никель, легко пассивируясь на воздухе, покрывается тонкой пленкой, почти не изменяющей блеска и предохраняющей его от воздействия окружающей среды. Поэтому никель отличается высокой коррозионной стойкостью на воздухе, в растворах щелочей и некоторых кислот благодаря сильно выраженной способности к пассивированию. Никелированные детали лучше противостоят истиранию, чем покрытые медью, так как электролитический никель в 2−3 раза тверже меди и латуни. Никелевое покрытие проявляет катодный характер защиты относительно железа и его сплавов, так как его потенциал положительнее, чем у железа, т.е. оказывает только механическую защиту. В тонких слоях (1−3 мкм) никелевые покрытия пористы. Невидимые глазу поры становятся очагами коррозионных поражений, если коррозионный агент проникает к основному металлу. Пористость почти полностью устраняется лишь при толщине 22−30 мкм. Наиболее эффективными являются многослойные (2−3 слоя) никелевые покрытия, защитная способность которых намного выше однослойных благодаря электрохимической защите внутри никелевых слоев и механической защите, обусловленной различной структурой слоев никеля. Распространены двух- и трехслойные покрытия матовым и блестящим никелем, в которых сочетаются первый слой, не содержащий серы, и последующие слои с включением различного количества серы, которые получают из электролитов с серосодержащими выравнивающими органическими добавками. Так как потенциал никеля, содержащего серу, имеет более отрицательное значение, чем потенциал никеля без включения серы, второй слой электрохимически (анодно) защищает от коррозии первый слой никеля, и таким образом обеспечивается более высокая защитная способность покрытия в целом. Хромирование. Хром является активным металлом и, хотя относится к электроотрицательным металлам, на воздухе и в окислительных средах он может сильно пассивироваться. Его потенциал при этом становиться + 1,19 В, благодаря чему хром приобретает свойства благородных металлов: коррозионную стойкость, устойчивость в органических кислотах, в растворах щелочей, азотной кислоте, в среде серы и ее соединений. Пассивная пленка оксида предохраняет хромовое покрытие от потускнения – на воздухе хром сохраняет блеск. Хромовые покрытия растворяются в горячей серной и хлороводородной кислотах (при комнатной температуре). Но при химической стойкости хромовые покрытия отличаются пористостью и не защищают надежно железо от коррозии, так как в гальванической паре железо – хром последний является катодом. Хромовые покрытия бывают защитно-декоративные и специальные. Защитно-декоративные блестящие хромовые покрытия толщиной до 1 мкм наносят на подслой меди или никеля. Для этих целей непосредственно на сталь хром не осаждают ввиду того, что в оголенных местах, порах и трещинах сталь будет разрушаться, так как она является анодом по отношению к хрому. Защитно-декоративное хромирование широко применяется для покрытия частей автомобилей, мотоциклов, велосипедов, вагонов, при изготовлении различных приборов и т.д. Высокая твердость, низкий коэффициент трения, жаростойкость и высокая коррозионная стойкость обеспечивают деталям, покрытым хромом, высокую износоустойчивость. Специальные хромовые покрытия толщиной 0,005–1 мм предназначены для улучшения механических свойств поверхности стали. При меднении нарушение целостности покрытия в большей степени влияет на разрушение стали. Уравнение коррозионных процессов в атмосферных условиях. Анод: ионы металла переходят в раствор: Мe→ Мen+ + ne Катод: проходит реакция восстановления: O2 + 2H2O + 4e → 4OH- (щелочные, нейтральные среды) O2 + 4H+ + 4e → 2H2O (подкисленная среда) Во многом стойкость металлов и сплавов, в условиях атмосферной коррозии, зависит от природы металла и состояния его поверхности. Атмосферная коррозия стали А(-) Fe0-2e- → Fe2+ K (+) O2+2H2O+4e- →4OH- |
