лекция 8 чего-то там. лекция 8. Цель лекции
 Скачать 1.44 Mb. Скачать 1.44 Mb.
|
|
ЛЕКЦИЯ 8. Биохимия системы гемостаза Цель лекцииОзнакомить с системами гемостаза (Сосудисто-тромбоцитарный и Коагуляционный гемостаз). Разобрать функции плазменных факторов и тромбоцитарных факторов свертывающей системы крови. Объяснить механизмы действия антикоагуляционной и фибринолитической систем. План лекции1. Компоненты системы гемостаза. 2. Сосудисто-тромбоцитарный гемостаз (первичный). 3. Коагуляционный гемостаз (вторичный, или плазменный) 4. Плазменные факторы свертывающей системы крови 5. Роль витамина К в свертывании крови 6. Этапы внутреннего и внешнего путей свертывания крови 7. Антикоагулянтная система крови 8. Система фибринолиза 9. Калликреин-кининовая система крови 1.Компоненты системы гемостазаГемостаз – это все процессы, направленные на сохранение жидкого состояния циркулирующей крови, препятствующая кровоточивости, а также процессы, обуславливающие восстановление кровотока в случае обтурации сосуда тромбом. Система гемостаза включает следующие компоненты: · стенку кровеностного сосуда; · форменные элементы крови; · биохимические системы: свертывающую (прокоагулянтную), противосвертывающую (антикоагулянтную), фибринолитическую и калликреин-кининовую. К основным фунциям системы гемостаза относятся: сохранение жидкого состояния циркулирующей крови, предупреждение кровопотерь и остановка кровотечений, лизис кровяных сгустков и восстановление исходного диаметра кровеносных сосудов. Неповрежденный эндотелий сосудов характеризуется тромборезистентностью. В ее реализации существенную роль играет простациклин (простагландин I), который синтезируется в эндотелиальных клетках сосудов. Простациклин является мощным ингибитором агрегации тромбоцитов. После повреждения сосудистой стенки запускается процесс гемокоагуляции, или свертывания крови. В зависимости от диаметра поврежденного сосуда различают два механизма гемостаза: сосудисто-тромбоцитарный (первичный) и коагуляционный (вторичный, или плазменный). 2. Сосудисто-тромбоцитарный гемостаз (первичный)Благодаря сосудисто-тромбоцитарному гемостазу происходит остановка кровотечения в сосудах мелкого калибра, или капиллярах, в которых низкое кровяное давление. Остановка кровотечения начинается с рефлекторного спазма просвета сосуда. Далее к месту повреждения мигрируют тромбоциты, происходит их адгезия и агреция. Тромбоциты выделяют биологически активные вещества, способствующие кратковременному поддержанию спазма сосуда и дальнейшей адгезии и агрегации тромбоцитов. В результате образуется тромбоцитарный, или белый, тромб, которого достаточно для остановки кровотечения в капиллярах. В кровотоке постоянно содержится от 20 до 40% активированных тромбоцитов, готовых при появлении молекул адгезии моментально начать процесс свертывания крови. В процессе тромбоцитарно-сосудистого взаимодействия различают стадии адгезии, активации и агрегации тромбоцитов. Адгезия тромбоцитов — это приклеивание тромбоцитов к месту повреждения сосуда. Она достигается благодаря реакции коллагеновых нитей с отрицательно заряженными тромбоцитами. Коллаген базальных мембран эндотелиальных клеток обнажается после поврежедния сосудистой стенки. После прикрепления к поврежденной поверхности сосуда тромбоциты активируются, что характеризуется образованием псевдоподий, с помощью которых они фиксируются к стенкам сосуда. Одновременно из активированного эндотелия высвобождаются белки адгезии, в первую очередь фактор фон Виллебранда (ффВ или WF). Кроме того, в адгезии тромбоцитов принимают участие ионы кальция (Са2+), АДФ и тромбоцитарные факторы: тромбоксан А2 (ТХ А2), фактор активации тромбоцитов (англ.: platelet-activating factor, PAF), фактор роста тромбоцитов (англ.: рlatelet-derived growth factor, PDGF). Помимо факторов адгезии, активированные тромбоциты выделяют серотонин и катехоламины, вызывающие спазм сосудов и способствующие остановке кровотечения. Этот этап гемостаза является достаточным для остановки кровотечения в капиллярах (рис.). Образование белого тромба занимает от 3 до 5 минут. 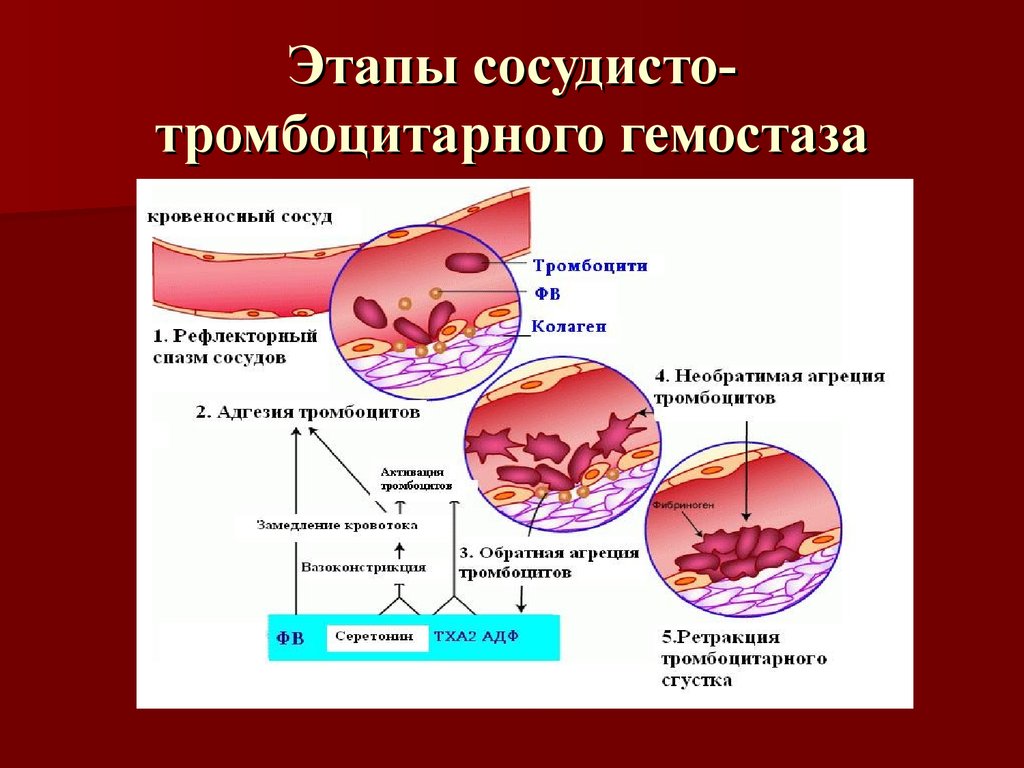 Этапы сосудисто-тромбоцитарного гемостаза 3. Коагуляционный гемостаз (вторичный, или плазменный)В основе коагуляционного гемостаза лежит биохимический процесс, в котором происходит постепенное превращение растворимого белка плазмы крови фибриногена в нерастворимый фибрин. Основные этапы гемостаза 1. Локальная вазоконстрикция - ограничивает первоначальную кровопотерю и способствует миграции тромбоцитов к месту повреждения сосуда. 2. Адгезия и агрегация тромбоцитов - завершается образованием белого, или тромбоцитарного, тромба. 3. Активация свертывающей системы крови – завершается образованием фибрина. 4. Лизис фибрина, восстановление прежнего диаметра сосуда и кровотока с помощью системы фибринолиза (рис. 2). 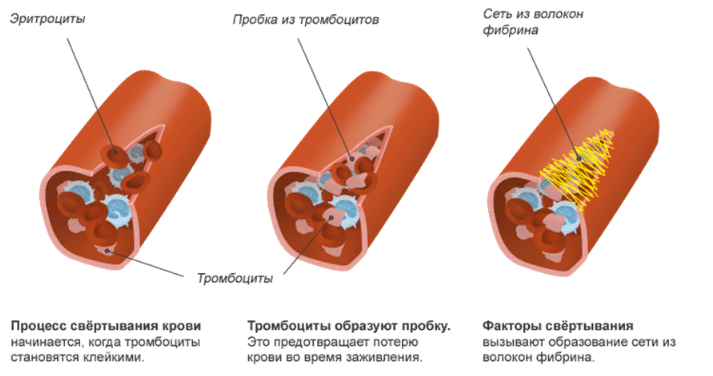 Рис. 2 Последовательность образования сети из волокон фибрина 4.Плазменные факторы свертывающей системы кровиСистема свертывания крови включает ферменты, белковые кофакторы, а также ингибиторы свертывания крови. Благодаря системе гемокоагуляции образуется фермент тромбин, катализирующий превращение фибриногена в фибрин. Практически все белки плазмы крови, участвующие в свертывании крови, синтезируются в печени в виде неактивных предшественников и обозначаются римскими цифрами. Белковые факторы, образующиеся в клетках крови, обозначаются арабскими цифрами. Активные формы этих белков обозначаются теми же цифрами, но с добавлением буквы «а». Активация факторов гемокоагуляции осуществляется путем частичного протеолиза. В процессе свертывания крови белковые факторы работают в составе комплексов, которые включают фермент, его кофактор, катионы кальция, а также фосфолипиды клеточных мембран. Факторы свертывания крови классифицируются на следующие группы: 1. Ферменты: а) являющиеся сериновыми протеазами: · фактор II – протромбин; · фактор VII – проконвертин; · фактор IX – антигемофильный глобулин В, или фактор Кристмаса; · фактор X – фактор Стюарта-Прауэра; · фактор XI – антигемофильный глобулин С, или фактор Розенталя; б) не являющиеся сериновыми пртеазами · фактор XIII – фибринстабилизирующий фактор (трансглутаминаза, фибринолигаза, фактор Лаки-Лоранда. 2. Белки-кофакторы, необходимые для связывания и закрепления факторов-ферментов на мембранах тромбоцитов и поврежденных эндотелиальных клеток: · фактор V – проакцелерин, является кофактором для фактора Xа; · фактор VII – проконвертин, является кофактором для фактора III; · фактор VIII – антигемофильный глобулин А, является кофактором для фактора IХа; · высокомолекулярный кининоген (ВМК, фактор Фитцжеральда-Флюже) – кофактор для фактора XII и рецептор прекалликреина. Необходимо иметь в виду, эти белки относятся также и к системе фибринолиза. 3. Субстрат реакции тромбообразования – фактор I (фибриноген). Функции плазменных факторов гемокоагуляции Фактор I (фибриноген) – это фибриллярный белок, превращающийся в фибрин (ф.Iа) под действием тромбина. Он образует сетчатую основу тромба, закупоривающего поврежденный сосуд. Фактор II (протромбин)– это кальцийзависимый предшественник активного протеолитическоо фермента тромбина (ф.IIа). Для его посттрансляционной модификации необходим витамин К. Превращение протромбина в тромбин проходит под действием тромбопластина (ф.3 тромбоцитов) и Са2+, а также при участии факторов Vа и Xа. Катионы кальция, а также факторы Vа и Xа составляют комплекс «протромбиназа» (рис. 3). Во время реакции активации тромбина образуется ряд производных протромбинаи различных типов тромбина (тромбин C, тромбин E), которые обладают прокоагулянтной, антикоагулянтной и фибринолитической активностью. Основным продуктом реакции является тромбин C, который катализирует образование фибриногена. 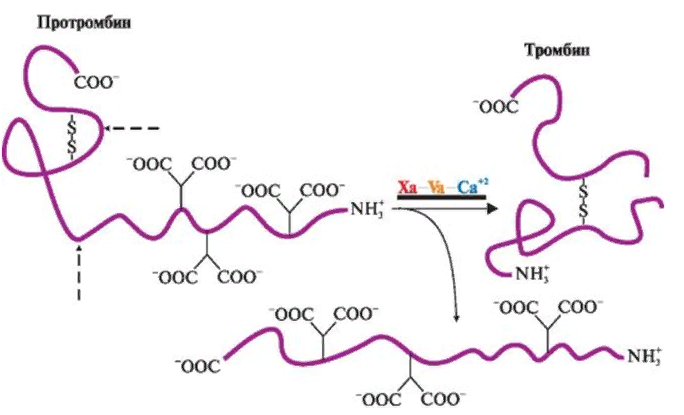 Рис. 3 Механизм активации тромбина Активный тромбин по механизму положительной обратной связи используется для образования Va, VIIa, VIIIa и XIa из своих предшественников. Фактор III (тканевой тромбопластин, тканевой фактор) – это единственный фактор гемокоагуляции, не контактирующий с кровью. Он появляется в ней только повреждения тканей и представляет собой фосфолипопротеины клеточных мембран. Вместе с факторами VIIа и Са2+ тканевой фактор входит в состав комплекса, который называется комплексом тканевого фактора, или инициирующим комплексом, или внешней тенназой. Под действием этого комплекса активируется фактор X, который в дальнейшем участвует во внешнем пути формирования протромбиназы – комплекса факторов, катализирующих превращение протромбина в тромбин. Фактор IV (ионы кальция, Са2+) – это единственный плазменный фактор системы гемостаза, не являющийся белком. Благодаря ему обеспечивается сближение и оптимальная ориентация ферментов свертывания крови на кислых фосфолипидах поверхности тромбоцитов. В процессе гемокоагуляции этот фактор не расходуется. Катионы кальция связывают антикоагулянт гепарин, что приводит к ускорению свертывания крови. При отсутствии Са2+ нарушаются агрегация тромбоцитов и ретракция кровяного сгустка. Фактор V (проакцелерин, плазменный AC-глобулин (англ. accelerator globulin), или лабильный фактор) – это предшественник акцелерина (фактора Va или фактора VI). Является кофактором для фактора Ха. Вместе с катионами кальция и фактором Ха входит в состав комплекса «протромбиназы», необходимого для активации протромбина. Фактор VI (акцелерин, или плазменный AC-глобулин, активная форма фактора V). Исключен из номенклатуры факторов свертывания, признается лишь неактивная форма фермента – фактор V. Фактор VII (проконвертин) – это предшественник протеолитического фермента конвертина (фактора VIIа), активирующегося в присутствии Са2+ , а также факторов Ха и IIa. Для его посттрансляционной модификации необходим витамин К. Фактор VIII (антигемофильный глобулин А) – это предшественник VIIIa. Циркулирует в крови в комплексе с фактором фон Виллебранда, который защищает его от разрушения. Активируется под действием IIa. Фактор VIIIa является кофактором для фактора IХa. Вместе с катионами кальция и фактором IXa входит в состав комплекса тенназы, или внутренней тенназы, который необходим для активации фактора Х. Фактор IХ (фактор Кристмаса, антигемофильный глобулин В) – это предшественник протеолитического фермента - фактора IХа. Для его посттрансляционной модификации необходим витамин К. Фактор Х (фактор Стюарта - Прауэра)- это предшественник активного фактора Ха. Активируется под воздействием комплекса тканевого фактора и тенназы. Входит в состав протромбиназы вместе с катионами кальция и своим кофактором – фактором Va. Необходим для превращения протромбина в тромбин (рис. 4). Для его посттрансляционной модификации используется витамин К. 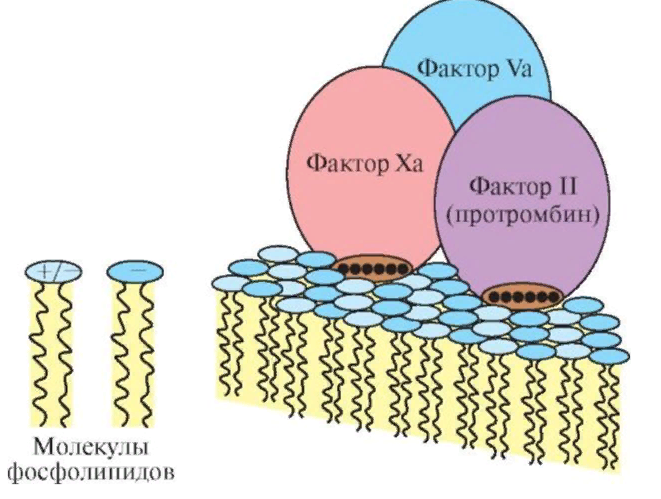 Рис. 4 Активация протромбина Фактор ХI (фактор Розенталя, антигемофильный глобулин С) – это предшественник протеолитического фермента фактора ХIа, который образуется при участии факторов XIIа, IIа, Флетчера и Фитцджеральда. Активирует образование фактора IХа. Фактор ХII (фактор Хагемана, контактный фактор) – это предшественник фактора ХIIа. Для образования ХIIа необходимы контакт с коллагеном, а также калликреин, плазмин и катехоламины. Контактный фактор участвует в образовании активной формы фактора Розенталя. Фактор ХIII (фибринстабилизирующий фактор, фибринолигаза, трансглутаминаза, фактор Лаки-Лоранда) – это предшественник активного фермента трансглутаминазы (фактора ХШа), катализирующего реакцию образования ковалентных связей как между молекулами фибрина, так и между фибрином и фибронектином – белком межклеточного матрикса соединительной ткани. Благодаря фибринстабилизирующему фактору образуется плотный сгусток, который фиксируется в месте повреждения сосуда и препятствует кровотечению. Кроме того, данный фактор стимулирует адгезию и агрегацию тромбоцитов. Фактор фон Виллебранда (VIII:FW или VIII:ф.В) – это антигеморрагический сосудистый фактор, который синтезируется в эндотелиальных клетках кровеносных сосудов и содержится в плазме крови и тромбоцитах. Стимулирует адгезию и агрегацию тромбоцитов, а также стабилизирует фактор VIII. Фактор Флетчера (прекалликреин) – это компонент калликреин-кининовой системы. Прекалликреин является предшественником протеолитического фермента калликреина, катализирующего образование кининов из кининогена, а также необходимого для активации XII фактора гемокоагуляции и плазминогена – компонента фибринолитической системы. Фактор Фитцджеральда (фактор Вильямса, фактор Флоджека) – это высокомолекулярный кининоген. Образующийся из него кинин участвует в активации фактора XII и плазминогена. 5. Роль витамина К в свертывании кровиВитамин К – это единственный жирорастворимый витамин, выполняющий коферментную функцию. Он является коферментом γ-глутамилкарбоксилазы. Под действием этого фермента происходит посттрансляционная модификация, а именно γ-карбоксилирование остатков глутаминовой кислоты II, VII, IX, X факторов свертывания крови, а также протеинов С и S, участвующих в работе антикоагулянтной системы. Благодаря этой модификации образуется γ-карбоксиглутаминовая кислота, что позволяет белкам посредством ионов Са2+ связываться с фосфолипидами клеточных мембран. Поступивший в печень витамин К (нафтохинон) восстанавливается НАДФH-зависимой витамин К-редуктазой с образованием дигидронафтохинона (рис. 5). Затем в ходе ферментативной реакции дигидрохинон окисляется, и образуется неактивный 2,3-эпоксид витамина К. Регенерация эпоксида в дигидрохинон осуществляется редуктазами, коферментом которых является белок тиоредоксин. 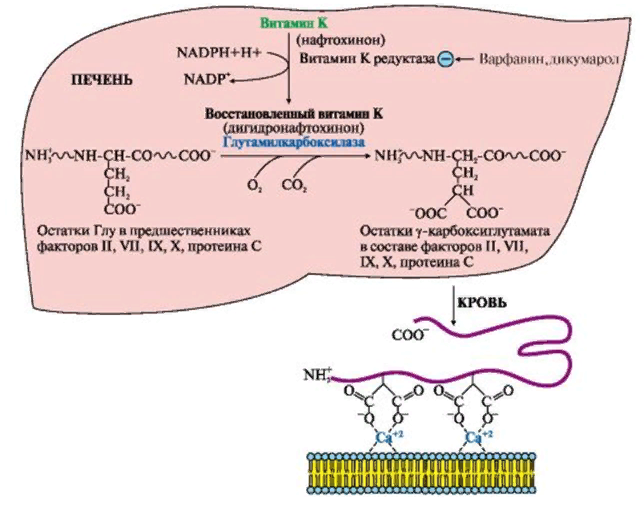 Рис. 5 Карбоксилирование остатков глутаминовой кислоты Лекарственные препараты группы кумаринов, например, дикумарол и варфарин, будучи структурными аналогами витамина К, являются конкурентными ингибиторами NADФH-зависимой витамин K-редуктазы. Они снижают скорость восстановления витамина К и, следовательно, активность γ-глутамилкарбоксилазы. Варфарин, дикумарол и их аналоги являются непрямыми антикоагулянтами и используются для лечения и предотвращения тромбозов. Синтезирован водорастворимый аналог витамина К – викасол. 6. Этапы внутреннего и внешнего путей свертывания кровиСвертывание крови, или гемокоагуляция, начинается с серии каскадных реакций частичного протеолиза, в результате которых образуется комплекс «протромбиназа» (Va + Xa + Ca2+). Различают внешний и внутренний пути образования протромбиназы и, соответственно, внешний и внутренний пути свертывания крови. Реализация внешнего пути происходит в результате повреждения тканей, что способствует выходу тканевого (III) фактора в плазму крови и последующему запуску каскада реакций образования протромбиназы. Причиной запуска внутреннего пути свертывания крови является контакт крови с аномальной, или поврежденной, внутренней поверхностью сосудистой стенки. Такие повреждения могут возникать в результате воспалительных, аутоиммунных процессов, а также нарушений гемодинамики. После образования протромбиназы дальнейшие реакции будут одинаковыми для обоих путей гемокоагуляции: под действием протромбиназы плазменный белок протромбин (фактор II) превращается в активный протеолитический фермент тромбин, который катализирует превращение фибриногена в фибрин. Внешний путь активации После повреждения тканей и выхода в кровь тканевого фактора происходит активация фактора VII и образование инициирующего комплекса, или комплекса тканевого фактора (III + VIIa + Ca2+), который активирует фактор X (рис. 6). 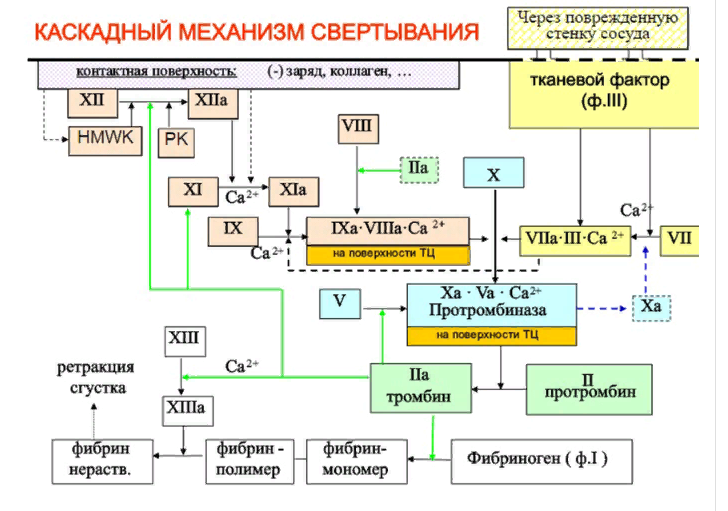 Рис. 6 Схема свертывания крови В дальнейшем факторы Xa ,Va и Ca2+ образуют комплекс «протромбиназу», который катализирует образование тромбина из протромбина путем частичного протеолиза. Внутренний путь активации Процесс запускается активацией фактора XII (контактного фактора) коллагеном субэндотелиального слоя внутренней поверхности сосудистой стенки. На данном этапе также задействованы высокомолекулярный кининоген и калликреин (см. рис. 15.6). Далее активируется фактор XI, а под действием XIа – фактор IX. Фактор IXa образует вместе с фактором VIIIа и Ca2+ комплекс «тенназу», который активирует фактор X. В результате, как и в случае внешнего пути свертывания крови, образуется комплекс «протромбиназа», необходимый для образования тромбина. Тромбин запускает образование фибрина. Полимеризация фибрина Фибриноген – это высокомолекулярный гликопротеин, который состоит из трех пар полипептидных цепей – альфа- (αα-), бета- (ββ-) и гамма- (γγ-), связанных между собой дисульфидными связями. В альфа- и бета-цепях существуют одноименно заряженные фрагменты, которые называются фибринопептидами А и В. Они закрывают комплементарные участки в фибриногене и не позволяют ему полимеризоваться. После появления большого количества тромбина начинается превращение фибриногена в фибрин. При этом тромбин катализирует отщепление фибринопептидов А и В в α- и β цепях фибриногена, в результате чего образуется растворимый фибрин-мономер. Далее начинается спонтанная агрегация мономеров фибрина с образованием олигомеров и еще непрочной фибриновой сети (фибрин-полимер). 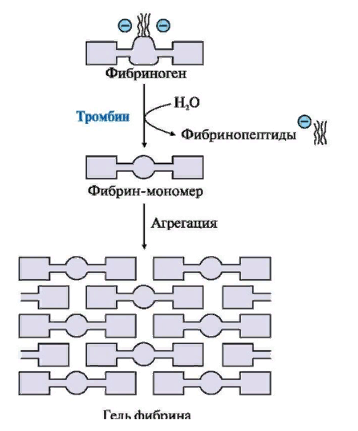 Впоследствии фактор XIIIa, который активируется тромбином, катализирует образование амидных связей между остатками лизина одной молекулы фибрин-полимера и остатками глутамина другой молекулы. Ковалентно сшитые между собой нити фибрина образуют прочную трехмерную сеть, в которую попадают тромбоциты, эритроциты и лейкоциты. Помимо образования ковалентных связей между нитями фибрина, под действием трансглутаминазы фибрин присоединяется к фибронектину, прочно связанному с другими молекулами внеклеточного матрикса. В результате тромб оказывается прикрепленным к межклеточному матриксу в области поврежденной стенки сосуда. 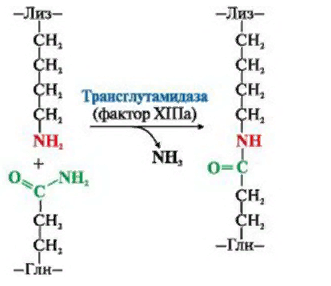 После образования тромба происходит его максимальное уплотнение, или ретракция. Для ретракции необходим тромбоцитарный фактор 6, или тромбостенин, обладающий АТФ-азной активностью. Он является аналогом актомиозина скелетных мышц. Тромбостенин также участвует в активации и агрегации тромбоцитов. Образование красного тромба занимает от 10 до 30 минут, а ретракция кровяного сгустка - от 2-х до 3-х часов и предупреждает полную закупорку сосудов образовавшимся тромбом. 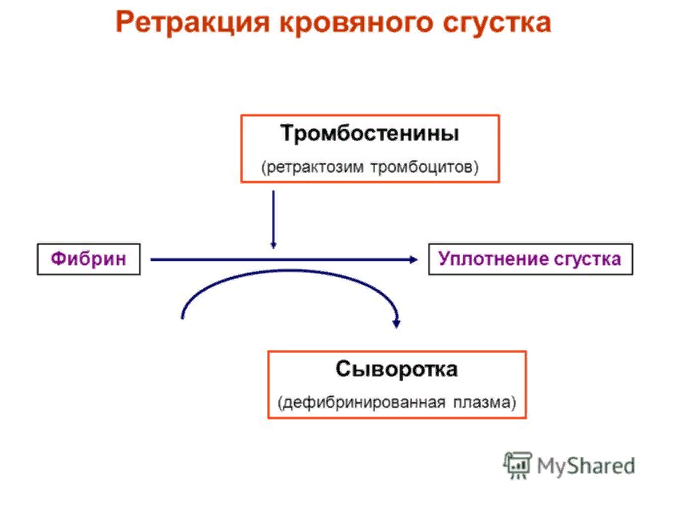 7. Антикоагулянтная система кровиПротивосвертывающая, или антикоагулянтная, система крови ограничивает распространение тромба и сохраняет кровь в жидком состоянии. К ней относятся ингибиторы ферментов свертывания крови и антикоагулянтная система протеинов С и S (антикоагулянтный путь). В зоне повреждения сосудистой стенки тромбоцитарный конгломерат постоянно увеличивается за счет дегрануляции тромбоцитов и выброса новых порций стимуляторов из клеток, участвующих в гемокоагуляции. Однако тромбообразование не распространяется вдоль сосудистой стенки благодаря системе протеинов С и S. Кроме того, в ответ на высвобождение АДФ из агрегирующих тромбоцитов в неповрежденном эндотелии образуется простагландин PG I2 (простациклин), который препятствует дальнейшей агрегации тромбоцитов и ингибирует свертывание крови за пределами поврежденного участка сосуда. Рассмотрим некоторые прямые, или естественные, антикоагулянты. Тромбомодулин – это интегральный белок мембран эндотелиальных клеток, который является рецептором для тромбина на неповрежденном эндотелии. Вместе с тромбином стимулирует активацию протеина С. Протеины С и S – это белки, входящие в антикоагулянтную систему протеинов С и S. Протеины С и S синтезируются в печени, для их посттрансляционных модификаций необходим витамин К. Взаимодействие тромбина с белком-активатором тромбомодулином (Тм) в присутствии ионов Са2+ приводит к образованию комплекса, который включает, помимо кальция и тромбомодулина, и активный тромбин :«IIа-Тм-Са2+» Данный комплекс активирует протеин С путем частичного протеолиза. Активированный протеин С (Сакт.) вместе с белком-кофактором S и Са2+ образует комплекс «протеин Сакт.-S-Са2+», катализирующий гидролиз плазменных факторов гемокоагуляции Va и VIIIa (Рис. 14.13). Разрушение Va и VIIIa факторов приводит к торможению каскада реакций свертывания крови и препятствует образованию тромба. 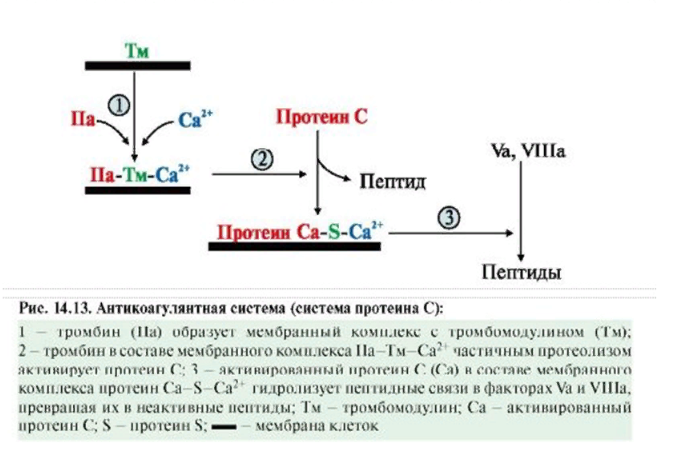 Антитромбин III – это наиболее сильный ингибитор свертывания крови. Он инактивирует ряд сериновых протеаз крови, таких как тромбин, факторы IХа, Ха, ХIа, ХIIа, калликреин, плазмин и урокиназу. Является гепарин-зависимым белком. Гепарин – это гетерополисахарид, который синтезируется в тучных клетках. Меняет конформацию антитромбина III, повышая его сродство к сериновым протеазам крови (рис. 15.12). Присоединение протеазы к комплексу «гепарин-антитромбин III» снижает сродство гепарина к антитромбину III. Гетерополисахарид высвобождается из комплекса и может активировать другие молекулы антитромбина III. α2-Макроглобулин – это белок, который взаимодействует с активными сериновыми протеазами и подавляет их протеолитическую активность. α1-Антитрипсин – это белок, который ингибирует тромбин, фактор XIa, калликреин, а также панкреатические и лейкоцитарные протеазы, ренин и урокиназу. 8. Система фибринолизаВ процессе образования гемостатической пробки активируются механизмы, направленные на ограничение роста тромба, его растворение и восстановление тока крови. Все это выполняет система фибринолиза. Фибринолизом называется процесс лизиса тромба или сгустка фибрина. Система фибринолиза состоит из ферментов, активаторов и ингибиторов фибринолиза. Непосредственно в разрушении фибрина путем протеолиза участвует фермент плазмин, или фибринолизин. Он образуется из своего предшественника плазминогена путем частичного протеолиза под действием активаторов фибринолиза. Под действием плазмина фибрин распадается на пептидные фрагменты.  Внутренними, или эндогенными, активаторами фибринолиза являются факторы XIIIa, ХIIа, прекалликреин, калликреин и высокомолекулярный кининоген. Следует помнить, что активация калликреин-кининовой системы возникает не только при свертывании крови, но и при многочисленных воспалительных и дегенеративных повреждениях внутренних органов. Внешний, или экзогенный, механизм активации фибринолиза осуществляется с помощью тканевых активаторов плазминогена содержащихся в сосудистом эндотелии, клетках крови, а также в моче (урокиназа). Кроме того, существуют активаторы фибринолиза бактериального происхождения, например, стрептокиназа и стафилокиназа. Тканевой активатор плазминогена (ТАП) –это главный активатор фибринолиза. Он является протеолитическим ферментом и содержится в эндотелии сосудов всех тканей, кроме печени. Поступление этого активатора в кровь увеличивается при эмоциональном напряжении, боли, венозной тромбоэмболии, умеренной физической работе. ТАП синтезируется в при любом повреждении сосуда, в том числе его закупорке тромбом, при интенсивном сжатии (например, сжатии манжетой), а также под влиянием вазоактивных веществ и некоторых лекарственных препаратов (адреналина, норадреналина, никотиновой кислоты). Существует две группы ингибиторов фибринолиза: ингибиторы плазмина и ингибиторы активаторов фибринолиза. α2-Антиплазмин – это фермент (сериновая протеаза), который является быстродействующим ингибитором плазмина. Он мешает плазминогену адсорбироваться на фибрине, снижая количество образующегося плазмина на поверхности сгустка, и тем самым резко замедляет фибринолиз. α2-Макроглобулин – это белок, который инактивирует тромбин, XIIа и плазмин. Механизм ингибирования заключается в образовании неактивного комплекса «α2-макроглобулин-протеаза», который затем переносится в печень. 9. Калликреин-кининовая система кровиКалликреин-кининовая система (ККС) является одной из важнейших физиологических систем организма. Она играет ведущую роль в регуляции активности каскадных протеолитических систем, таких как кининогенез, свёртывание крови, фибринолиз, ренин-ангиотензиновая система. Благодаря деятельности ККС обеспечиваются процессы адаптации и защиты организма, а также осуществляется контроль над различными стадиями морфогенеза клеток отдельных тканей, иммунитетом, развитием воспалительных реакций, возникновением злокачественных новообразований и другими патологическими процессами. Калликреины относятся к трипсиноподобным сериновым протеазам и делятся на плазменные и тканевые. Тканевые калликреины (их не менее десяти) содержатся в тканях некоторых органов и их секретах: в поджелудочной железе, слюнных железах, стенке кишечника, почках и моче, половых и потовых железах. Субстратами для калликреинов являются кининогены. Кининогены– это полифункциональные гликопротеины, молекулы которых состоят из одной полипептидной цепи. Синтезируются кининогены в основном гепатоцитами, однако в активные кинины они превращаются в крови. Прежде чем секретироваться в кровоток, кининогены подвергаются посттрансляционному гликолизированию. Кинины – это большая группа полипептидов, которые обладают сосудорасширяющим и гипотензивным действием. Хорошо изучены два кинина: брадикинин и каллидин. Образование калликреина из прекалликреинапроходит путем частичного протеолиза и катализируется аквированным фактором Хагемана (XIIa). Под действием калликреина расщепляются две пептидные связи в кининогене, что приводит к появлению каллидина. В дальнейшем каллидин превращается в брадикинин. Для этой реакции необходим ангиотензин-I-превращающийфермент, или кининаза II (рис. 9). Образовавшийся брадикинин быстро расщепляется на неактивные фрагменты под действием металлоферментов кининаз. Период полураспада брадикининав большом круге кровообращения равен 17-24 секундам, но еще быстрее он разрушается в малом круге кровообращения. 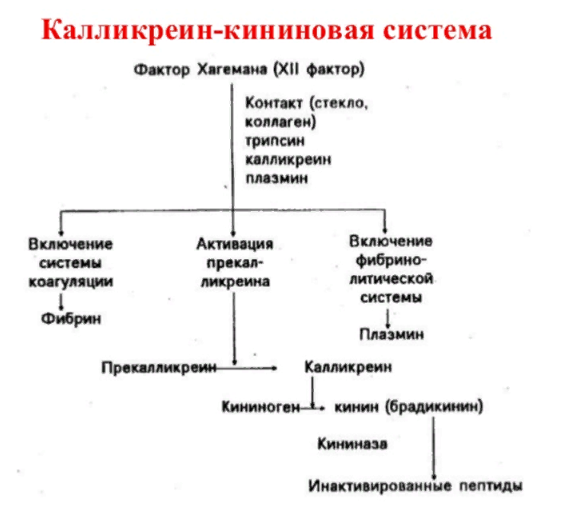 Рис. 15.9 Калликреин-кининовая система Функции калликреин-кининовой системы: - участие во внутреннем механизме образования протромбиназы благодаря активации фактора XIIa и XIa. - обеспечение через фактор XIIa и калликреин взаимосвязи между внешним и внутренним путями образования протромбиназы, активируя факторыVII и XI. - активация фибринолиза. Калликреин является активатором проурокиназы и плазминогена. - участие в регуляции основных биологических функций сосудистой стенки. В частности, брадикинин вызывает расширение просвета периферических и коронарных артерий, тем самым снижая артериальное давление и повышая проницаемость капилляров. - ферменты калликреин-кининовой системы активируют С1-компонент комплемента и проренин, а также стимулируют активацию нейтрофилов либо непосредственно, либо через высвобождение брадикинина. - участие в развитии воспалительных и аллергических реакций. Существует группа противовоспалительных препаратов (контрикал, гордокс), которые ингибируют образование кининов. - под влиянием кининов происходит усиление секреции интерлейкинов –1, 8 (IL-1, IL-8), фактора некроза опухоли «альфа» (TNFa), а также простагландинов и лейкотриенов. - кинины влияют на продукцию и секрецию монооксида азота (NO), расширяющего кровеносные сосуды и являющегося мощным вазодилататором, дезагрегантом тромбоцитов, активатором фибринолиза, а также медиатором ЦНС. - под воздействием брадикинина усиливается сокращение гладкой мускулатуры бронхов и других органов и стимулируется болевой эффект; брадикинин обладает инсулиноподобным действием, способствует усвоению глюкозы периферическими органами, модулирует передачу нервных импульсов в ЦНС |
