углеводороды, их строение и характерные химические свойства — ко. CnH2n, где п
 Скачать 149.32 Kb. Скачать 149.32 Kb.
|
|
АЛКЕНЫ Алкены (этиленовые углеводороды, олефины) - непредельные углеводороды, молекулы которых содержат одну двойную связь. Общая формула ряда алкенов CnH2n, где п целое число начиная с 2. Простейшие представители: 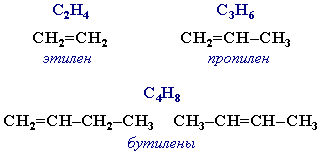 Номенклатура алкенов По систематической номенклатуре названия алкенов производят от названий соответствующих алканов (с тем же числом атомов углерода) путем замены суффикса –ан на –ен: Например: этан → этен ( этилен); пропан → пропен и т.д. Гомологический ряд алкенов С2Н4 этен (этилен) С3Н6 пропен С4Н8 бутен С5Н10 пентен С6Н12 гексен С7Н14 гептен С8Н16 октен С9Н18 нонен С10Н20 декен Главная цепь выбирается таким образом, чтобы она обязательно включала в себя двойную связь (т.е. она может быть не самой длинной). Нумерацию углеродных атомов начинают с ближнего к двойной связи конца цепи. Положение двойной связи указывается цифрой после названия. Например: 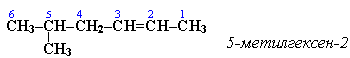 2. Свойства алкенов Физические свойства алкенов закономерно изменяются в гомологическом ряду: от С2Н4 до С4Н8 – газы, начиная с С5Н10 – жидкости, с С18Н36 – твердые вещества. Алкены практически нерастворимы в воде, но хорошо растворяются в органических растворителях. Химические свойства алкенов определяются строением и свойствами двойной связи С=С, которая значительно активнее других связей в молекулах этих соединений. Алкены химически более активны, чем алканы. Для алкенов наиболее характерны реакции, протекающие за разрушения двойной связи. При этом, в продукте реакции образуется одинарная связь, и исходное ненасыщенное соединение превращается в насыщенное без образования других продуктов, т.е. происходит реакция присоединения. Кроме того, алкенам свойственны реакции изомеризации и окисления (в том числе реакция горения, характерная для всех углеводородов). 3. Реакции окисления алкенов Мягкое окисление алкенов водным раствором перманганата калия приводит к образованию двухатомных спиртов (реакция Вагнера): 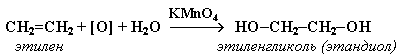 В ходе этой реакции происходит обесцвечивание фиолетовой окраски водного раствора KMnO4. Поэтому она используется как качественная реакция на алкены. При жестком окислении алкенов кипящим раствором KMnO4 в кислой среде происходит полный разрыв двойной связи: 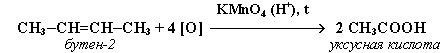 Полное окисление (горение): 5. Получение алкенов 5.1. Крекинг алканов: 5.2. Дегидрогалогенирование галогеналканов (отщепление галогенводорода) при действии спиртового раствора щелочи 5.3. Дегидратация спиртов (отщепление воды) при повышенной температуре (выше 140° C) в присутствии водоотнимающих реагентов 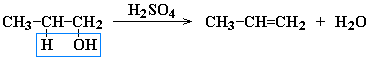 Реакции отщепления идут в соответствии с правилом Зайцева: Отщепление атома водорода в реакциях дегидрогалогенирования и дегидратации происходит преимущественно от наименее гидрогенизированного атома углерода. 5.4. Дегалогенирование (отщепление галогена) дигалогеналканов, имеющих атомы галогена у соседних атомов углерода, при действии активных металлов: 5.5. Дегидрирование (отщепление водорода) алканов при 500°С: 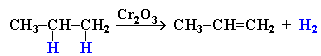 6. Применение алкенов Алкены применяются в качестве исходных продуктов в производстве полимерных материалов (пластмасс, каучуков, пленок) и других органических веществ. Этилен (этен) Н2С=СН2 используется для получения полиэтилена, политетрафторэтилена (тефлона), этилового спирта, уксусного альдегида, галогенопроизводных и многих других органических соединений. 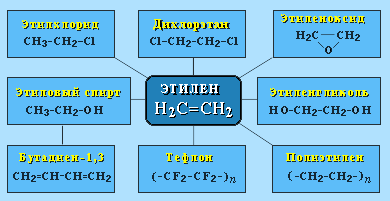 Применяется как средство для ускоренного созревания фруктов. Пропилен (пропен) Н2С=СН2–СН3 и бутилены (бутен-1 и бутен-2) используются для получения спиртов и полимеров. Изобутилен (2-метилпропен) Н2С=С(СН3)2 применяется в производстве синтетического каучука. АЛКИНЫ Алкины (ацетиленовые углеводороды) – непредельные углеводороды, молекулы которых содержат одну тройную связь C≡C. Общая формула алкинов СnH2n-2 , где п целое число, начиная с 2. Простейшие представители:  Тройную связь C≡C осуществляют 6 общих электронов:  1. Номенклатура алкинов Названия алкинов образуются от названий соответствующих алканов (с тем же числом атомов углерода) путем замены суффикса –ан на –ин: этан → этин; пропан → пропин и т.д. Гомологический ряд алкинов С2Н2 этин (ацетилен) С3Н4 пропин С4Н6 бутин С5Н8 пентин С6Н10 гексин С7Н12 гептин С8Н14 октин С9Н16 нонин С10Н18 декин Главная цепь выбирается таким образом, чтобы она обязательно включала в себя тройную связь (т.е. она может быть не самой длинной). Нумерацию углеродных атомов начинают с ближнего к тройной связи конца цепи. Цифра, обозначающая положение тройной связи, ставится обычно после суффикса –ин. Например: 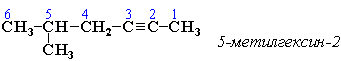 5-метил-гексин-2 2. Свойства алкинов Физические свойства. Температуры кипения и плавления ацетиленовых углеводородов увеличиваются с ростом их молекулярной массы. При обычных условиях алкины С2Н2-С4Н6 – газы, С5Н8-С16Н30 – жидкости, с С17Н32 – твердые вещества. Температуры кипения и плавления алкинов выше, чем у соответствующих алкенов. Алкины плохо растворимы в воде, лучше – в органических растворителях. Химические свойства алкинов сходны с алкенами, что обусловлено их ненасыщенностью. 3. Получение алкинов Ацетилен является важнейшим исходным продуктом в производстве многих органических веществ и материалов. Его получают в больших количествах, используя ряд промышленных методов. Пиролиз метана: Пиролиз этана или этилена: Гидролиз карбида кальция: Карбид кальция образуется при нагревании смеси оксида кальция СаО (жженой извести) и кокса до 2500С: 6. Применение алкинов Наибольшее практическое значение имеют ацетилен H–C≡C–H и винилацетилен CH2=CH–C≡CH. Ацетилен используется для получения самых разнообразных веществ: 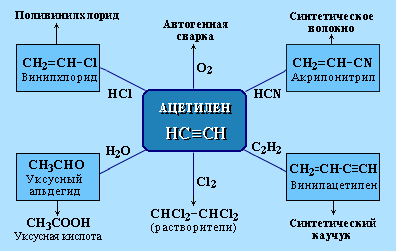 Винилацетилен является важным промежуточным продуктом в производстве масло- и бензостойкого синтетического хлоропренового каучука: 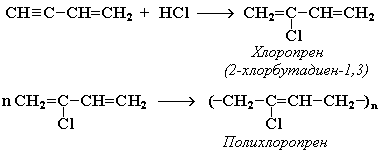 АРЕНЫ (ароматические углеводороды) Арены или ароматические углеводороды – это соединения, молекулы которых содержат устойчивые циклические группы атомов (бензольные ядра) с замкнутой системой сопряженных связей. Простейшие представители (одноядерные арены): 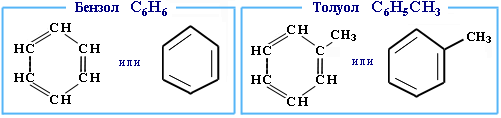 Термин "ароматические соединения" возник давно в связи с тем, что некоторые представители этого ряда веществ имеют приятный запах. Ароматичность молекулы означает ее повышенную устойчивость, обусловленную делокализацией π-электронов в циклической системе. 1. Гомологи бензола. Номенклатура и изомерия Гомологи бензола – соединения, образованные заменой одного или нескольких атомов водорода в молекуле бензола на углеводородные радикалы (R): Общая формула гомологического ряда бензола CnH2n-6, где п – целое число начиная с 6. Номенклатура. Названия аренов образуются от названия углеводородного радикала (приставка) и слова бензол (корень). Например: 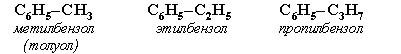 3. Свойства аренов Физические свойства. Бензол и его ближайшие гомологи – бесцветные жидкие вещества (табл. 7.3.1), нерастворимые в воде, но хорошо растворяющиеся во многих органических жидкостях. Легче воды. Огнеопасны. Бензол токсичен (поражает почки, печень, костный мозг, кровь). По химическим свойствам арены отличаются от предельных и непредельных углеводородов. Бензольное кольцо обусловливает повышенную устойчивость бензола и его гомологов.Поэтому арены не склонны вступать в реакции присоединения или окисления, которые ведут к нарушению ароматичности. Для них наиболее характерны реакции, идущие с сохранением ароматической системы, а именно, реакции замещения атомов водорода, связанных с циклом. Другие реакции (присоединение, окисление), в которых участвуют делокализованные углерод-углеродные связи бензольного кольца идут с трудом. 3.1. Реакции замещения в бензольном кольце Галогенирование Замещение атома водорода в бензольном кольце на галоген происходитв присутствии катализаторов AlCl3, AlBr3, FeCl3 и т.п. 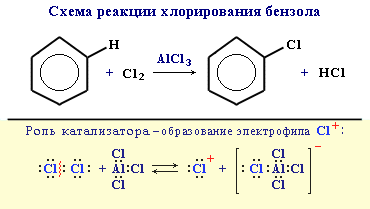 Нитрование Бензол реагирует с нитрующей смесью (смесью концентрированныхазотной и серной кислот): 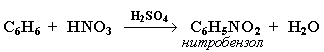 Получение ароматических углеводородов Основными природными источниками ароматических углеводородов являются каменный уголь и нефть. При коксовании каменного угля образуется каменноугольная смола, из которой выделяют бензол, толуол, ксилолы, нафталин и многие другие органические соединения. 5. Применение ароматических углеводородов Бензол С6Н6 используется как исходный продукт для получения различных ароматических соединений – нитробензола, хлорбензола, анилина, фенола, стирола и т.д., применяемых в производстве лекарств, пластмасс, красителей, ядохимикатов и многих других органических веществ. 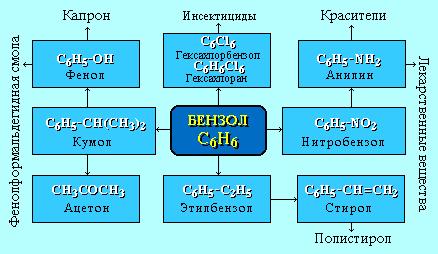 Толуол С6Н5–СН3 применяется в производстве красителей, лекарственных и взрывчатых веществ (тротил, тол). Ксилолы С6Н4(СН3)2 в виде смеси трех изомеров (орто-, мета- и пара-ксилолов) – технический ксилол – применяется как растворитель и исходный продукт для синтеза многих органических соединений. Изопропилбензол (кумол) С6Н4СН(СН3)2 – исходное вещество для получения фенола и ацетона. Винилбензол (стирол) C6H5CН=СН2 используется для получения ценного полимерного материала полистирола. 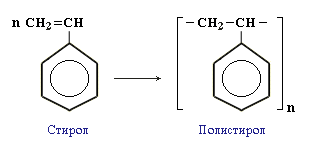 |
