химия вариант 7. Co(OH)3
 Скачать 201.16 Kb. Скачать 201.16 Kb.
|
          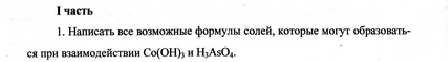 Co(OH)3 гидроксид кобальта (III) (– слабое основание, обладает амфотерными свойствами, по типу основания в водных растворах диссоциирует с образованием следующих ионов Co3+, Co(OH)2+, Co(OH)2+ В результате можно получить одну среднюю соль и две основных. H3AsO4мышьяковая кислота (триводородтетраоксоарсенат(V)) – слабая, трехосновная кислота, при диссоциации в водных растворах образует ионы AsO43-, HAsO42- , H2AsO4- Можно получить одну среднюю соль и две кислых. - при взаимодействии указанных соединений в зависимости от их соотношения могут образоваться пять солей: Средняя или нормальная соль(полная нейтрализация кислоты основанием) CoAsO4- арсенат кобальта (III) Кислые соли (избыток кислоты, неполная нейтрализация кислоты основанием) Co2(HAsO4)3 - гидроарсенат кобальта (III) Co(H2AsO4)3 - дигидроарсенат кобальта (III) Основные соли (избыток основания, неполная нейтрализация основания кислотой). [Co(OH)]3 (AsO4)2арсенат гидроксокобальта(III) [Co(OH)2]3 (AsO4) арсенат дигидроксокобальта(III) Ta) ) ) ) ) ) +732e-8 e-18e-32 e- 11е-2е- Электронная формула: 1s 22s 22p 63s 23p64s 2 3d104p65s24d105p66s24f145d3  S) ) ) +162e-8 e-6e- Электронная конфигурация атома 1s 22s 22p 63s 23p4 Валентные электроны определяются по номеру группы, в которой находится элемент. Сера находится в VI группе, главной подгруппе, значит 6 валентных электронов 3s 23p4 валентные электроны Графическое изображение электронов В нормальном состоянии Нормальное состояние валентность II( два неспаренных электрона) 3s2 3p43d0
Так как на последнем энергетическом уровне у серы есть свободная d-орбиталь и пара Sи P-электронов, то может произойти распаривание электронов ( переход с pна dи с sна d). Возбужденное состояние Далее возможно распаривание электронов, так как есть пары и свободные ячейки. 3s2 3p43d0
3s2 3p33d1
У нас четыре неспаренных электрона, валентность (IV) Далее так же возможно распаривание электронов, так как есть пары и свободные ячейки. 3s23p33d1
3s1 3p33d2
У нас шесть неспаренных электронов, валентность (VI) Рассмотрим нормальное состояние атома серы: Cосчитаем количество электронных пар на внешних подуровнях. В нашем случае их 2 – одна на подуровне 3sи одна на подуровне 3p. Таким образом, валентные возможности (В.в.) атомасеры в нормальном состоянии равны 2: В.в. (S) = 1обм + 1дд.а., в том числе одна по обменному механизму (обм), одна – по донорно-акцепторному (д.а.), где атом серы выступает в качестве донора (д.), т.е. атома, предоставляющего при образовании ковалентной химической связи электронную пару. Формальная схема реализации таких возможностей представлена ниже: 3p 3s 3p 3s Определим валентные возможности атома серы в возбужденном состоянии: 3s1 3p33d2
Исходя из данной графической формулы, валентные возможности атома серы в возбужденном состоянии (S*) равны 9: В.в. (S*) = 6обм + 3ад.а., в том числе шесть по обменному механизму (обм), три – по донорно-акцепторному в качестве акцептора (а), т.е. атома предоставляющего свободные атомные ячейки на задействованном энергетическом уровне. Формальная схема гипотетической реализации таких возможностей представлена ниже: 3p 3s 3d 3pp 3s 3d Na2S -ионная связь SO3 – ковалентная полярная H2S – ковалентная полярная  У нас есть: - AgNO3 – нитрат серебра. Соль, образованная слабым основанием и сильной кислотой. Гидролиз по катиону Молекулярное уравнение: AgNO3 + HOH ⇄AgOH + HNO3 Полное ионное уравнение: Ag+ + NO3- + HOH ⇄AgOH + H+ + NO3- Краткое ионное уравнение: Ag+ + HOH ⇄AgOH + H+ Т.к. в результате гидролиза образовались ионы водорода (H+), то раствор будет имееть кислую среду (pH< 7) Далее образовавшийся гидроксид серебра- неустойчивый и будет разлагаться: 2AgOH =>Ag2O + H2O -Ni – никель, металл средней активности.При хранении на воздухе никель покрывается тонкой защитной пленкой оксида (NiO). В результате гидролиза нитрата серебра образуется азотная кислота. Оксид никеля(II)проявляет основные свойства, поэтому может взаимодействовать с азотной кислотой. NiO + 2HNO3=>Ni(NO3)2+ H2O Таким образом, оксидная пленка может раствориться. И уже чистый никель будет взаимодействовать с азотной кислотой. - Никель может реагировать с разбавленной азотной кислотой. ( в нашем случае концентрированная азотная кислота не образуется) Рассмотрим возможность процесса окислительно- восстановительной реакции с точки зрения ЭДС. Ni + HNO3Ni(NO3)2 + NO + H2O Ni0 - 2e =>Ni2+ 2 3 восстановитель, окисление NO3- + 4H+ + 3e =>NO + 2H2O 3 2 окислитель, восстановление 3Ni0 + 2NO3- + 8H+ => 3Ni2+ + 2NO + 4H2O 3 Ni + 8HNO3 =>3Ni(NO3)2 + 2NO + 4H2O Возьмем численные данные по стандартным окислительно-восстановительным потенциалам (φ0), характеризующие указанные процессы. φ0 (Ni2+ / Ni) = -0.25B φ0(NO3- + 4H+ / NO + 2H2O) = 0,96 В Реакция способная протекать самопроизвольно, если разность потенциалов Δ φ, характеризующих процесс восстановления и окисления (ЭДС реакции), будет больше нуля Рассчитаем ЭДС нашей реакции ЭДС = φ0окислитель - φ0восстановитель ЭДС = φ0(NO3- + 4H+ / NO + 2H2O) - φ0 (Cu2+ / Cu) ЭДС = 0,96 – (- 0,25) = 1.21 В Эдс> 0, значит реакция взаимодействия никеля с азотной кислотой возможна. -Кроме того, никель может реагировать с растворами солей серебра Докажем возможность протекания данной реакции Ni + AgNO3Ni(NO3)2 + Ag Ni0 - 2e =>Ni2+ 2 1 восстановитель, окисление Ag+ + 1e =>Ag0 1 2 окислитель, восстановление Ni0 + 2AgNO3=>Ni(NO3)2 + 2Ag0 φ0 (Ni2+ / Ni) = -0.25 B φ0 (Ag+ / Ag0) = 0,80B ЭДС = φ0окислитель - φ0восстановитель ЭДС = φ0 (Ag+ / Ag0) - φ0 (Ni2+ / Ni) ЭДС = 0,80 –(- 0,25) = 1.05 В Эдс> 0, значит реакция взаимодействия никеля с солями серебра возможна. при гидролизе нитрата серебра может образовываться продукт распада гидроксида серебра – оксид серебра, который будет реагировать с азотной кислотой. Ag2O + 2HNO3 => AgNO3 + H2O |
