ал. Элементы II группы главной подгруппы. Второй группе главной подгруппе периодической системы химических элементов Д. И. Менделеева
 Скачать 91.45 Kb. Скачать 91.45 Kb.
|
|
Элементы II группы главной подгруппы Положение в периодической системе химических элементов Щелочноземельные металлы расположены во второй группе главной подгруппе периодической системы химических элементов Д.И. Менделеева (или просто во 2 группе в длиннопериодной форме ПСХЭ). На практике к щелочноземельным металлам относят только кальций Ca, стронций Sr, барий Ba и радий Ra. Бериллий Be по свойствам больше похож на алюминий, магний Mg проявляет некоторые свойства щелочноземельных металлов, но в целом отличается от них. Однако, согласно номенклатуре ИЮПАК, щелочноземельными принято считать все металлы II группы главной подгруппы. Электронное строение и закономерности изменения свойств Электронная конфигурация внешнего энергетического уровня щелочноземельных металлов: ns2, на внешнем энергетическом уровне в основном состоянии находится 2 s-электрона. Следовательно, типичная степень окисления щелочноземельных металлов в соединениях +2. Рассмотрим некоторые закономерности изменения свойств щелочноземельных металлов. В ряду Be—Mg—Ca—Sr—Ba—Ra, в соответствии с Периодическим законом, увеличивается атомный радиус, усиливаются металлические свойства, ослабевают неметаллические свойства, уменьшается электроотрицательность. Физические свойства Все щелочноземельные металлы — вещества серого цвета и гораздо более твердые, чем щелочные металлы. Бериллий Be устойчив на воздухе. Магний и кальций (Mg и Ca) устойчивы в сухом воздухе. Стронций Sr и барий Ba хранят под слоем керосина. Кристаллическая решетка щелочноземельных металлов в твёрдом состоянии — металлическая. Следовательно, они обладают высокой тепло- и электропроводимостью. Кипят и плавятся при высоких температурах. Нахождение в природе Как правило, щелочноземельные металлы в природе присутствуют в виде минеральных солей: хлоридов, бромидов, йодидов, карбонатов, нитратов и др. Основные минералы, в которых присутствуют щелочноземельные металлы: Доломит — CaCO3 · MgCO3 — карбонат кальция-магния. Магнезит MgCO3 – карбонат магния. Кальцит CaCO3 – карбонат кальция. Гипс CaSO4 · 2H2O – дигидрат сульфата кальция. Барит BaSO4 — сульфат бария. Витерит BaCO3– карбонат бария. Способы получения Магний получают электролизом расплавленного карналлита или хлорида магния с добавками хлорида натрия при 720–750°С:MgCl2 → Mg + Cl2 или восстановлением прокаленного доломита в электропечах при 1200–1300°С: 2(CaO · MgO) + Si → 2Mg + Ca2SiO4 Кальций получают электролизом расплавленного хлорида кальция с добавками фторида кальция: CaCl2 → Ca + Cl2 Барий получают восстановлением оксида бария алюминием в вакууме при 1200 °C: 4BaO + 2Al → 3Ba + Ba(AlO2)2 Качественные реакции Качественная реакция на щелочноземельные металлы — окрашивание пламени солями щелочноземельных металлов. 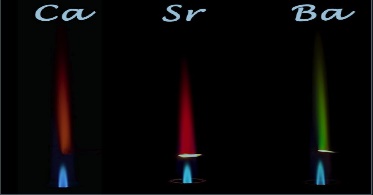 Цвет пламени: Цвет пламени:Ca — кирпично-красный Sr — карминово-красный (алый) Ba — яблочно-зеленый Качественная реакция на ионы магния: взаимодействие с щелочами. Ионы магния осаждаются щелочами с образованием белого осадка гидроксида магния: Mg2+ + 2OH— → Mg(OH)2↓ Качественная реакция на ионы кальция, стронция, бария: взаимодействие с карбонатами. При взаимодействии солей кальция, стронция и бария с карбонатами выпадает белый осадок карбоната кальция, стронция или бария:Ca2++ CO32-→ CaCO3↓ Ba2++ CO32-→ BaCO3↓ Качественная реакция на ионы стронция и бария: взаимодействие с сульфатами. При взаимодействии солей стронция и бария с сульфатами выпадает белый осадок сульфата бария и сульфата стронция:Ba2++ SO42-→ BaSO4↓ Sr2++ SO42-→ SrSO4↓ Также осадки белого цвета образуются при взаимодействии солей кальция, стронция и бария с сульфитами и фосфатами. 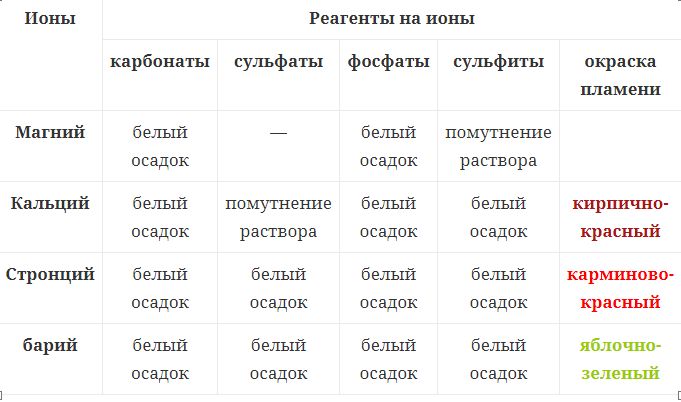 Например, при взаимодействии хлорида кальция с фосфатом натрия образуется белый осадок фосфата кальция: 3CaCl2+ 2Na3PO4→ 6NaCl + 2Ca3(PO4)2↓ Химические свойства 1. Щелочноземельные металлы — сильные восстановители. Поэтому они реагируют почти со всеми неметаллами. 1.1. Щелочноземельные металлы реагируют с галогенамис образованием галогенидов при нагревании. Например, бериллий взаимодействует с хлором с образованием хлорида бериллия: Be + Cl2 → BeCl2 1.2. Щелочноземельные металлы реагируют при нагревании с серой и фосфором с образованием сульфидов и фосфидов. Например, кальций взаимодействует с серой при нагревании: Ca + S → CaS Кальций взаимодействует с фосфором с образованием фосфидов: 3Ca + 2P → Ca3P2 1.3.Щелочноземельные металлы реагируют с водородом при нагревании. При этом образуются бинарные соединения — гидриды. Бериллий с водородомне взаимодействует, магний реагирует лишь при повышенном давлении. Mg + H2 → MgH2 1.4.С азотоммагний взаимодействует при комнатной температуре с образованием нитрида:3Mg + N2 → Mg3N2 Остальные щелочноземельные металлы реагируют с азотом при нагревании. 1.5. Щелочноземельные металлы реагируют с углеродом с образованием карбидов, преимущественно ацетиленидов. Например, кальций взаимодействует с углеродомс образованием карбида кальция: Ca + 2C → CaC2 Бериллий реагирует с углеродом при нагревании с образованием карбида — метанида: 2Be + C → Be2C 1.6.Бериллий сгораетна воздухе при температуре около 900°С: 2Be + O2 → 2BeO Магнийгоритна воздухепри 650°С с выделением большого количества света. При этом образуются оксиды и нитриды: 2Mg + O2 → 2MgO 3Mg + N2 → Mg3N2 Щелочноземельные металлы горят на воздухе при температуре около 500°С, в результате также образуются оксиды и нитриды. Видеоопыт: горение кальция на воздухе можно посмотреть здесь. 2. Щелочноземельные металлы взаимодействуют со сложными веществами: 2.1. Щелочноземельные металлы реагируют с водой. Взаимодействие с водойприводит к образованию щелочи и водорода.Бериллийс водой не реагирует. Магний реагирует с водой при кипячении. Кальций, стронций и барий реагируют с водой при комнатной температуре. Например, кальций реагирует с водойс образованием гидроксида кальция и водорода: Ca0 + 2H2+O = Ca+(OH)2 + H20 2.2.Щелочноземельные металлы взаимодействуют с минеральными кислотами (с соляной, фосфорной, разбавленнойсерной кислотой и др.). При этом образуются соль и водород. Например, магний реагирует с соляной кислотой: Mg + 2HCl → MgCl2 + H2↑ 2.3.При взаимодействии щелочноземельных металлов с концентрированной серной кислотой образуется сера. Например, при взаимодействии кальция с концентрированной серной кислотой образуется сульфат кальция, сера и вода: 4Ca + 5H2SO4(конц.) → 4CaSO4 + S + 5H2O 2.4.Щелочноземельные металлы реагируют с азотной кислотой. При взаимодействии кальция и магния с концентрированной или разбавленной азотной кислотой образуется оксид азота (I): 4Ca + 10HNO3 (конц) → N2O + 4Сa(NO3)2 + 5H2O При взаимодействии щелочноземельных металлов с очень разбавленной азотной кислотой образуется нитрат аммония: 4Ba + 10HNO3 → 4Ba(NO3)2 + NH4NO3 + 3H2O 2.5. Щелочноземельные металлы могут восстанавливатьнекоторые неметаллы (кремний, бор, углерод) из оксидов. Например, при взаимодействии кальция с оксидом кремния (IV) образуются кремний и оксид кальция: 2Ca + SiO2 → 2CaO + Si Магний горит в атмосфере углекислого газа. При этом образуется сажа и оксид магния: 2Mg + CO2 → 2MgO + C 2.6.В расплавещелочноземельные металлы могут вытеснять менее активные металлы изсолей и оксидов. Обратите внимание! В растворе щелочноземельные металлы будут взаимодействовать с водой, а не с солями других металлов. Например, кальций вытесняет медь из расплава хлорида меди (II): Ca + CuCl2 → CaCl2 + Cu Оксиды щелочноземельных металловСпособы получения 1.Оксиды щелочноземельных металловможно получить из простых веществ — окислением металлов кислородом:2Ca + O2 → 2CaO 2. Оксиды щелочноземельных металлов можно получить термическим разложениемнекоторых кислородсодержащих солей — карбонатов, нитратов. Например, нитрат кальция разлагается на оксид кальция, оксид азота (IV) и кислород:2Ca(NO3)2→ 2CaO + 4NO2+ O2 MgCO3 → MgO + CO2 СаСО3 → СаО + СО2 3.Оксиды магния и бериллия можно получить термическим разложением гидроксидов: Mg(OH)2 → MgO + H2O Химические свойства Оксиды кальция, стронция, бария и магния— типичные основные оксиды. Вступают в реакции с кислотными и амфотерными оксидами, кислотами, водой. Оксид бериллия — амфотерный. 1. Оксиды кальция, стронция, бария и магния взаимодействуют с кислотными и амфотерными оксидами: Например, оксид магния взаимодействует с углекислым газом с образованием карбоната магния: MgO + CO2 → MgCO3 2. Оксиды щелочноземельных металлов взаимодействуют с кислотами с образованием средних и кислых солей (с многоосновными кислотами). Например, оксид кальция взаимодействует с соляной кислотой с образованием хлорида кальция и воды: CaO + 2HCl → CaCl2 + H2O 3. Оксиды кальция, стронция и бария активно взаимодействуют с водой с образованием щелочей. Например, оксид кальция взаимодействует с водой с образованием гидроксида кальция: CaO + H2O → 2Ca(OH)2 Оксид магния реагирует с водой при нагревании: MgO + H2O → Mg(OH)2 Оксид бериллия не взаимодействует с водой. 4.Оксид бериллия взаимодействует с щелочами и основными оксидами. При взаимодействии оксида бериллия с щелочами в расплаве или с основными оксидами образуются соли-бериллаты. Например, оксид натрия реагирует с оксидом бериллия с образованием бериллата натрия: Na2O + BeO → Na2BeO2 Например, гидроксид натрия реагирует с оксидом бериллия в расплаве с образованием бериллата натрия: 2NaOH + BeO → Na2BeO2 + H2O При взаимодействии оксида бериллия с щелочами в растворе образуются комплексные соли. Например, оксид бериллия реагирует с гидроксидом калия с растворе с образованием тетрагидроксобериллата калия: 2NaOH + BeO + H2O → Na2[Be(OH)4] Гидроксиды щелочноземельных металлов Способы получения 1. Гидроксиды кальция, стронция и бария получают при взаимодействии соответствующих оксидов с водой. Например, оксид кальция (негашеная известь) при взаимодействии с водой образует гидроксид кальция(гашеная известь):CaO + H2O → Ca(OH)2 Оксид магния взаимодействует с водой только при нагревании: MgO + H2O → Mg(OH)2 2.Гидроксиды кальция, стронция и бария получают при взаимодействии соответствующих металлов с водой. Например, кальций реагирует с водой с образованием гидроксида кальция и водорода: 2Ca + 2H2O → 2Ca(OH)2 + H2 Магний взаимодействует с водой только при кипячении: 2Mg + 2H2O → 2Mg(OH)2 + H2 3. Гидроксиды кальция и магния можно получить при взаимодействии солей кальция и магния с щелочами. Например, нитрат кальция с гидроксидом калия образует нитрат калия и гидроксид кальция:Ca(NO3)2+ 2KOH → Ca(OH)2↓ + 2KNO3Химические свойства 1. Гидроксиды кальция, стронция и бария реагируют с всеми кислотами(и сильными, и слабыми). При этом образуются средние или кислые соли, в зависимости от соотношения реагентов. Гидроксид магния взаимодействует только с сильными кислотами. Например, гидроксид кальция с соляной кислотой реагирует с образованием хлорида кальция:Ca(OH)2 + 2HCl → CaCl2 + 2H2O 2. Гидроксиды щелочных металлов реагируют с кислотными оксидами. При этом образуются средние или кислые соли, в зависимости от соотношения реагентов. Например, гидроксид бария суглекислым газом реагирует с образованием карбонатов или гидрокарбонатов: Ba(OH)2(избыток) + CO2 → BaCO3 + H2O Ba(OH)2 + 2CO2(избыток) → Ba(HCO3)2 3. Гидроксиды кальция, стронция и бария реагируют с амфотерными оксидами и гидроксидами. При этом в расплаве образуются средние соли, а в растворе комплексные соли. Например, гидроксид бария с оксидом алюминия реагирует в расплаве с образованием алюминатовBa(OH)2+ Al2O3→ Ba(AlO2)2+ H2O в растворе образуется комплексная соль — тетрагидроксоалюминат: Ba(OH)2 + Al2O3 + 3H2O → Ba[Al(OH)4]2 4. Гидроксиды кальция, стронция и бария взаимодействуют с кислыми солями. При этом образуются средние соли, или менее кислые соли. Например: гидроксид кальция реагирует с гидрокарбонатом кальция с образованием карбоната кальция: Ca(OH)2 + Ca(HCO3)2 → 2CaCO3 + 2H2O 5.Гидроксиды кальция, стронция и бария взаимодействуют с простыми веществами-неметаллами (кроме инертных газов, азота, кислорода, водорода и углерода). Взаимодействие щелочей с неметаллами подробно рассмотрено в статье про щелочные металлы. 6.Гидроксиды кальция, стронция и бариявзаимодействуют с амфотерными металлами, кроме железа и хрома. При этом в расплаве образуются соль и водород: Ca(OH)2 + Zn → CaZnO2 + H2 В растворе образуются комплексная соль и водород: Ca(OH)2 + 2Al + 6Н2О = Ca[Al(OH)4]2 + 3Н2 7.Гидроксиды кальция, стронция и бариявступают в обменные реакции с растворимыми солями. Как правило, с этими гидроксидами реагируют растворимые соли тяжелых металлов (в ряду активности расположены правее алюминия), а также растворимые карбонаты, сульфиты, силикаты, и, для гидроксидов стронция и бария — растворимые сульфаты. Например, хлорид железа (II) реагирует с гидроксидом бария с образованием хлорида бария и осадка гидроксида железа (II): Ba(OH)2+ FeCl2= BaCl2+ Fe(OH)2↓ Также с гидроксидами кальция, стронция и бариявзаимодействуют соли аммония. Например, при взаимодействии бромида аммония и гидроксида кальция образуются бромид кальция, аммиак и вода: 2NH4Br + Ca(OH)2= 2NH3 + 2H2O + CaBr2 8. Гидроксид кальция разлагаетсяпри нагревании до 580оС, гидроксиды магния и бериллияразлагаютсяпри нагревании:Mg(OH)2 → MgO + H2O 9. Гидроксиды кальция, стронция и бария проявляют свойства сильных оснований. В воде практически полностью диссоциируют, образуя щелочную среду и меняя окраску индикаторов.Ba(OH)2 ↔ Ba2+ + 2OH— Гидроксид магния — нерастворимое основание. Гидроксид бериллия проявляет амфотерные свойства. 10. Гидроксид и бериллия взаимодействует с щелочами. В расплаве образуются соли бериллаты, а в растворе щелочей — комплексные соли. Например, гидроксид бериллия реагирует с расплавом гидроксида натрия: Be(OH)2 + 2NaOH → Na2BeO2 + 2H2O При взаимодействии гидроксида бериллия с избытком раствора щелочи образуется комплексная соль:Be(OH)2+ 2NaOH → Na2[Be(OH)4] Соли щелочноземельных металлов Нитраты щелочноземельных металловНитраты кальция, стронция и бария при нагревании разлагаются на нитриты и кислород. Исключение — нитрат магния. Он разлагается на оксид магния, оксид азота (IV) и кислород. Например, нитрат кальция разлагается при нагревании на нитрит кальция и молекулярный кислород: Ca(NO3)2 →Ca(NO2)2 + O2 Карбонаты щелочноземельных металлов 1. Карбонаты щелочноземельных металлов при нагревании разлагаютсяна оксид и углекислый газ. Например, карбонат кальция разлагается при температуре 1200оС на оксид кальция и углекислый газ:CaCO3 → CaO + CO2 2. Карбонаты щелочноземельных металловпод действием воды и углекислого газа превращаются в растворимые в воде гидрокарбонаты. Например, карбонат кальция взаимодействует с углекислым газом и водой с образованием гидрокарбоната кальция:CaCO3+ H2O + CO2→ Ca(HCO3)2 3. Карбонаты щелочноземельных металлов взаимодействуют с более сильными кислотами с образованием новой соли, углекислого газа и воды. Более сильные кислоты вытесняют менее сильные из солей. Например, карбонат магния взаимодействует с соляной кислотой: CaCO3 + 2HCl → CaCl2 + CO2↑+ H2O 4.Менее летучие оксиды вытесняют углекислый газ из карбонатов при сплавлении. К менее летучим, чем углекислый газ, оксидам относятся твердые оксиды — оксид кремния (IV), оксиды амфотерных металлов. Менее летучие оксиды вытесняют более летучие оксиды из солей при сплавлении. Например, карбонат кальция взаимодействует с оксидом алюминия при сплавлении: CaCO3+ Al2O3→ Ca(AlO2)2+ CO2↑Жесткость водыПостоянная и временная жесткость Жесткость воды — это характеристика воды, обусловленная содержанием в ней растворенных солей щелочноземельных металлов, в основном кальция и магния (солей жесткости). Временная (карбонатная) жесткость обусловлена присутствием гидрокарбонатов кальция Ca(HCO3)2 и магния Mg(HCO3)2 в воде. Постоянная (некарбонатная) жесткость обусловлена присутствием солей, не выделяющихся при кипячении из раствора: хлоридов (CaCl2) и сульфатов (MgSO4) кальция и магния. Способы устранения жесткости Существуют химические и физические способы устранения жесткости. Химические способы устранения временной жесткости: 1. Кипячение. При кипячении гидрокарбонаты кальция и магния распадаются на нерастворимые карбонаты, углекислый газ и воду: Ca(HCO3)2→ CaCO3 + CO2 + H2O 2. Добавление извести (гидроксида кальция). При добавлении щелочи растворимые гидрокарбонаты переходят в нерастворимые карбонаты: Ca(HCO3)2+ Ca(OH)2 → 2CaCO3 + 2H2O Химические способы устранения постоянной жесткости — реакции ионного обмена, которые позволяют осадить ионы кальция и магния из раствора: 1. Добавление соды (карбоната натрия). Карбонат натрия связывает ионы кальция и магния в нерастворимые карбонаты: CaCl2+ Na2CO3 → CaCO3↓+ 2NaCl 2. Добавление фосфатов.Фосфаты также связывают ионы кальция и магния: 3CaCl2+ 2Na3PO4 → Ca3(PO4)2↓ + 6NaCl |
