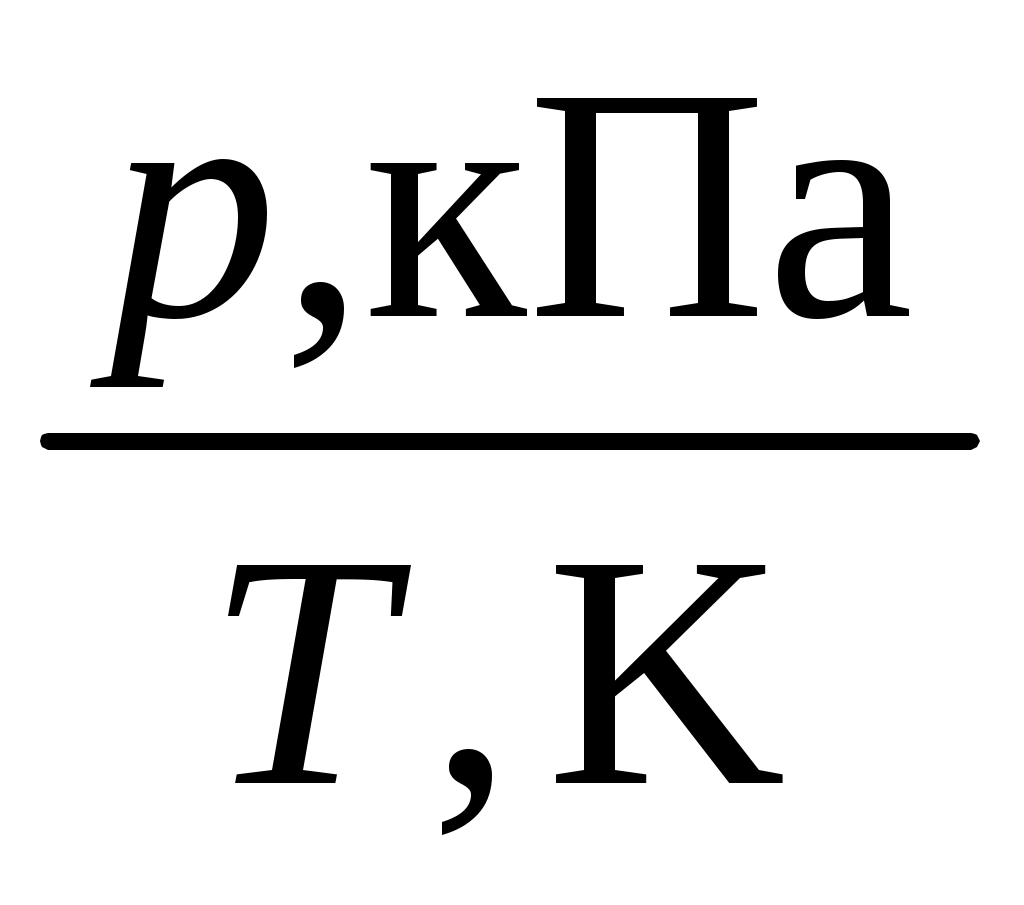Д. И. Менделеева расчётнографические работы по курсу " физическая химия" Москва 2018 Содержание Введение 3 Задание Первое начало термодинамики. Термохимия задание Второй закон
 Скачать 1.19 Mb. Скачать 1.19 Mb.
|
|
Второе начало термодинамики. Энтропия. Термодинамические потенциалы 1. Напишите математическое выражение 2-го закона термодинамики в дифференциальной форме для обратимого (равновесного) и необратимого процессов в открытой системе. 2. Энтропия как критерий состояния равновесия и направления протекания самопроизвольного процесса в изолированной системе. 3. Напишите уравнения, выражающие зависимость энтропии от температуры ( 4. Рассчитайте изменение энтропии ( 5. На основании уравнения зависимости теплоемкости от температуры 6. Используя значения 7. Графическим интегрированием определите изменение энтропии вещества А при изобарном нагревании от 298 до 800 K в 8. Определите абсолютную энтропию 9. Определите изменение энтропии ( 10. Определите абсолютную энтропию вещества А в 11. Определите изменение энтропии ( 12. Укажите при каких условиях проведения процесса 13. Напишите уравнение, выражающее зависимость энергии Гиббса от давления и температуры в дифференциальной форме. Приведите графические зависимости 14. Приведите уравнения для расчета изменения энергии Гиббса при изотермическом расширении от давления 15. Рассчитайте изменение энергии Гиббса ( 16. Рассчитайте изменение энергии Гиббса ( 17. Определите ΔG для 1 моль вещества А, при изменении давления от 18. Определите 19. Определите 20. Определите Если Вы затрудняетесь выполнить это задание, то обратитесь к литературе [9], с. 69 – 93, примеры 5,6,7,16,17,18,20 (задачи с решениями). ЗАДАНИЕ 3 Фазовое равновесие в однокомпонентных системах 1. Изобразите диаграмму состояния в координатах 2. Правило фаз Гиббса. Рассчитайте число степеней свободы в фигуративных точках, отвечающих различным областям диаграммы. 3. Напишите уравнение Клапейрона–Клаузиуса в дифференциальной форме для равновесия жидкость–пар и твердое – пар. 4. Напишите уравнение Клапейрона–Клаузиуса в дифференциальной форме для равновесия жидкость–твердое. Путем анализа уравнения Клайперона–Клаузиуса поясните как изменяется температура плавления с увеличением внешнего давления. 5. Приведите интегральную форму уравнения Клапейрона-Клаузиуса для процесса испарения, если 6. По данным о давлении насыщенного пара над твердым и жидким веществом А при различных температурах (табл. 2, 3) постройте на одном графике зависимости 7. По данным о давлении насыщенного пара над твердым и жидким веществом А при различных температурах постройте на одном графике зависимости 8. По графику (п. 8) найдите температуру и давление в тройной точке. 9. Используя графические зависимости 10. Рассчитайте 11. Определите теплоту плавления Если Вы затрудняетесь выполнить это задание, то обратитесь к литературе [ 9 ], с. 155 – 166 №№ 2, 3, 5, 6 (задачи с решениями). Таблица 2
Таблица 3
| ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||