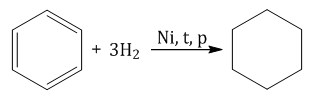МИНИСТЕРСТВО НАУКИ И ВЫСШЕГО ОБРАЗОВАНИЯ РОССИЙСКОЙ ФЕДЕРАЦИИ
Федеральное государственное автономное образовательное учреждение высшего образования
«Дальневосточный федеральный университет»

ПОЛИТЕХНИЧЕСКИЙ ИНСТИТУТ (ШКОЛА)
Департамент нефтегазовых технологий и нефтехимии
О Т Ч Ё Т
по лабораторной работе
Тема ЛР: «Физико-химические свойства углеводородов нефтей и нефтепродуктов. Арены»
Дисциплина: «Свойства углеводородов используемых в нефтегазовом комплексе»
|
Выполнил:
студент гр. Б3121-21.03.01
Маханьков Д.Е.
|
|
Проверил:
преподаватель Верховых О.Е.
отметка о зачете, дата сдачи отчета
|
|
|
г. Владивосток
   2022 2022
Теоретическая часть
Нефть представляет собой сложную смесь соединений, состоящих в основном из углеводородов. Углеводороды нефтей представляют собой алканы, циклоалканы (нафтены), арены, а также углеводороды смешанного строения (рис. 2.1).
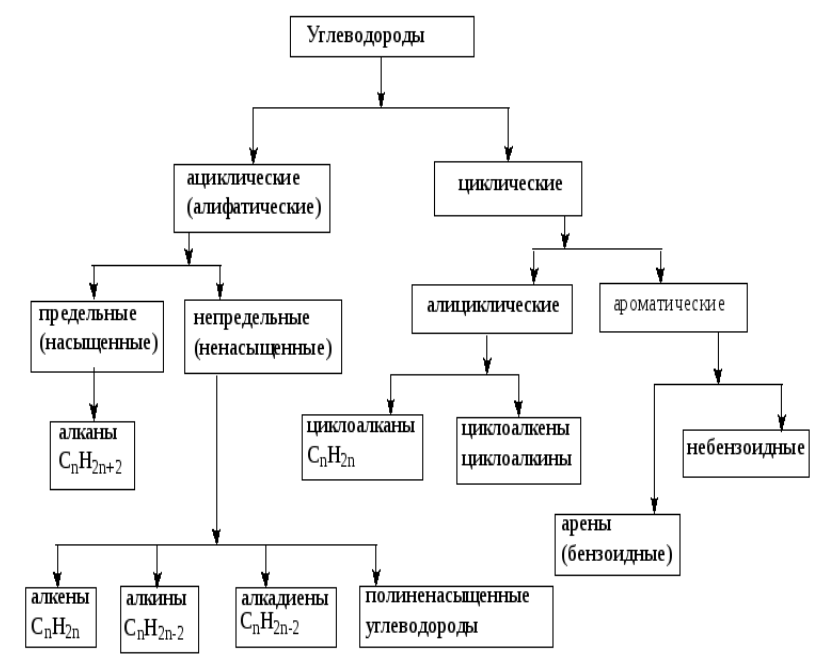
При добыче нефти ее часто сопровождают попутные тазы. В основном это также углеводороды (низкомолекулярные алканы). В результате различных процессов нефтепереработки и нефтехимии получают товарные продукты, содержащие наряду с насыщенными, также ненасыщенные непредельные углеводороды – алкены, алкадиены, алкины.
Целью данной работы является ознакомление с некоторыми методами получения и химическими свойствами отдельных представителей указанных выше типов углеводородов, входящих в состав нефтей и нефтепродуктов. 14
Алканы (предельные, метановые, насыщенные, парафины) – это углеводороды, в состав молекул которых входят атомы углерода, связанные только одинарными связями. Общая формула алканов – СnН2n+2. Все атомы углерода находятся в состоянии гибридизации sp3 , все связи в алканах равноценны и находятся под тетраэдрическим углом друг к другу.
В химическом отношении при обычных условиях алканы менее реакционноспособны, чем углеводороды других типов. К настоящему времени известны следующие основные типы реакций, в которые вступают алканы: реакции замещения водорода (проходят по радикальному механизму, часто только при облучении), реакции окисления, дегидрирования, крекинга (т.е. идущие с расщеплением связей С-С).
Алкены (этиленовые, непредельные, ненасыщенные, олефины) – углеводороды, в молекулах которых между соседними атомами углерода имеется двойная связь. Атомы углерода при двойной связи находятся в состоянии гибридизации sp2 . Двойная связь представляет собой сочетание одинарной σ-связи, образованной за счет осевого перекрывания гибридизованных sp 2 -орбиталей, и π-связи, образованной за счет бокового перекрывания негибридизованных р-орбиталей. Общая формула алкенов – СnН2n.
Алкены – это один из самых реакционноспособных типов углеводородов. В основном реакции идут по двойной π-связи под действием различных реагентов (поскольку π-связь намного слабее, чем σ-связь). Основные типы реакций алкенов – присоединение, полимеризация, окисление и т.д.
Циклоалканы (полиметиленовые, циклопарафины, нафтены) являются, как и алканы, предельными, насыщенными углеводородами, все атомы углерода в которых находятся в состоянии гибридизации sp3 . Атомы углерода в незамещенных циклоалканах замкнуты в цикл. В нефтях найдены циклические углеводороды с пятью и шестью атомами углерода в цикле, поэтому такие циклоалканы получили название нафтенов. Общая формула циклоалканов – СnН2n.
По химическим свойствам нафтены похожи на алканы, т.е. малореакционноспособны. Из реакций следует отметить реакцию дегидрирования шестичленных нафтенов (реакция Зелинского), которая дает возможность получать из низкооктановых нафтенов высокооктановые арены.
Арены (ароматические углеводороды) – углеводороды, в состав молекул которых входит бензольное кольцо (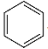 ). Атомы углерода в бензольном кольце находятся в состоянии гибридизации sp 2 . Общая формула простейших аренов – СnН2n-6. ). Атомы углерода в бензольном кольце находятся в состоянии гибридизации sp 2 . Общая формула простейших аренов – СnН2n-6.
Арены вступают в реакции замещения в бензольном кольце (галогенирование, нитрование, сульфирование, алкилирование, ацилирование), в реакции окисления, присоединения, замещения водорода в боковых цепях (последние аналогичны реакциям алканов).
Наиболее характерными для аренов являются реакции замещения водорода в бензольном кольце. При наличии в бензольном кольце заместителей следующая группа встает не в любое, а в строго определенное положение по отношению к первой. Заместители, которые облегчают проведение реакций и направляют следующую группу в орто-, и параположения по отношению к себе, называются заместителями (ориентантами) I рода. Это алкильные группы Alk- (CH3-. C2H5- и т.п.), группы -ОН, NH2, а также галогены (однако последние затрудняют протекание реакции). Заместители, которые затрудняют реакции и направляют следующую группу в мета-положение по отношению к себе, называются заместителями (ориентантами) II рода. К ним относятся: -NO2, -SO3H, -СООН, -С≡N, -СНО.
Арены являются высокооктановыми компонентами моторных топлив, содержание которых из-за токсичности ограничивается. Циклоалканы и нормальные (неразветвленные) алканы обладают низкими октановыми числами. Наиболее ценными компонентами бензинов являются разветвленные алканы.
Ход работы
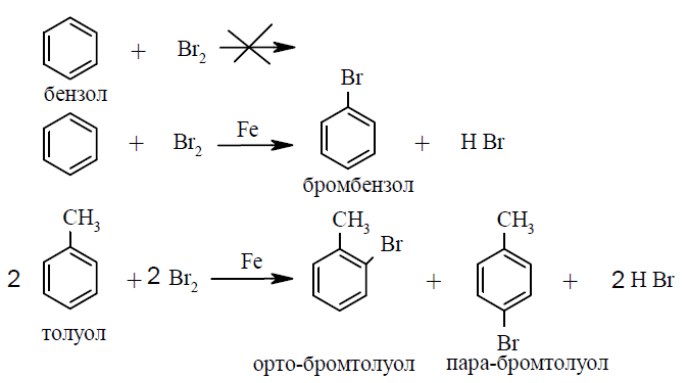
Опыт 1. Бромирование бензола и толуола
В две пробирки наливают по 1 мл бензола, в третью – 1 мл толуола. В одну из пробирок с бензолом и с толуолом добавляют 0,5 г катализатора – железа. Приливают во все три пробирки
0,5 мл раствора брома в тетрахлорметане (CCl4). Нагревают пробирки при встряхивании на водяной бане. Наблюдают, что в пробирке с бензолом без катализатора изменений не происходит, реакция не идет. В остальных случаях происходит постепенное исчезновение окраски брома.
Опыт 2. Окисление толуола
В две пробирки помещают по несколько (3 – 4) капель раствора перманганата калия и разбавленной серной кислоты, затем добавляют в одну пробирку
0,5 мл бензола, а в другую – такое же количество толуола. Сильно встряхивают обе пробирки. Наблюдают, что смесь, содержащая бензол, не изменяет окраски, а в пробирке с толуолом розовая окраска постепенно исчезает. Бензол весьма устойчив к действию окислителей, а гомологи бензола окисляются сравнительно легко с образованием бензойной кислоты:
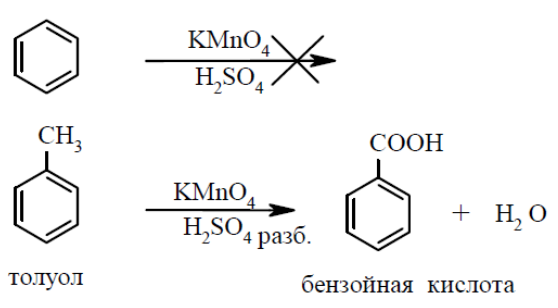
Контрольные вопросы:
1. Дайте определение аренам. Напишите общие формулы.
Арены (ароматические углеводороды) – углеводороды, в состав молекул которых входит бензольное кольцо ( ). Атомы углерода в бензольном кольце находятся в состоянии гибридизации sp 2 . Общая формула простейших аренов – СnН2n-6. (С6Н6–бензол, С6Н5СН3 – толуол) ). Атомы углерода в бензольном кольце находятся в состоянии гибридизации sp 2 . Общая формула простейших аренов – СnН2n-6. (С6Н6–бензол, С6Н5СН3 – толуол)
2. В какие реакции вступают арены? Напишите схемы данных реакций.
Арены могут вступать в реакции: присоединения, замещения, окисления.
Гидрирование бензола
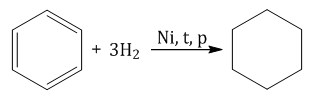
Хлорирование бензола на свету
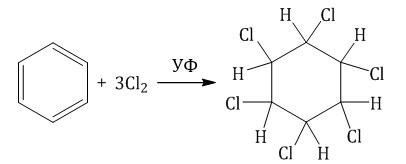
Галогенирование
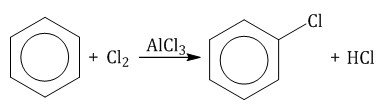
Нитрование
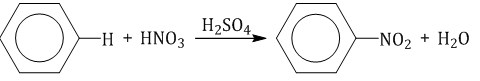
Горение
2C6H6 + 15O2 → 12CO2 + 6H2O + Q
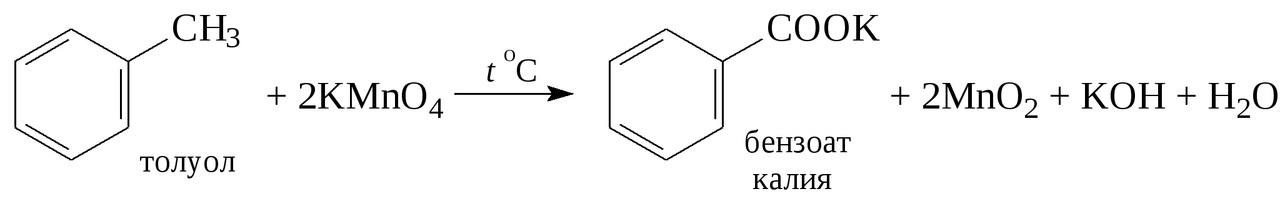
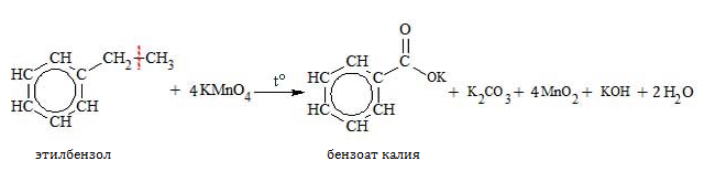
3. Напишите схемы реакций окисления раствором перманганата калия: а) толуола (при нагревании); б) этилбензола (при нагревании).
А) Р-я окисления раствором перманганата калия толуола
Б) Р-я окисления раствором перманганата калия этил бензола
4. Какие заместители активируют бензольное кольцо, а какие дезактивируют?
Увеличение электронной плотности в бензольном кольце называется активацией кольца.
Если заменить H на группу, отдающую электроны (Ориентанты I рода) в бензольном кольце, то кольцо активируется.
Если заменить атом Н электроноакцепторной группой (Ориентанты II рода), кольцо будет деактивировано.
Активирующие
|
Дезактивирующие
|
R, – ОН, – OR, – OCOR, –SH, – SR, – NH2, – NHR, – NHCOR, –N=N–, – CH3, – CH2R, – CR3, – Hal (F, Cl, Br, I)
|
COOH, -CH=O, -C(R)=O, -CN,
-CHal3, -NO2, -NH3 + , -SO3H
|
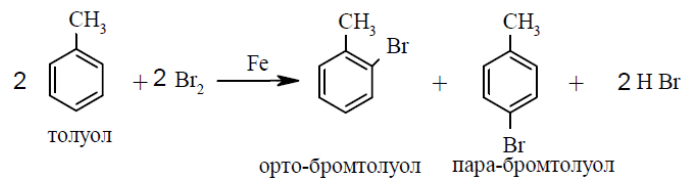
5. Напишите схемы реакций бромирования: а) толуола; б) фенола; в) бензола. Укажите, в каких случаях необходимо использовать катализатор. Назовите образующие соединения.
А)
Б)
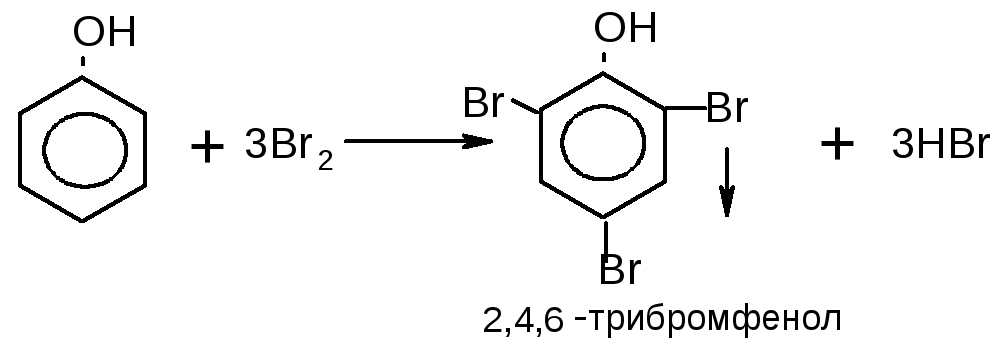
В)
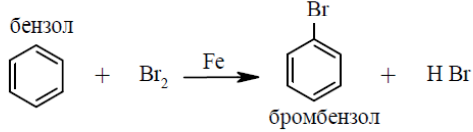
6. Напишите реакцию Зелинского. В чем ее суть?
Реакция Зелинского — каталитическая тримеризация ацетилена с образованием бензола при нагревании.

Вывод
В ходе лабораторной работы мы изучили химические свойства бензола и толуола. Выяснили, что реакция бромирования не протекает без катализатора, в то время как в присутствии катализатора реакции протекают с исчезновением окраски брома. Бензол также не вступил в реакцию с перманганатом калия, в то время как толуол прореагировал и перманганатом калия, в следствии чего произошло постепенное исчезновение окраски. |
 Скачать 490.23 Kb.
Скачать 490.23 Kb.







 2022
2022