Химия. Дано m(P) 10,2 г, V(Cl
 Скачать 33.35 Kb. Скачать 33.35 Kb.
|
|
ВАРИАНТ №3 1. 10,2 г фосфора с 18,42 л хлора образовали хлорид. Определите простейшую формулу хлорида. Дано: m(P) = 10,2 г, V(Cl2) = 18,42 л Найти: формулу PClx Решение. Определить простейшую формулу соединения фосфора с хлором можно, если найти степень окисления фосфора, а она равна его эквивалентному числу z. Его можно найти из соотношения молярной массы фосфора и его молярной массы эквивалента. Таким образом, задача сводится к нахождению M( P). Вещество, для которого возможно вычисление количества вещества эквивалента в данной задаче – это хлор, т.к. для него можно вычислить z: Cl2 + 2е‒ = 2 Cl‒ z(Cl2) = 2, fz (Cl2)=1/2 n( Cl2) = n(Cl2) ∙ z(Cl2) = 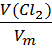 ∙ z (Cl 2) = ∙ z (Cl 2) = n( Р) = n( Cl2) (по закону эквивалентов), тогда M( Р) = > z(Р) =5 Ответ:+5 2. Охарактеризуйте уравнениями реакций химические свойства и процесс диссоциации соединения Ca(OH)2. Гидроксид кальция Ca(OH)2 — неорганическое соединение. Белый, при нагревании разлагается без плавления. Проявляет основные свойства. 2Ca(OH)2 + 2Cl2 = Ca(ClO)2 + CaCl2 + 2H2O, если с хлором реагирует горячий гидроксид кальция (суспензия), то в итоге образуется хлорат кальция, хлорид кальция и вода: Ca(OH)2 + 6Cl2 = Ca(ClO3)2 + 5CaCl2 + 6H2O Процесс диссоциации гидроксида кальция отображается следующим уравнением: Ca(OH)2 Ca2++2OH- 3. Охарактеризуйте корпускулярно-волновую двойственность электрона. Корпускулярно-волновой дуализм (от лат. dualis — двойственный) — является важнейшим универсальным свойством природы, которое состоит в том, что каждому микрообъекту присущи сразу и корпускулярные, и волновые характеристики. Например, электрон, нейтрон, фотон в одних условиях ведут себя как частицы, которые двигаются по классическим траекториям и имеют определенную энергию и импульс, а в других — обнаруживают свою волновую природу, которая характерна для явлений интерференции и дифракции частиц. 4. Структуры внешнего и предвнешнего электронных слоев атомов элементов имеют вид: 3s23p64s13d5 и 4s24p65s14d5. Назовите данные элементы, приведите формулы оксидов и гидроксидов. Структура внешнего и предвнешнего электронных слоев 2 6 5 2 3s 3p 3d 4s соответствует элементу марганцу Mn. Структура внешнего и предвнешнего электронных слоев 2 6 5 2 4s 4p 4d 5s соответствует элементу технецию Tc. Структура внешнего и предвнешнего электронных слоев 2 6 5 2 5s 5p 5d 6s соответствует элементу рению Rе. Марганец, технеций и рений относятся к семейству d-элементов. 5. Дайте определение понятия ионной связи, опишите механизм ее образования и свойства. Приведите примеры ионных соединений. Напишите электронные формулы ионов Са2+, S2–, F–. Ионная (электровалентная) химическая связь — связь, обусловленная образованием электронных пар за счет перехода валентных электронов от одного атома к другому. Примеры: NaF, CaCl 2, MgF 2, Li 2 S, BaO, RbI. Большой подсказкой служит таблица растворимости, ведь все соли имеют ионные связи: CaSO 4, Na 3 PO 4. Одинаковую электронную конфигурацию имеют ион кальция +2 и Si-4, P-3, S-2, Cl-1, Ar, K+1, Sc+3, Ti+4, V+5, Mn+7 Порядок заполнения оболочек атома кальция (Ca2+) электронами: 1s → 2s → 2p → 3s → 3p → 4s → 3d → 4p → 5s → 4d → 5p → 6s → 4f → 5d → 6p → 7s → 5f → 6d → 7p. S(2-) 1s2 2s2 2p6 3s2 3p6(Ar) Ca(2+) тоже самое, как у аниона серы. У ионов завершенный внешний энергетический уровень, как у атомов инертных газов. Одинаковую электронную конфигурацию имеют ион фтора -1 и C-4, N-3, O-2, Ne, Na+1, Mg+2, Al+3, Si+4, P+5, S+6 Порядок заполнения оболочек атома фтора (F-) электронами: 1s → 2s → 2p → 3s → 3p → 4s → 3d → 4p → 5s → 4d → 5p → 6s → 4f → 5d → 6p → 7s → 5f → 6d → 7p. F: 1s2 2s2 2p5 → F-: 1s22s22p6 Одинаковую электронную конфигурацию имеют ион фтора -1 и C-4, N-3, O-2, Ne, Na+1, Mg+2, Al+3, Si+4, P+5, S+6 Порядок заполнения оболочек атома фтора (F-) электронами: 1s → 2s → 2p → 3s → 3p → 4s → 3d → 4p → 5s → 4d → 5p → 6s → 4f → 5d → 6p → 7s → 5f → 6d → 7p. 6. Расставить коэффициенты в схемах реакций и указать, будет ли влиять изменение давления на смещение равновесия. а) 2NO2(г) ↔ N2O4(г); Равновесные молярные концентрации реагентов [NO2] = 2 – 1,5 = 0,5 моль/л [N2O4] = 1,5/2 = 0,75 моль/л б) 3NH3 (г) ↔ N2(г) + Н2(г); для реакции 2NH3(г) ↔ N2(г) + 3H2(г), ∆rН° > 0, в) С(т) + 3Н2(г) ↔ СH4(г); г) FeO(т) + СО(г) ↔ Fe(т) + СО2 (г). исходная концентрация [CO]исх = [CO]pавн. К = [СО2] / [СО] 7. Сформулируйте первый закон термодинамики и напишите его математическое выражение. Запишите выражение первого закона термодинамики для изотермического и изохорного процессов. Первый закон термодинамики: сообщенное системе количество теплоты расходуется на совершение системой работы против внешних сил и изменение внутренней энергии системы. Если работу совершают внешние по отношению к системе тела, то работа газа считается отрицательной, работа внешних тел положительной и А = - A/ Тогда первый закон термодинамики лучше написать в виде ∆U = Q + А. Применение первого закона термодинамики к изопроцессам. Применим первый закон термодинамики к изопроцессам в газах. В изохорном процессе (V = const) газ работы не совершает, A = 0. Следовательно, Q = ΔU = U (T2) – U (T1). Здесь U (T1) и U (T2) – внутренние энергии газа в начальном и конечном состояниях. Внутренняя энергия идеального газа зависит только от температуры (закон Джоуля) . При изохорном нагревании тепло поглощается газом (Q > 0), и его внутренняя энергия увеличивается. При охлаждении тепло отдается внешним телам (Q < 0). В изобарном процессе (p = const) работа, совершаемая газом, выражается соотношением A = p (V2 – V1) = p ΔV. Первый закон термодинамики для изобарного процесса дает: Q = U (T2) – U (T1) + p (V2 – V1) = ΔU + p ΔV. При изобарном расширении Q > 0 – тепло поглощается газом, и газ совершает положительную работу. При изобарном сжатии Q < 0 – тепло отдается внешним телам. В этом случае A < 0. Температура газа при изобарном сжатии уменьшается, T2 < T1; внутренняя энергия убывает, ΔU < 0. 8. В медицинской практике широко применяют 10 % гипертонический раствор СаСl2. Определите, какое количество граммов соли нужно растворить в 300 мл воды, чтобы получить раствор с заданной концентрацией. Дано: m(р-ра) = 300 г w = 10% Найти: m(соли) = ? V(H2O) = ? Решение: m(соли) = (m(р-ра)*w)/100% m(соли) = (300*10)/100 = 30 г Ответ: 30 г. 9. Составьте ионные и молекулярные уравнения реакций, протекающих между веществами: FeS + HCl → Молекулярное уравнение: FeS+2HCl = FeCl2+H2S FeS+2H(+) + 2Cl(-) = Fe(2+) + 2Cl(-) + H2S FeS+2H(+) = Fe(2+) + H2S --- ионное уравнение Pb(NO3)2 + K2SO4 →Молекулярное уравнение: Pb(NO3)2 + K2SO4 = PbSO4 + 2KNO3 Pb(2+) + 2NO3(-) + 2K(+)+ SO4(2-)=2K(+) + 2NO3(-) + PbSO4 Pb(2+) + SO4(2-)= PbSO4 -ионное уравнение CaCl2 + H2C2O4 → Молекулярное уравнение: CaCl2 + H2C2O4 = CaC2O4 + 2HCl (реакция обмена) CaC2O4 + 2H(+) + 2Cl(-) = H2C2O4 + Ca(2+) + 2Cl(-) CaC2O4 + 2H(+) =H2C2O4 + Ca(2+) - ионное уравнение (сомневаюсь в правильности) 10. Электронная теория кислот и оснований Льюиса. Дайте определение кислот и оснований согласно этой теории. Приведите примеры. Теория Льюиса (1925 г.) – апротонной или электронной теорией кислот и оснований. Кислотность и основность по бренстеду согласно теории Бренстеда, кислотой называют соединение, способное отдавать протон, т. е. кислота – донор протона, а основание – соединение, способное присоединять протон, т. е. основание является акцептором протона. Основания Льюиса – это доноры пары электронов (спирты, алкоголят-анионы, простые эфиры, амины и т.д.). Кислоты Льюиса – это акцепторы пары электронов, т.е. соединения, имеющие вакантную орбиталь (ион водорода и катионы металлов: H+, Ag+, Na+, Fe2+; галогениды элементов второго и третьего периодов BF3, AlCl3, FeCl3, ZnCl2; галогены; соединения олова и серы: SnCl4, SO3). 11. Рассчитайте рН бикарбонатного буферного раствора, приготовленного из 20 мл 0,1 н раствора Н2СО3 и 80 мл 0,1 н раствора NaНСО3. Кд(Н2СО3) = 4,45 · 10-7. Дано: С (СН3СООН) = 0,1 н Vр (СН3СООН) = 80 мл = 0,08 л С (СН3СООNa) = 0,1 н Vр (СН3СООNa) = 20 мл КД (СН3СООН) = 1,74 · 10– 5 рН = ? Решение: 1. Находим рКкислоты: рКкислоты = – lgКД = – lg 1,74 · 10– 5 = 4,76 2. Находим рН ацетатного буферного раствора: CC · VC 0,02 · 0,1 рН = рКкислоты + lg = 4,76 + lg = 4,16 CК · VК 0,08 · 0,1 Ответ: рН = 4,16 12. Рассчитайте осмотическое давление при 310°К водного раствора, содержащего в 0,1 л дезоксирибозу массой 1,34 г. Каким (гипо- гипер- или изотоническим) является этот раствор по отношению к плазме крови. С4h10o4=134 количество вещества 1,34/134=0,01 pv=nrt p=nrt\v p=0,01*0,0821л ат./моль*К*310/0,1л=2,545ат/молль*К Ответ: Посм= 2,545 или 258 кПа. 13. Составьте ионные и молекулярные уравнения реакции гидролиза NaH2PO4 и рассчитайте Kг. (Kд1 H3PО4 = 7,5·10–3, Kд2H3PO4 = 6,3·10–8, Kд3H3PO4 = 1,3·10–12). NaH2PO4 ↔ Na+ + H2PO4 — (диссоциация соли); Na+ + H2PO4—+ H2O ↔ H3PO4 + OH — + Na+ (полное ионное уравнение); H2PO4—+ H2O ↔ H3PO4 + OH — (сокращенное ионное уравнение); NaH2PO4 + H2O ↔ H3PO4 + NaOH (молекулярное уравнение). Из справочника: Кд''(H3PO4)=6,2*10^(-8) [H+]=Кд''(H3PO4)*(n(NaH2PO4)/n(Na2HPO4) = 6,2*10^(-8)* (0,2/0,1)=6,2*10^(-8)*2= 12,4*10^(-8) моль/л pH=-lg[H+]=-lg12,4*10^(-8)=6,9 При добавлении 0,05 моль NaOH: NaOH + NaH2PO4 = Na2HPO4 + H2O n(Na2HPO4)обр=n(NaOH)=0,05 моль n(NaH2PO4)изр=n(NaOH)=0,05 моль n(Na2HPO4)'=0,10+0,05=0,15 моль n(NaH2PO4)=0,20-0,05=0,15 моль [H+]'=Кд''(H3PO4)*(n(NaH2PO4)'/n(Na2HPO4)' = 6,2*10^(-8)* (0,15/0,15)=6,2*10^(-8) моль/л pH'=-lg[H+]'=-lg 6,2*10^(-8)=7,2 Ответ: 7,2. 14. Используя метод электронного баланса, определите стехиометрические коэффициенты в следующей ОВР: NaCrO2 + Br2 + NaOH → Na2CrO4 + NaBr + H2O NaCrO2 + NaOH+ Br2 = Na2CrO4 + NaBr2 + H2O Cr(+3)-3e=Cr(+6) Br2(0)+2e=2Br(-1) 2Cr(+3)-6e=2Cr(+6) 3Br2(0)+6e=6Br(-1) NaCrO2 + 4NaOH + 3Br2 = Na2CrO4 + 3NaBr2 + 2H2O 15. Медная пластина опущена в раствор соли СuSO4. Охарактеризуйте явление, происходящее на границе металл-раствор и факторы, влияющие на данное явление. Равновесие на границе Cu / CuSO4 смещается в сторону образования металлической меди (Cu Cu2+ + 2), т.е. происходит процесс восстановления меди. Процессы восстановления в электрохимии называют катодными процессами, а соответствующие электроды - катодами. Гальванический элемент Даниэля – Якоби. Рассмотрим систему, в которой два металлических электрода погружены в растворы солей, содержащие собственные ионы (т.е. ионы того же металла, из которого сделан электрод). 16. Определите координационное число, дентатность лигандов и заряд комплексного иона в следующих комплексных соединениях: [Co(NH3)5SO4]Br; Ва[PtCl4]; NaК2[Fe(CN)6)]; [Co(NH3)3(NО2)3]; K3[Ag(S2O3)2]. [Co(NH3)5SO4]Br бидентатный лиганд – ион CO32 образует две связи с комплексообразователем – условным ионом Co(III), а каждая молекула лиганда NH3 – только одну связь. Ва[PtCl4]- [PtCl4(NH3)2] - NH3 нейтр., Cl-, с.о. Pt +4 (х-4=0 → х=4) . [PtCl4(NH3)2] - диаминотетрахлороплатина (IV). NaК2[Fe(CN)6)] = 3K⁺ + [Fe(CN)₆]³⁻ [Fe(CN)₆]³⁻ ⇔ Fe³⁺ + 6CN⁻ железо в степени окисления +3 - комплексообразователь, КЧ=6 [Co(NH3)3(NО2)3] внутреорбитальный комплекс, металл +3, коорд. число 3+3 , заряд комп. иона 0. K3[Ag(S2O3)2] - +1 и -3 Список используемых источников 1. Барагузина, В.В. Общая и неорганическая химия: Учебное пособие / В.В. Барагузина, И.В. Богомолова, Е.В. Федоренко. - М.: ИЦ РИОР, 2017. - 272 c. 2. Валова, (Копылова) В Аналитическая химия и физико-химические методы анализа: Практикум / (Копылова) В.Д. Валова. - М.: Дашков и К, 2016. - 200 c. 3. Димитриев, А.Д. Биохимия: Учебное пособие / А.Д. Димитриев, Е.Д. Амбросьева. - М.: Дашков и К, 2018. - 168 c. |
