ДИАГНОСТИЧЕСКИЕ МАРКЕРЫ ЛОКАЛЬНОГО АЛЛЕРГИЧЕСКОГО РИНИТА. ЛАР. Диагностические маркеры локального аллергического ринита
 Скачать 188.84 Kb. Скачать 188.84 Kb.
|
|
Министерство здравоохранения Красноярского края краевое государственное бюджетное профессиональное образовательное учреждение «Дивногорский медицинский техникум» Монгуш Айза Айдашовна ДИАГНОСТИЧЕСКИЕ МАРКЕРЫ ЛОКАЛЬНОГО АЛЛЕРГИЧЕСКОГО РИНИТА специальность: 34.02.01. Сестринское дело, 412группа. ПМ.02. Информационные технологии Научный руководитель: Вадютин Максим Валерьевич Оценка работы: _______________ __________________________ (подпись преподавателя) Дивногорск 2022 г. СОДЕРЖАНИЕВВЕДЕНИЕ 1 1 ДИАГНОСТИЧЕСКИЕ МАРКЕРЫ ЛОКАЛЬНОГО АЛЛЕРГИЧЕСКОГО РИНИТА НА ПЕРВОЙ ЛИНИИ 4 2 ПОДТВЕРЖДАЮЩИЕ ДИАГНОСТИЧЕСКИЕ МАРКЕРЫ ЛОКАЛЬНОГО АЛЛЕРГИЧЕСКОГО РИНИТА 6 ЗАКЛЮЧЕНИЕ 9 СПИСОК ЛИТЕРАТУРЫ 10 ВВЕДЕНИЕАктуалность: С тех пор, как D.G. Powe и соавтор [1] описали энтопию как локальную аллергическую парадигму, локальные атопические расстройства унифицированного дыхательного тракта стали актуальной темой в аллергологии. К настоящему времени описаны локальная бронхиальная астма [2–5], локальный аллергический ринит [6–10], «двойной аллергический ринит» [11, 12] и локальный аллергический конъюнктивит [13]. Классические атопические болезни дыхательных путей хорошо исследованы в течение многих лет и включены в международные согласительные документы по их диагностике и терапии [14–16]. Но диагностика и лицензированные терапевтические подходы к локальным аллергическим расстройствам органов дыхания пока находятся в разработке. Сравнительное исследование классического аллергического ринита (AР) и локального аллергического ринита (ЛАР) в последнее десятилетие проведено как с теоретической, так и клинической точек зрения [12, 17]. Пациенты с ЛАР имеют те же симптоматические проявления, что и АР (назальная обструкция, чихание, зуд и насморк). Исключение заключается в разнице состава коморбидных состояний. Оба эндотипа ринита встречаются у взрослых и детей, сходны не только по клинической характеристике, но и связаны с сенсибилизацией к домашним пыльцевым клещам (ДПК) D. pteronissinus и D. farinae, иногда демонстрируя тяжелое персистирующее течение с астматическими и глазными симптомами [8, 18, 19]. С теоретической точки зрения патогенез АР и ЛАР имеет сходные черты за исключением механизмов и уровней срыва аллергенной толерантности при ЛАР. Существенно то, что благодаря феномену аллергенной толерантности число людей с одновременным наличием отягощенной атопической наследственности и клинических аллергических проявлений не совпадает с числом людей с наследственностью, но без симптомов (т.е. практически здоровых) [20–23]. Практически здоровые, хотя и сенсибилизированные, индивидуумы всегда существенно преобладают в числе над пациентами с АР и ЛАР. На системном уровне поддержание аллергенной толерантности преимущественно обусловлено сетью протолерогенных клеток и молекул, таких как Т-регуляторные клетки, протолерогенные дендритные клетки, иммуносупрессивные цитокины (интерлейкин (IL)-10, IL-35, трансформирующий фактор роста (TGFb) и т.д.) [20, 24]. На локальном (назальном) уровне аллергенная толерантность в значительной степени зависит от особенностей иннервации носа и складывающего набора соответствующих нейротрансмиттеров [25–27]. Также могут иметь значение локальные концентрации Pathogen-Associated Molecular Patterns (PAMP), которые генерируются из собственной микробиоты, и Allergen-Associated Molecular Patterns (AAMP) [28]. По контрасту с кожей и гастроинтестинальным трактом, иннервация унифицированных дыхательных путей имеет некоторую особенность. Дыхательный тракт снабжается соматосенсорной и вегетативной нервной системой (ВНС), из них последняя опосредует аллергические воспалительные симптомы. ВНС состоит из парасимпатических нейронов, чьи ядра располагаются в головном мозге и действуют через вагус, и симпатических нейронов, чьи ядра локализуются в паравертебральных ганглиях. Гастроинтестинальный тракт дополнительно имеет собственную автономную нервную систему, называемую энтеральной нервной системой и состоящую из первичных внутренних афферентных нейронов, интернейронов и миэнтерального и субмукозного сплетений [25]. Эта система поддерживает аллергенную толерантность в гастроэнтеральном тракте. Если аллергенная толерантность все еще сохраняется на системном уровне, но при этом в носу формируется соответствующий дисбаланс нейротрансмиттеров, ВНС может стать ответственной за автономный срыв толерантности и привести к развитию ЛАР [27]. 1 ДИАГНОСТИЧЕСКИЕ МАРКЕРЫ ЛОКАЛЬНОГО АЛЛЕРГИЧЕСКОГО РИНИТА НА ПЕРВОЙ ЛИНИИПервоначально любой пациент, у которого подозревается аллергический ринит, должен быть обследован в соответствии с ринологическим/аллергологическим согласительным документом [14]. Этот алгоритм включает: сбор анамнеза, клинический осмотр, видеориноскопию, риноманометрию или акустическую ринометрию, спиральную компьютерную томографию придаточных пазух носа, назальную цитологию или гистологию, кожные аллергопробы и определение общего сывороточного иммуноглобулина (IgE). Первичное рутинное оторинологическое исследование применительно к пациентам с неуточненным аллергическим ринитом включает, главным образом, видеориноскопию и компьютерную томографию. Эндоскопия не позволяет выявлять существенную разницу между АР и ЛАР. В подавляющем числе случаев определяются отек и синюшность слизистой носа и назальная обструкция (рис1.), а также у некоторых больных могут быть обнаружены искривление носовой перегородки, риносинусит и полипы. Томография дает возможность уточнить анатомические и сопутствующие воспалительные особенности: назальный гребень, полипоз, гипертрофию носовой раковины, атопию центрального отдела и др. [29, 30]. Кожные аллергопробы используются в аллергологии около 150 лет. Выделяют прик-тесты [31] и интрадермальные пробы. В соответствии с несколькими проспективными исследованиями и на основании системных обзоров прик-тесты продемонстрировали себя как безопасный метод аллергологического тестирования. Кроме того, прик-тесты могут проводиться в любой возрастной группе [14]. В связи с проникновением на ограниченную глубину кожи не было зафиксировано опасных побочных реакций и особенно системной анафилаксии с летальным исходом [32]. 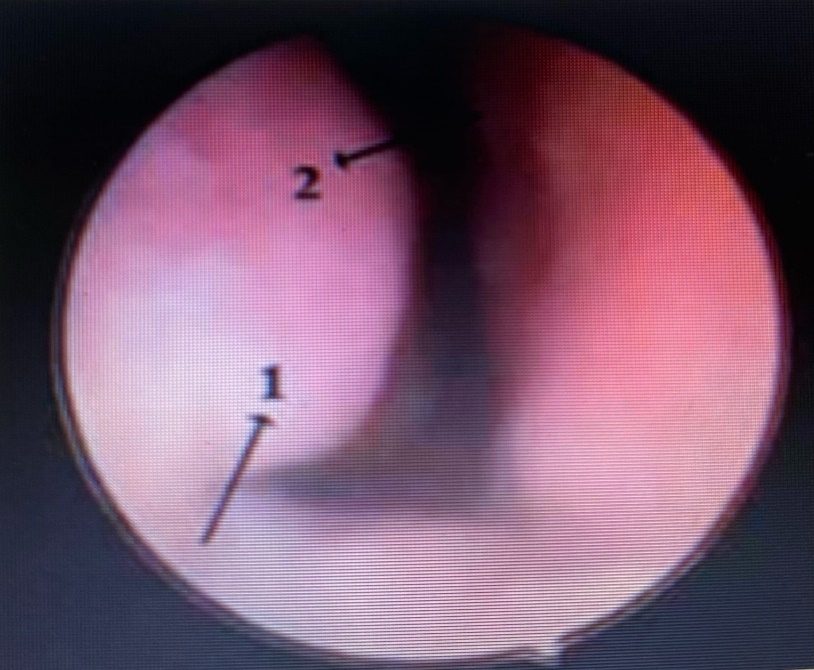 Рисунок 1- Эндоскопическая картина локального аллергического ринита: отек (1) и синюшность (2) слизистой оболочки нижней носовой раковины Интрадермальное тестирование редко используется как первичный подход, чаще – как вторая линия аллерготестирования in vivo. Интересно, что интрадермальные пробы, по-видимому, являются более чувствительными, чем прик-тесты, для аллергенов домашнего происхождения, например, ДПК. Пока не известно, чем это объясняется [14]. Выполнение и надежность измерения общего сывороточного IgE зависят от нескольких факторов, включая выбор реагентов и качество оборудования. Некоторые авторы продемонстрировали недостаточную точность этого маркера для аллергодиагностики вне зависимости от определяемой концентрации [32–34]. В соответствии с продолжающейся научной дискуссией [35], определение IgE не может заменить кожное аллерготестерирование. Это относится и к новейшей технологии компонетного исследования с целью выявления специфических IgE [36]. По-видимому, выраженные цитофильные свойства единственного иммуноглобулина, каким является IgE, предполагает не столько его циркуляцию в биологических жидкостях, сколько присоединение в комплексе с аллергеном к высокоаффинному рецептору FcεRI на базофилах и тучных клетках, что является триггером атопического воспаления [37]. 2 ПОДТВЕРЖДАЮЩИЕ ДИАГНОСТИЧЕСКИЕ МАРКЕРЫ ЛОКАЛЬНОГО АЛЛЕРГИЧЕСКОГО РИНИТАПодтверждение идентификации ЛАР основано на следующем алгоритме [17, 38]: - отсутствие у пациентов системных атопических расстройств, например: пищевой, инсектной аллергии и атопического дерматита; - негативые кожные аллергопробы; - отсутствие повышенного уровня общего сывороточного IgE; - доказательство сенсибилизации в форме IgE на локальном уровне. Неимение системных атопий, повышенной концентрации общего сывороточного IgE и отрицательные кожные аддерготесты подтверждают поддержание аллергенной толерантности на системном уровне у данных пациентов. Однако атопические расстройства в унифицированных дыхательных путях, включая ЛАР, могут развиться у некоторых больных. Следовательно, доказательство присутствия IgE в носу является существенным вопросом для правильной диагностики и исключения ошибок у таких пациентов. Существуют три метода определения специфических назальных IgE: Назальный провокационный тест (НПТ), или аллергенная провокация [14, 19, 39–41] с использованием оценки в форме либо визуального аналогового счета (ВАС) (a, i), либо с помощью риноманометрии (a, ii). Определение специфических назальных IgE [14, 42–44] в носовом секрете (b, i) или носовой ткани, взятых путем мукозальной биопсии носа (МБН) (b, ii). Тест активации базофилов (ТАБ) [12, 14, 45, 46]. Эти три метода отличаются разной специфичностью и чувствительностью (таблица). Специфичность и чувствительность тестов при определении IgE к ДПК при локальном аллергическом рините по данным различных авторов
Таблица №1 Аллерген при НПТ может вводиться с помощью разных устройств: шприцев, назального спрея, капельниц для носа, микропипеток и др. Результат НПТ оценивается через 20 мин после применения аллергена любыми возможными способами оценки: ВАС, риноманометрией определением воспалительных маркеров в назальном секрете и назальной концентрации NO. НПТ проводится отдельно для аллер генов ДПК D. pteronyssinus и D. farinae в дозе 5 тыс. стандартизованных биологических единиц (SBU)/мл для каждого по 0,2 мл прик-теста через калибровочное устройство в обе ноздри при комнатной температуре [40]. ВАС позволяет оценить изменения назальных симптомов (ринореи, зуда, чихания и обструкции), что дает возможность провести дифференциальную диагностику ЛАР и неаллергического ринита [19]. В настоящее время разработаны специальные компьютерные ВАС-приложения для смартфонов, которые помогают проводить клиническую оценку с высокой эффективностью [39, 48]. Риноманометрическая интерпретация результатов НПТ основана на измерении сопротивления воздушного потока через правый и левый носовые ходы во время спокойного дыхания [40]. В связи с высокой специфичностью и чувствительностью НПТ признается золотым стандартом (см. таблицу) в диагностике ЛАР [9, 12]. Доказательство присутствия специфических назальных IgE в носовых секретах диагностически важно, но трудно достижимо [14]. При использовании технологии immunoCAP [42] содержание IgE считается повышенным при >0,35 kU/L [42]. Носовые секреты собираются через абсорбтивную фильтровальную бумагу с нижней носовой раковины в течение 5 мин [49], и содержащиеся в них специфические к ДПК IgE анализируются с помощью immunoCAP. Описаны различные методы для лучшей идентификации IgE, включая назальный лаваж, соскабливание и МБН [14, 43, 47], но для клинической практики неинвазивные методы предпочтительны [12]. Итак, определение специфических назальных IgE имеет высокую специфичность, но средней степени чувствительность, что может быть затруднением для диагностики ЛАР. ТАБ выполняется с клетками периферической крови на проточном цитофлуориметре, когда выявляется экспрессия активационных маркеров типа CD63 при стимуляции аллергенами ДПК или другого происхождения [12]. ТАБ может быть дополнительным полезным методом для диагностики ЛАР в сомнительных случаях, когда причинно-значимый аллерген не известен или требуется оценить ответ на аллерген-специфическую иммунотерапию (АСИТ) [14, 45]. Как видно из таблицы, БАТ имеет высокую специфичность и средней степени чувствительность. С клинической точки зрения эозинофильный катионный булок, триптаза, цитокины и хемокины являются дополнительными уточняющими маркерами как для ЛАР, так и АР [7, 50]. В связи с особенностями срыва аллергенной толерантности психосома тические маркеры, очевидно, более характерны для ЛАР, чем для АР. С этой целью может использоваться опросник R.L. Spitzer и соавт. [51], который служит полезным инструментом в дифференциальной диагностике этих двух эндотипов аллергического ринита. ЗАКЛЮЧЕНИЕЛАР и АР имеют похожие клинические и эндоскопические признаки. Но диагноз ЛАР основывается на НПТ либо на выявлении специфических назальных IgE или позитивном ТАБ при отсутствии данных за системную атопию [14]. НПТ признается золотым стандартом при идентификации ЛАР, поскольку показывает оптимальную специфичность и чувствительность [9]. К сожалению, иногда некоторые случаи ЛАР остаются невыявленными и по ошибке относятся к группе неаллергических ринитов. В настоящее время протокольным лечением ЛАР является только медикаментозная терапия [40]. Однако ряд исследователей получили обнадеживающие результаты при использовании АСИТ при ЛАР [52]. В целом ЛАР остается патологией, перспективной для дальнейших исследований в современной аллергологии и ринологии [7, 12, 14, 17, 19]. СПИСОК ЛИТЕРАТУРЫ1. Powe D.G., Bonnin A.J., Jones N.S. ‘Entopy’: local allergy paradigm. Clin. Exp. Allergy. 2010; 40 (7): 987–997. DOI: 10.1111/j.1365-2222.2010.03536.x. 2. Campo P., Eguiluz-Gracia I., Salas M. et al. Bronchial asthma triggered by house dust mites in patients with local allergic rhinitis. Allergy. 2019; 74 (8): 1502–1510. DOI: 10.1111/ all.13775. 3. Froidure A., Mouthuy J., Durham S.R. Asthma phenotypes and IgE responses. Eur. Respir. J. 2016 Jan.; 47 (1): 304–319. DOI: 10.1183/13993003.01824-2014. 4. Kılıç E., Kutlu A., Hastalıkları G. et al. Does local allergy (entopy) exists in asthma? J. Clin. Anal. Med. 2016. Letters to Editors from 01.02.2016. DOI: 10.4328/JCAM.3272. 5. Klimov A.V., Isaev P.Yu., Klimov V.V., Sviridova V.S. Endotypes of allergic rhinitis and asthma accompanying food allergy. Бюллетень сибирской медицины. 2019; 18 (2): 287–289. DOI: 10.20538/1682-0363-2019-2-287–289. 6. Rondón C., Canto G., Blanca M. Local allergic rhinitis: A new entity, characterization and further studies. Curr. Opin. Allergy Clin. Immunol. 2010; 10 (1): 1–7. DOI: 10.1097/ ACI.0b013e328334f5fb. 7. Incorvaia C., Fuiano N., Martignago I. et al. Local allergic rhinitis: evolution of concepts. Clin. Transl. Allergy. 2017; 7: 38. DOI: 10.1186/s13601-017-0174-7. 8. De Mello J.F. Local allergic rhinitis. Braz. J. Otorhinolaryngol. 2016; 82 (6): 621–622. DOI: 10.1016/j.bjorl.2016.09.001. 9. Eguiluz-Gracia I., Pérez-Sánchez N., Bogas G. et al. How to diagnose and treat local allergic rhinitis: a challenge for clinicians. J. Clin. Med. 2019; 8 (7): 1062–1074. DOI: 10.3390/ jcm8071062. 10. Zicari A.M., Occasi F., Di Fraia M. et al. Local allergic rhinitis in children: novel diagnostic features and potential biomarkers. Am. J. Rhinol. Allergy 2016; 30 (5): 329–334. DOI: 10.2500/ajra.2016.30.4352. 11. Eguiluz-Gracia I., Fernandez-Santamaria R., Almudena Testera-Montes A., Ariza A., Campo P. et al. Coexistence of nasal reactivity to allergens with and without IgE sensitization in patients with allergic rhinitis. Allergy. 2020; 75 (7): 1689–1698. DOI: 10.1111/all.14206. 12. Maoz-Segal R., Machnes-Maayan D., Veksler-Offengenden I. et al. Local allergic rhinitis: an old story but a new entity. Rhinosinusitis. London: IntechOpen; 2019: 1–9. DOI: 10.5772/ intechopen.86212. 13. Yamana Y., Fukuda K., Ko R., Uchio E. Local allergic conjunctivitis: a phenotype of allergic conjunctivitis. Int. Ophthalmol. 2019; 39 (11): 2539–2544. DOI: 10.1007/s10792-019-01101-z. 14. Wise S.K., Lin S.Y., Toskala E. et al. International consensus statement on allergy and rhinology: allergic rhinitis. Int. Forum Allergy Rhinol. 2018; 8 (2): 108–352. DOI: 10.1002/alr.22073. 15. Global Initiative for Athma. Global strategy for asthma management and prevention. 2020. URL: www.ginasthma.org. 16. Takamura E., Uchio E., Ebihara N. et al. Japanese guideline for allergic conjunctival diseases. Allergol. Int. 2017; 66 (2): 220–229. DOI: 10.1016/j.alit.2016.12.004. 17. Campo P., Eguiluz-Gracia I., Bogas G. et al. Local allergic rhinitis: implications for management. Clin. Exp. Allergy. 2019; 49 (1): 6–16. DOI: 10.1111/cea.13192. 18. Sennekamp J., Joest I., Filipiak-Pittroff B. et al. Local allergic nasal reactions convert to classic systemic allergic reactions: A long-term follow-up. Int. Arch. Allergy Immunol. 2015; 166 (2): 154–160. DOI: 10.1159/000380852. 19. Jung C.-G., Lee J.-H., Ban G.-Y., Park H.-S., Shin Y.S. Prevalence and clinical characteristics of local allergic rhinitis to house dust mites. Yonsei Med. J. 2017; 58 (5): 1047–1050. DOI: 10.3349/ymj.2017.58.5.1047. 20. Wisniewski J., Agrawal R., Woodfolk J.A. Mechanisms of tolerance induction in allergic disease: Integrating current and emerging concepts. Clin. Exp. Allergy. 2013; 43 (2): 164–176. DOI: 10.1111/cea.12016. 21. Abdel-Gadir A., Massoud A.H., Chatila T.A. Antigen-specific Treg cells in immunological tolerance: implications for allergic diseases. F1000Research. 2018; 7: 38. DOI: 10.12688/ f1000research.12650. 22. Calzada D., Baos S., Cremades-Jimeno L., Cárdaba B. Immunological mechanisms in allergic diseases and allergen tolerance: the role of Treg cells. J. Immunol. Res. 2018; 2018: 6012053. DOI: 10.1155/2018/6012053. 23. Calderón M.A., Linneberg A., Kleine-Tebbe J. et al. Respiratory allergy caused by house dust mites: What do we really know? J. Allergy Clin. Immunol. 2015; 136 (1): 38–47. DOI: 10.1016/j.jaci.2014.10.012. 24. Klimov V.V. From basic to clinical immunology. Springer Nature, Cham; 2019. DOI: 10.1007/978-3-030-03323-1. 25. Voisin T., Bouvier A., Chiu I.V. Neuro-immune interactions in allergic diseases: Novel targets for therapeutics. Int. Immunol. 2017; 29 (6): 247–261. DOI: 10.1093/intimm/dxx040 |
