Дикарбоновые кислоты. Дикарбоновые кислоты
 Скачать 89.85 Kb. Скачать 89.85 Kb.
|
|
Дикарбоновые кислоты – это вещества с двумя функциональными одновалентными карбоксильными группами – СООН, функция которых заключается в определении основных свойств этих веществ. Их общая формула – HOOC-R-COOH. И здесь под «R» подразумевается любой органический 2-валентный радикал, представляющий собой атомы, соединенные с функциональной группой молекулы. Наиболее известными являются кислоты линейного строения, содержащие от 2 до 6 атомов углерода: НООС-СООН - этандиовая (номенклатура ИЮПАК) или щавелевая кислота (тривиальная номенклатура) НООС-СН2 -СООН - пропандиовая или малоновая кислота НООС-СН2-СН2-СООН - бутандиовая или янтарная кислота НООС-СН2-СН2-СН2-СООН - пентандиовая или глутаровая кислота НООС-СН2-СН2-СН2-СООН - адипиновая кислота Дикарбоновые кислоты подразделяют в зависимости от типа углеводородного радикала:
За счет наличия дополнительной полярной карбоксильной группы (COOH), способной образовывать водородные связи, дикарбоновые кислоты лучше растворяются в воде и имеют более высокие температуры плавления, чем соответствующие монокарбоновые кислоты. Карбоксильная группа проявляет сильные электроноакцепторные свойства, и поэтому дикарбоновые кислоты являются более сильными кислотами, чем соответствующие монокарбоновые. Названия дикарбоновых кислот по систематической номенклатуре образуют прибавлением окончания «диовая кислота» к названию алкана. Часто применяют тривиальные названия. Свойства дикарбоновых кислот Двухосновные карбоновые кислоты проявляют свойства, характерные для одноосновных кислотам – они образуют соли, сложные эфиры, хлорангидриды и амиды. Помимо этого, они способны вступать в специфические реакции, например, образование циклических ангидридов, двух различных рядов сложных эфиров (кислых и полных) и смешанных производных. По физическим свойствам двухосновные кислоты подобны одноосновным. Это кристаллические вещества с высокими температурами плавления. Одной из особенностей дикарбоновых кислот является то, что кислоты с четным числом углеродных атомов плавятся при более высоких температурах, нежели с нечетным (стоит заметить, что с удлинением углеродной цепи разница в температурах постепенно уменьшается). Низшие гомологи хорошо растворяются в воде. Так же, как и монокарбоновые кислоты, двухосновные кислоты способны образовывать межмолекулярные водородные связи. Особенности К свойствам дикарбоновых кислот также относится образование хелатов. Это – комплексные соединения, состоящие из циклических группировок с комплексообразователем (центральным ионом). Хелаты используются для разделения, аналитического определения и концентрирования самых разных элементов. А в сельском хозяйстве и медицине их используют для ввода в пищу таких микроэлементов, как марганец, железо, медь и т. д. Еще некоторые дикарбоновые кислоты образуют циклические ангидриды – соединения R1CO-O-COR2, которые являются ацилирующими агентами, имеющими способность вступать в реакции с нуклеофилами, электроноизбыточными химическими реагентами. И последняя особенность дикарбоновых кислот – это образование ими полимеров (высокомолекулярных веществ). Оно происходит вследствие реакции с иными полифункциональными соединениями. Химические свойства 1) Образование солей Дикарбоновые кислоты являются двухосновными, поэтому 1 моль кислоты будет взаимодействовать с двумя моль NaOH. При этом вначале образуется кислая соль, затем средняя: 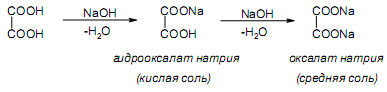 Характерной особенностью щавелевой кислоты является образование нерастворимого осадка оксалата кальция при добавлении к еѐ раствору растворимых солей кальция, что используется в аналитической химии для обнаружения кальция или щавелевой кислоты: (COOH)2 + CaCl2 → (COO)2Ca + 2 HCl Моча животных и человека часто содержит небольшие количества оксалата кальция. Его содержание увеличивается в патологических случаях (оксалурия). Оксалат кальция также может образовывать камни в почках. 2) Поведение при нагревании Щавелевая кислота при нагревании до 150oC претерпевает декарбоксилирование и превращается в муравьиную кислоту: Аналогично и малоновая кислота легко декарбоксилируется с образованием уксусной кислоты: Янтарная и глутаровая при нагревании отщепляют воду и дают ангидриды: 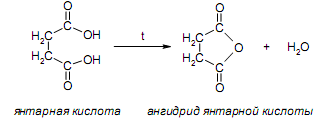 (здесь формула янтарной кислоты изображена в виде конформации ―клешня). Высшие дикарбоновые кислоты отщепляют воду только при действии сильных дегидратирующих агентов – например, P2O5. При этом образуются полимерные ангидриды. Легко образуются те циклические ангидриды, которые имеют 5 или 6 атомов в цикле, т. к. именно в этих случаях напряжения в цикле минимальны. 3) Окисление дикарбоновых кислот Щавелевая кислота легко окисляется перманганатом калия в кислой среде до угольной кислоты, что используется в перманганатометрии: Янтарная кислота является одним из компонентов важнейшего биохимического пути – цикла трикарбоновых кислот (цикл Кребса), в котором она окисляется до ненасыщенной дикарбоновой кислоты – фумаровой: 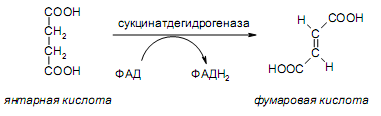 (ФАД – флавинадениндинуклеотид – является коферментом сукцинатдегидрогеназы. Обратите внимание, что два атома водорода переходят от янтарной кислоты к ФАД) 4) Другие реакции Среди очень важных реакций производных дикарбоновых кислот следует отметить синтезы с использованием малонового эфира (включая реакцию Кнѐвенагеля и реакцию Михаэля), конденсацию Дикмана (аналог сложноэфирной конденсации Кляйзена), ацилоиновую конденсацию и термическое разложение солей с образованием циклических кетонов. Получение дикарбоновых кислот Методы получения дикарбоновых кислот Наиболее распространенным способом синтеза высших двухосновных кислот является окисление циклических кетонов. Также высшие дикарбоновые кислоты можно получать из тетрахлоралканов. Требуемые галогеналканы синтезируют по реакции теломеризации из этилена и четыреххлористого углерода. Кислоты с четным числом углеродных атомов в скелете могут быть получены электролизом солей кислых эфиров низших двухосновных кислот. Многие дикарбоновые кислоты встречаются в природе и могут быть выделены из природных источников. Щавелевая кислота широко распространена в растениях. Особенно богаты ею водоросли, грибы, лишайники, папоротники. Кислая калиевая соль содержится в щавеле и кислице (лат. oxalis – кислица, отсюда название солей – оксалаты), магниевая соль в листьях злаков. Как уже отмечалось выше, кальциевая соль содержится в моче. В промышленности щавелевую кислоту получают быстрым нагреванием формиата натрия: 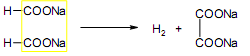 Из образующегося оксалата натрия получают щавелевую кислоту. Щавелевая кислота и ее соли применяются как протрава в кожевенной и текстильной промышленности, в аналитической химии, органическом синтезе, для очистки металлов от ржавчины и накипи, компонент композиций для очистки Al, Cr и Ag, для осаждения редкоземельных элементов. Малоновая кислота в больших количествах находится в свѐкле. Встречается во всех живых организмах, которые синтезируют высшие жирные кислоты, так как это один из субстратов для биосинтеза жирных кислот. В организме образуется путѐм карбоксилирования уксусной кислоты (точнее еѐ производного – ацетил-КоА): Процесс сопровождается гидролизом АТФ и с участием биотина (витамин H), который является коферментом ацетил-КоА-карбоксилазы. Промышленно важная адипиновую кислоту получают окислением циклогексана кислородом (катализатор – стеарат кобальта). Исходный циклогексан получают гидрированием бензола. Адипиновая кислота в основном идѐт на производство нейлона 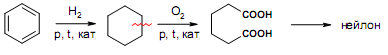 Ненасыщенные дикарбоновые кислоты дикарбоновый кислота химический физический Благодаря стереохимическим особенностям, особое значение имеют фумаровая и малеиновая кислоты, которые отвечают составу бутендиовой кислоты, то есть имеют одну двойную С=С связь и две карбоксильные группы. Обе кислоты являются геометрическими изомерами друг друга и могут быть получены дегидратированием яблочной кислоты: фумаровая образуется при более низкой температуре, а малеиновая – при более высокой: 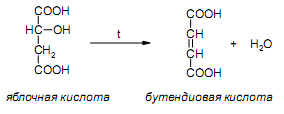 Так как малеиновая кислота при нагревании легко образует циклический ангидрид, а фумаровая кислота не даѐт ангидрида, то был сделан вывод, что малеиновая кислота является цис-изомером, а фумаровая – транс-изомером (Вант-Гофф, Ле-Бель, Вислицениус): 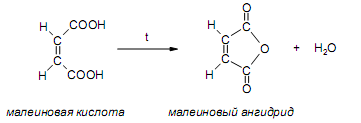 Действительно, у фумаровой кислоты карбоксильные группы расположены слишком далеко друг от друга, чтобы образовать циклический ангидрид: 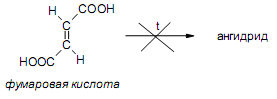 Малеиновая кислота в природе практически не встречается. Еѐ синтезируют из ангидрида, который получают окиcлением бензола кислородом в присутствии V2O5. Малеиновая кислота, бесцветные кристаллы, tпл 139 °С. Используется как антиоксидант для жиров и масел, в производстве янтарной, аспарагиновой и молочной кислот Нахождение в природе и применение кислот: Щавелевая кислота широко распространена в растительном мире. В виде солей содержится в листьях щавеля, ревеня, кислицы. В организме человека образует труднорастворимые соли (оксалаты), например оксалат кальция, которые отлагаются в виде камней в почках и мочевом пузыре. Применяют как отбеливающее средство: удаление ржавчины, красок, лака, чернил; в органическом синтезе. Малоновая кислота (сложные эфиры и соли - малоноаты) содержится в некоторых растениях, например сахарной свекле. Широко используется в органическом синтезе для получения карбоновых кислот. Янтарная кислота (соли и сложные эфиры называются сукцинатами) участвует в обменных процессах, протекающих в организме. Является промежуточным соединением в цикле трикарбоновых кислот. В 1556 году немецким алхимиком Агриколой впервые выделена из продуктов сухой перегонки янтаря. Кислота и ее ангидрид широко используются в органическом синтезе. Фумаровая кислота (НООС-СН=СН-СООН - транс-бутендиовая кислота), в отличие от цис-малеиновой, широко распространена в природе, содержится во многих растениях, много - в грибах, участвует в процессе обмена веществ, в частности в цикле трикарбоновых кислот. Малеиновая кислота(цис-бутендиовая кислоты)в природе не встречается. Кислота и ее ангидрид широко используются в органическом синтезе. |
