Химия. химия ответы тест. Дисциплина общая и неорганическая химия
 Скачать 56.79 Kb. Скачать 56.79 Kb.
|
|
ДИСЦИПЛИНА: «ОБЩАЯ И НЕОРГАНИЧЕСКАЯ ХИМИЯ» 1.Номер периода показывает: а) число протонов б) число нейтронов в) число электронов г) количество энергетических уровней 2. Электронная формула атома натрия: а) Is2 2s2 2p2 б) Is2 2s2 2р6 3s2 Зр4 в) Is2 2s2 2p6 3s1 г) Is2 2s2 2p6 3s2 Зр5 3.Соединение с ионной связью: a) NaCl в) С12 б) SО2 г) Nа 4.Сложные вещества, состоящие из атомов металлов и гидроксогрупп называются: а) кислоты б) соли в) оксиды г) основания 5.В растворах кислот лакмус изменяет свой цвет на: а) малиновый б) красный в) фиолетовый г) желтый 6.Заряд комплексного иона в соединении К3 Fе(СN)6]: а) 1- в) 3- б) 2- г) 1+ 7. Отрицательно заряженные ионы: а) катионы б) анионы в) протоны г) нейтроны 8.Слабый электролит: a) KJ в) КОН б) H2S г) HCI 9. Реакция, относящаяся к редокс -реакциям: а) 2КМnО4 + IOFeSO4 + 8H2SO4 K2SO4 + MnSO4 + 5Fe2(SO4)3 + 8Н2О б) CaO + H2SО4 CaSО4 + H2O в) Ca(OH)2 + H2 SO4 СаSО4 + 2H2O г) FeSО4 + 2NaOH Fe(OH)2 + Na2SO4 10. Наиболее ярко выражены окислительные свойства у: а) фтора б) хлора в) брома г) йода 11. Название H2SO4. а) серная кислота б) сернистая кислота в) сероводородная кислота г) тиосерная кислота 12. Формула оксида фосфора (Ш): а) Аs2О5 в) Р2О5 б) Аs2О3 г) Р2О3 13. В медицине в качестве наружного антисептического средства используют раствор; а) KMnO4 б) MnSO4 в) HCl г) Na2 SO4 14. Осуществить превращение Cu(OH)2 CuSO4 можно с помощью а) серной кислоты б) сульфата натрия в) сероводорода г) сернистого газа 15. К солям относится группа веществ а) NaNO3,NH3,KCl б) NH4C1, KI, Na2CO3 в) H3PO4, K2SO4, AIN г) Fe2 О3, FeCl2, FeCl3 16. При взаимодействии с водородом сера а) является восстановителем б) является окислителем в) повышает степень окисления г) не изменяет степень окисления 17. Азотную кислоту нельзя получить при взаимодействии веществ а) N2 О5 и Н2О б) NH3 и Н2О в) AgNО3 и НС1 г) H2SO4 и Ba(NO3)2 18. Реакция, идущая до конца; а) NaNО3 + HCL б) KNО3 + HCI в) КОН + НС1 г) K2CО3 + NaCI 19. В ряду элементов натрий магний алюминий а) увеличивается число электронных слоев в атомах б) увеличивается число электронов во внешнем и электронном слое в) уменьшается число протонов в ядрах атомов г) уменьшается степень окисления элементов в соединениях с кислородом 20. При взаимодействии концентрированной серной кислоты с медью получаются: а) CuSO4+ H2 б) СuO + H2SO3 в) CuSO4 + H2 O + SO2 г) CuO + H2S 21. В соединении с водородом значение степени окисления -2 всегда имеют химические элементы: а) О и S; б) S и N, в) О и С; г) S и СI. 22. В ряду элементов бериллий → бор → углерод: а) увеличивается число электронных слоев в атомах; б) увеличивается число электронов во внешнем электронном слое; в) уменьшается число протонов в ядрах атомов; г) уменьшается степень окисления элементов в соединениях.с кислородом. 23.Вещества, формулы которых Cu(OH)2, Cu2S7 СuСl2 , Cu2Oсоответственно имеют названия: а) гидроксид меди (li). оксид меди (I), сульфат меди (II), хлорид меди (II). б) гидроксид меди (II), сульфид меди (I). хлорид меди (II), оксид меди (I). в) оксид меди (II). сульфид меди (II), гидроксид меди (I), хлорид меди (II), г) гидроксид меди(II), сульфит меди (II). хлорид меди (II), оксид меди (II). 24. Основание, кислота, соль и кислотный оксид составляют группу веществ: а) Сu(ОН)2 , КОН. Н2S, АI2 О3; б) Fe(OH)3 H2S1O3, Na2S, P2О5 ; в) Zn(OH)2 CuO. AI2 (SO4)3 K2S; г) Ba(OH)2: , FeCI3 ,. H3.PO3. Fe2 О3. 25. Соединение с ковалентной неполярной связью образуется между атомами: а) металлов; б) разных неметаллов; в) с резко различной электроотрицательностью; г) одинаковых неметаллов. 26. Оксид углерода (IV) можно получить при взаимодействии пары веществ: а) карбоната кальция и азотной кислоты; б) карбоната натрия и гидроксида бария; в) угольной кислоты и магния; г) гидроксида кальция и угольной кислоты. 27. К реакциям нейтрализации относится реакция, уравнение которой: а) СаО + H2SO4 → CaSO4 + Н2О ; б) Ba(NO3)2 + K2SO4 →BaSO4 +2KNO3- в) 2NaOH + CuSO4 → Cu (OH)2 +Na2SO4; г) H3PO4 + 3Ca(OH)2 → Ca3(PO4)2 + 6 Н2О 28. Раствор гидроксида натрия (NaOH) взаимодействует с каждым веществом, указанным в ряду: a) SiO2, Na2SO4 H2.SO4 CuO; б) CО2, HCI,CuSO4. H3PO4, в) FeO,Cu, Н2 SO3 ЖЬ, Аl(OH)3 г) SО3, AI, NaNO3 Zn(OH)2 29. При взаимодействии железа с соляной кислотой образуется 2,8 л водорода. Масса «растворившегося» железа: а) 28 г; б) 7 г; в) 14 г: г) 56 г. 30. Молекулярную кристаллическую решетку имеет пара веществ: а) вода и оксид углерода (IV); б) оксид кремния и оксид серы (IV); в) сульфид калия и хлор; г) трафит (С) и оксид углерода (II). 31. В атоме брома число электронных слоев и чисто электронов внешнего слоя соответственно равны а) 4,5 б) 3,7 в)4,7 г) 4,6 32. К солям относится группа веществ a) NaNO3 MH3 КCL б) NH4 .С1. KI. Na2CO2 в) Н3РО4 K2SO4 AIN г) Fe2 О3. FeCI2 FeCI3 33. Соединения с ионным типом связи образуются в том случае, когда взаимодействуют атомы а) одинаковых неметаллов б) с одинаковой электроотрицательностью в) с резко различной электроотрицательностью г) разных неметаллов 34. В соответствии с сокращенным ионным уравнением Сu2 + 2OН = Сu(ОН)2, взаимодействует пара электролитов а) CuSO, и Fе (ОН)2 б) Cu2SO4 и NaOH в) CuCl2 и Са (ОН)2 г) КОН и Cu2S 35. Процесс восстановления хлора показан схемой a) CI-4 → Сl7 6) С1-1 → С1-1 в) С!6→ Сl7 г) Сl-1→ С16 36. Масса соли, полученной при взаимодействии избытка гидроксида натрия с 33,6 л (н.у.) оксида углерода (IV) - а) 79,5 г б) 15,9 г в) 159 г г) 106 г 37. В уравнении реакции получения фосфата кальция Ca3 (PO3)2 при взаимодействии фосфорной кислоты и гидроксида кальция коэффициент перед формулой воды равен а)3 б) 6 в) 2 г)4 38. Основание и соль могут получиться в результате взаимодействия между: a) NaOH и Fe2 (SO4)3 б) Сu(ОН2), и ZnCl2 в) Ba(OH)2 c и KNO3 г) КОН и H2SO4 39. Реакция Fe + S = FeS + 95.4 кДж является реакцией а) ионного обмена, экзотермической, необратимой б) окислительно-восстановительной, экзотермической, необратимой в) ионного обмена экзотермической, необратимой г) окислительно-восстановительной, экзотермической, обратимой 40. Кальций и нитрат серебра можно использовать для осуществления реакций по цепочке превращений а) КС1 → . СаСl2 → AgCI 6)NaCI → AgCI → Ag в) СаСl2 → Сl2 НСl г) НСl → СаСl2 → AgCI 41. Вертикальные группировки элементов, объединяющие в основном сходные по свойствам элементы, называются: а) большие периоды б) группы в) ряды г) малые периоды 42. Вариант заполнения электронами Р подуровня, который соответствует правилу Гунда: В 43 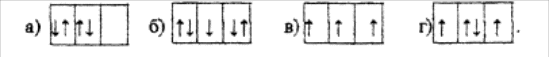 . Реакция, идущая до конца; а) NaNО3 + HCL б) KNО3 + HCI в) КОН + НС1 г) K2CО3 + NaCI 44 . Амфотерное основание: a) NaOH в) Ca(OH)2 б) КОН г) Zn(OH)2 45. В растворах щелочей фенолфталеин становится: а) малиновым б) красным в) синим г) фиолетовым 46. Заряд иона комплексообразователя в соединении К4 Fе(СN)6]: а) 1+ в) 3 + б) 2+ г) 4 + 47. Нейтральная среда: а) рН=7 б) рН=13 в) рН=11 г) рН=9 48. Ионы, которые не могут существовать одновременно в растворе: а) К + и РО43- б) Nа+ и SO42- в) Zn2+ и ОH- г) К+ и NO3- 49. С соляной кислотой не будет взаимодействовать: а) Си б) Fe в) А1 г) Zn 50. Отрицательная: степень окисления азота в соединении: a) N2O б) NO в) NО2 г) Na3N 51. Названию гидрокарбонат натрия соответствует формула: a) NaHCO3 б) Na2СО3 в) NaNO3 г) Na2SO3 52. Какова электронная конфигурация иона AI3+ а) Is б) Is2 2s2 2p6 в) Is2 2s2 2p6 3s2 Зр6 г) Is2 2s2 2p6 3s2 Зр1 53. Названию хлорид кальция соответствует формула: а)CaCI2 б) КС1 в) Са(СlO)2 г) СаО 54. В ряду элементов натрий магний алюминий а) увеличивается число электронных слоев в атомах б) увеличивается число электронов во внешнем и электронном слое в) уменьшается число протонов в ядрах атомов г) уменьшается степень окисления элементов в соединениях с кислородом 55. С помощью раствора, содержащего сульфат-ионы, можно распознать а) катионы натрия б) катионы бария в) гидроксид-ионы г) катионы алюминия 56. Гидроксид меди (II) можно получить при взаимодействии а) СиО и Н2О б) СиО и H2SO4 в) СиО и КОН г) NaOH и CuSO4 57. Соли, при взаимодействии которых с растворами, содержащими ионы водорода, образуется газ, называются а) нитраты б) фосфаты в) карбонаты г) сульфаты 58. С увеличением заряда ядра металлические свойства в группах: а) усиливаются б) ослабевают в) не изменяются 59. Кислород проявляет положительную степень окисления в соединении: a) Na2O б) КМnО4 в) Н2О2 г) OF2 60. Гидрокснд кальция реагирует с: a) NaOH б) Nа2О в) ВаО г) НС1 61. В ряду веществ: K2SO4 → H2SО3 → S → FeS - степень окисления серы: а) повышается от 0 до + 4 б) повышается от - 2 до + 6; в) понижается от + 6 до - 2. Доказать. 62. Изменение свойств оксидов от кислотных к основным происходит в ряду: а) MgO → AI2O3 → SiO2 → Р2О5 ; б) SO3 → СО2 → ВеО → Li2 О; в) ВеО → MgO → СаО → А12О3; г) А12О3 → SiO2 → CQ2 → В2О3. 63. В веществе, название которого фосфат калия, степень окисления фосфора равна а)+5 б)+3 в)-3 г)-5 64. Ковалентная полярная связь и степени окисления химических элементов - 3 и +1 в соединении а) СН4 б) РН3 в) N2 О3 г) AICI3 65. Для получения 13,35г хлорида алюминия потребуется хлор, объемом равным а) 3,36 л б) 6.72 л в) 11,2 л г) 22,4 л 66.Нерастворимое вещество образуется при взаимодействии растворов а) карбоната натрия и азотной кислоты б) нитрата меди (II) и хлорида натрия в) гвдроксида кальция (II) и соляной кислоты г) сульфата железа (III) и гидроксида калия 67. Сокращенное ионное уравнение Са2 + СО23= СаСО3 можно составить для реакции между веществами а) Na2СО3 и H:2SO4 б) К2СО4 и СаС12 в) Са(ОН)2 и НС1 r)Ca(NO3)2 и NaOH 68. Химическая связь элементов в бромоводороде а) ионная б) полярно – ковалентная в) металлическая г) ковалентная неполярная 69. Гидроксид- ионы ОН можно обнаружить в растворе с помощью а) фенолфталеина б) лакмуса синего в) хлорида натрия г) метилоранжа 70. .Вещества, формулы которых Fe(OH)3, FeO, Fe 2 (SО4)3 FeS. соответственно имеют названия: а) гидроксид железа (III). оксид железа (II). сульфат железа (III), сульфид железа (II). б) гидроксид железа (III), оксид железа (II), сульфит железа (III), сульфид железа (II). в) гидроксид железа (III), оксид железа (II). сульфат железа (II), сульфид железа (II). г) гидроксид железа (II). оксид железа (11). сульфат железа (III). сульфид железа (II). 71. Ковалентная полярная связь и степени окисления химических элементов -3 и +1 в соединении: а) СН4; б) СН3; либо PH3 b) N2 О3 г)А1Сl3. 72.Реакция между оксидом меди (II) и серной кислотой относится к реакциям а) обмена б) замещения в) соединения г) разложения 73. Уравнение окислительно-восстановительной реакции a) 2Fe(ОH)3 = Fе2O3 + ЗН2О б) СаО +Н2О = Са(ОН)2 в) NaOH + НI = Nal + Н2О г) 2А1 + 3S = А12S3 74. При взаимодействии растворов гидроксида кальция и карбоната натрия можно получить: а) карбонат кальция, углекислый газ и воду; б) гидроксид натрия, углекислый таз и воду; в) карбонат кальция и гидроксид натрия; г) гидрокарбонат натрия и пигхжарбонат катьция. 75. Гидроксид меди (II) можно получить при взаимодействии а) СuО и Н2О б) СuО и H2SO4 в) Сu и КОН г) NaOH и CuSO4 76. Реакция натрия с водой относится к реакциям: а) соединения; б) замещения; в) разложения; г) обмена. Запишите уравнения реакций. 77. С каждым из веществ, формулы которых BaCl2. Cu(OH)2, Fe, будет взаимодействовать а) сульфат цинка; в) гидроксид натрия; б) нитрат магния; г) серная кислота. 78. В соляной кислоте полностью «растворилась» цинковая пластинка массой 16,25г Объем выделившегося при этом водорода: а) 11,2 л; б) 2,24 л: в) 5,6 л; г) 1.12 л 79. Кислотными оксидами является группа веществ: а) Р2О5, СО, SO2 в) CuO, SO2. SO3 б) . SO3 CO, SO2; r) N 2, O5, СО2 SO3. 80. Основания соответствуют химическим элементам, имеющим следующие порядковые номера в периодической системе: а) 20.16,12; в) 13, 14. 15; б) 12,20,19: г) 6, 11,12. 81. С увеличением заряда ядра металлические свойства в группах: а) усиливаются б) ослабевают в) не изменяются 82. Порядковый номер элемента показывает: а) высшую положительную степень окисления элемента б) высшую отрицательную степень окисления элемента в) атомную массу элемента г) число электронов 83. Сложные вещества, состоящие из двух элементов, один из которых кислород, называются: а) оксиды б) кислоты в) основания г) соли 84. Кислотный оксид: a) SО3 б) К2О в) А12Оз г) Na2O 85. Кислая среда: а) рН=4 б) рН=8 в) рН=9 г) рН=10 86. Соли, образованные сильным основанием и слабой кислотой, имеют реакцию среды: а) кислую б) щелочную в) нейтральную г) близкую к нейтральной 87. Физиологический раствор - это раствор: а) хлорида магния б) сульфата цинка в) гидроксида натрия г) 0,9 % хлорида натрия 88. Кислород проявляет положительную степень окисления в соединении: a) Na2O б) КМnО4 в) Н2О2 г) OF2 89. При взаимодействии концентрированной серной кислоты с медью получаются: а) CuSO4+ H2 б) СuO + H2SO3 в) CuSO4 + H2 O + SO2 г) CuO + H2S 90. Формула нитрата калия: а) КNO3 б) Са(NO3)2 в) KNO2 г) Са(NО2)2 91. Реактив, используемый для обнаружения углекислого газа; а) нитрат серебра б) хлорид бария в) известковая вода г) оксалат аммония 92. Гидрооксид алюминия проявляет свойства: а) амфотерные б) кислотные в) основные 93. Элементы I группы главной подгруппы называют: а) щелочные металлы б) щелочноземельные металлы в) галогены г) инертные газы 94. С разбавленной серной кислотой не реагирует: а) Сu б) Мg в) Fe r) Zn 95. Формула бихромата калия: а) K2CrO4 б) Н2 CrO4 в) K2Cr2 O7 г) Сг2О3 96. Для лечения анемий в медицине используют соединения: а) хрома б) алюминия в) марганца г ) железа 97. Для получения гидроксида меди (II) реакцией обмена может быть использован а) CuSO4 б) CuS в) Cu2SО4 г) Cu2S 98. Отрицательная: степень окисления азота в соединении: a) N2O б) NO в) NО2 г) Na3N 99. Явление, когда один и тот же химический элемент образует несколько простых веществ, называется а) адсорбцией б) аллотропией в) изотопией г) амфотерностью 100. Сильными электролитами являются растворы: а) гидроксида натрия б) хлорида аммония в) гидроксида железа (Ш) г) соляной кислоты 10I. Степень окисления +5 имеет азот в группе веществ a) NH3, N2 О5, HNO3 б) NН4Сl N2 O5 HNO3 в) KNO3 N2 О5, HNO3 г) Ba (NO3)2, HNO2 N2O5 102 В атоме кремния число электронных слоев и число электронов внешнего слоя соответственно равны а) 3, 3 б) 3,2 в) 2,4 г) 3.4 103. В ряду элементов натрий → магний → алюминий а) увеличивается число электронных слоев в атомах б) увеличивается число электронов во внешнем электронном слое в) уменьшается число протонов r ядрах атомов г) уменьшается степень окисления элементов в соединениях с кислородом 104. Неметаллические свойства усиливаются в ряду элементов а) Se → S → О б) О → N → С б) B → Be → Li r) N → P → As 105. К солям относится группа веществ а) NаNO3 , Nib. КО б) NH4C1, Kl, Na3CO3 в) H3 PО4, K2SO4 AIN r) Fe 2O3, FeCl3 106. В водородном соединении фосфора число общих электронных пар а) 3 б) 2 в) 4 г) 5 107. Сульфат бария можно получить при взаимодействии а) Ва(ОН)2. и SO2 б) Ва(NO3)2 и К2SO4 в) Н2О и H2S г) Ва(ОН)2 и Н2S 108.Кислотунельзя получить при взаимодействии веществ а) Ва(NO3)2 и Н2SO4 б) H2О и Р2О5 в) H2О и СаО г) H2 Cl2 109. Масса меди в 0.5 моль оксида меди (П)СuО а) 32г б) 64г в) 16г г) 8г 110. Уравнение реакции ионного обмена а) H2S+3О2 =2SО2+2H2О б) СаСО3 =СаО+СО2 в) Zn + H2SО4 = ZnSО4 +H2 ↑ г) КОН +H2SO4 = K2SO4 +2H2О 111. В процессе реакции, уравнение которой 2Н2S+О2 =2S+2H2О схема превращения серы a) S0 → S +2 б) S 2→ S0 в) S 2 → S4 r)S4 → S--2 112. При полном разложении 10г карбоната кальция образовался углекислый газ объемом а) 4.48 л б) 11,2 л в) 22,4 л г)2,24 л 113. При взаимодействии цинка с серной кислотой получили 5,6л водорода. Масса прореагировавшего цинка а) 32,5 г б) 21,7 г в) 16,25 г г) 24,4 г 114. В уравнении реакции между гидроксидом алюминия и серной кислотой коэффициент перед формулой воды равен а) 6 6) 4 в) 3 г) 2 115. Газообразное вещество образуется при взаимодействии а) ВаСl2 и H2SO4 б) Na2CO3 и НNO3 в) NaOH и СО2 г) Cu(OH)2 и НСl 116. Сокращенное ионное уравнение Сu2 + 2ОН = Сu(ОН)2 можно составить для реакции между веществами а) CuCl2 и iAgNO3 б)Сu(ОH)2 и H2SO4 в) СuSO4 и Вa(NO3)2: г) Cu(NO3)2 и Са(ОН)2 117. В растворе одновременно не могут быть ионы а) К и СО32 б)Са2: и СО32 B) Na и SО42 r) Ca2 и ОН 118. Осуществить превращение Сu(ОН)2 → СuSO4 можно с помощью а) серной кислоты б) сульфата натрия в) сероводорода г) сернистого газа 119. В соответствии с сокращенным ионным уравнением Сu2' + 2ОН = Сu(ОН)2 взаимодействует пара электролитов а) СuSO4 и Fе(ОН)2 б)Cu2SO4 и NaOH в) CuCl2 и Са(ОН)2 г) КОН и Cu2S 120. Процесс окисления азота показан схемой a) N+3 → N-3 б) N +4 → N-2 в) N +3 → N-2 г) N8 →N'4 121. В периодах с увеличением заряда ядра неметаллические свойства: а) усиливаются б) ослабевают в) не изменяются 122. Соединение с коваленгной веполярной связью: а) О2 б) NaCl в) НС1 г) H2SО4 123. Сложные вещества, состоящие из атомов водорода и кислотных остатков, называются; а) кислоты б) соли в) оксиды г) основания 124. Из перечисленных веществ указать кислоту: a) NaOH б) СО2 в) NaCI г) HCI 125. Положительно заряженные ионы: а) катионы б) анионы в) протоны г) нейтроны 126. Сульфаты обнаруживают с помощью раствора: а) нитрата серебра б) нитрата натрия в) хлорида бария г) оксалата аммония 127. При разбавлении серной кислоты всегда приливают кислоту в воду. Разбавление конц. H2SO4 приливанием к ней воды опасно тем, что; а) может возникнуть пожар б) может произойти разложение воды в) может выделиться газ г) может произойти разбрызгивание раствора вследствие выделения теплоты 128. Формула ортофосфорной кислоты: а) HPO2 б) Н3РО3 в) Н3РО4 г) НРО3 129. В медицине используется соединение: а) К2 О б) NаНСОз в) КОН г) Na2CO3 130. Гидроксид кальция реагирует с: a) NaOH б) Nа2О в) ВаО г) НС1 131. Поваренная соль - это: а) хлорид натрии б) карбонат натрия в) гидрокарбонат натрия : г) оксид натрия 132. С разбавленной серной кислотой не реагирует: а) Сu б) Мg в) Fe r) Zn 133. Название FeSO4: а) сульфат железа (II) б) сульфат железа (Ш) в) сульфит железа (II) г) сульфит железа (Ш) 134. Газообразное вещество образуется при взаимодействии а) ВаС12 и H2SO4 б) Na2CO3 и HNO3 в) NаOH и СО2 г) Cu(OH)2 и НС1 135. С помощью соляной кислоты можно определить наличие в растворе а) сульфата меди (II) б) карбоната калия (II) в) хлорида меди г) нитрата натрия 136. Реакция между оксидом меди (II) и серной кислотой относится к реакциям а) обмена б) замещения в)соединения г) разложения 137. Явление, когда один и тот же химический элемент образует несколько простых веществ, называется а) адсорбцией б) аллотропией в) изотопией г) амфотерностью 138. Реакция, идущая до конца; а) NaNО3 + HCL б) KNО3 + HCI в) КОН + НС1 г) K2CО3 + NaCI 139. В ряду элементов натрий магний алюминий а) увеличивается число электронных слоев в атомах б) увеличивается число электронов во внешнем и электронном слое в) уменьшается число протонов в ядрах атомов г) уменьшается степень окисления элементов в соединениях с кислородом 140. При взаимодействии концентрированной серной кислоты с медью получаются: а) CuSO4+ H2 б) СuO + H2SO3 в) CuSO4 + H2 O + SO2 г) CuO + H2S 14I. Степень окисления +6 имеет сера в группе веществ: а) H2SO4 (N-3Н4)2SO4 SO3 в) H2 SO3 SO3 K2 SO3; б) SO2. H2S, SO3 г) SO3 Na2SO4 H2SO4 142. Химическому элементу, образующему простое вещество с наиболее ярко выраженными металлическими свойствами, соответствует схема строения атома: а) +4 )2:)2 в) +12 2)8)2 б) +20 ) 2) 8)8 )2 г) +13 )2 )8)3 143. К кислотам относится группа веществ: а) H2 S5 НNO3 Нвг; в) NH3 НNO3 HJ; б) КСI, НС1, Н2 SO4 г) NaOH, H2SO4 H2S. 144. Ковалентная полярная связь и степени окисления +5 и -2 в веществе: a)NН3; б)Р2О3; в) Н3Р; г) P2O5. 145. Гидроксид меди (II) можно получить при взаимодействии а) СuО и Н2О; б) СuО и H2SO4 в) СuО и КОН; г) NaOH и CuSO4 146. Реакция между магнием и соляной кислотой относится к реакциям: а)соединения; в) разложения; б) обмена: г) замещения, 147. Масса натрия в 0.5 моль карбоната натрия Na2CO3 равна: а) 9,2 г б) 11,5 г в) 46 г г) 23 г 148. С каждым из веществ, формулы которых ВаСl2 Cu(OH)2, Fe, будет взаимодействовать: а) сульфат натрия; б) нитрат алюминия; в) гидроксид бария; г) серная кислота 149. При пропускании хлора над нагретым натрием получили 0,5 моль соли. Объем вступившего в реакцию хлора: а) 5,6 л; б) 11,2 л; в) 2,8 л: г) 8,4 л. 150. Схеме превращений N" → N -4 соответствует уравнение химической реакции a) N2 + О2.=2NO б) 4NH3 + 3О2 = 2N2 +6Н2О в) N2 + ЗН2 = 2NH3 r)NH3 + H2О=NH4OH 151.При взаимодействии с водородом сера а) является восстанови гелем б) является окислителем в) повышает степень окисления г) не изменяет степень окисления 152. Кристаллическую решетку ионного типа имеет вещество, которое: а) прочно, плавится при высокой температуре; б) пластично, плавится при высокой температуре; в) газообразно при 20 "С, хороню растворяется в воде; г) хрупкое, плавится при невысокой температуре. 153. Кислоты состава HR образуют все элементы, имеющие следующие порядковые номера в периодической системе: а) 7,15,33; б) 6, 14, 32; в) 7, 16, 34; г) 15, 16, 17. 154. В ряду элементов натрий → магний → алюминий а) увеличивается число электронных слоев в атомах б) увеличивается число электронов во внешнем электронном слое в) уменьшается число протонов в ядрах атомов г) уменьшается степень окисления элементов в соединениях с кислородом 155. С увеличением заряда ядра атомов металлические свойства в ряду элементов Na → Mg → Al → Si а) усиливаются б) не изменяются в) ослабевает г) изменяются периодически 156. Атомы химических элементов азота и фосфора имеют а) одинаковое число электронов внешнего слоя б) одинаковое число электронов в атоме в) разную высшую степень окисления г) одинаковое число электронных слоев 157. Почерневшую при нагревании медную пластину можно вновь сделать блестящей, если обработать ее поверхность а) соляной кислотой б) известковой водой в) раствором мыла г) нашатырным спиртом 158. Основания соответствуют химическим элементам, имеющим следующие порядковые номера в периодической системе а) 20,16.12 б)12,20.19 в) 13,14,15 г) 6,11,12 159. Среди указанных пар веществ к кислотным оксидам относятся: а) Na2 и SO3 b) CO и N2O5 б) SiO2 и P2O5 г) SO2 и CuO. 160. Реакция Fe + S = FeS + 95,4 кДж является реакцией а) ионного обмена, экзотермической, необратимой б) окислительно-восстановительной, экзотермической, необратимой в) ионного обмена, эндотермической, необратимой г) окислительно-восстановительной, экзотермической, обратимой |
