курсовая работа. КР. Дога А. А. Введение Глава I
 Скачать 271.74 Kb. Скачать 271.74 Kb.
|
|
Дога А. А. Введение Глава I 1.1 Инновационные лекарственные средства 1.2 Воспроизведенные лекарственные препараты 1.3 Эффект от внедрения инновационных средств для общества Глава II 2.1 Примеры микронизированных субстанций 2.2.1 - Микронизированного глибенкламида (Манинил). 2.2.2 - Топические глюкокортикостероиды 2.3 Примеры запатентованной инновацианных ЛП 2.4 Полимерные технологии 2.5 Вспомогательные вещества как потенциальные причины развития нежелательных реакций Заключение Введение Инновационная деятельность и новые технологии, являются одним из основных факторов экономического развития. Как свидетельствует мировой опыт, эффективность национальной экономики определяется степенью развития инновационных процессов, для которых в равной мере важными компонентами являются как получение новых знаний, так и передача их в производственные секторы и социальную сферу. Фармацевтическая промышленность входит в число приоритетных отраслей с точки зрения инновационного развития российской экономики. Фармацевтический рынок относится к категории наиболее динамично развивающихся рынков. Однако нелегко найти отрасль, зависящую от инноваций в большей степени, чем фармацевтическая промышленность. Инновации в фармацевтической отрасли играют уникальную роль. Именно научные открытия и разработки являются движущей силой развития и основой для ее существования. Научно-исследовательские работы в сфере фармацевтики нацелены на профилактику и лечение общих, сложных и «забытых» заболеваний, а также на улучшение существующих лекарственных препаратов и методов лечения, а также повышение качества жизни пациентов. Однако «феномен эволюции болезней» вынуждает исследовательский процесс быть непрерывным и постоянно совершенствующимся. С данной точки зрения инновационное развитие фармацевтической отрасли является крайне перспективным направлением. Основная часть. Для фармацевтической промышленности особое значение приобретают продуктовые инновации, поскольку именно сами лекарственные средства являются жизненно необходимым продуктом для населения страны, но при этом продуктовые инновации важны и для предприятий. Они позволяют фирме максимизировать прибыль за счет повышения по отношению к себестоимости цены реализации единицы нового продукта, а также новых модификаций и модернизаций предыдущей формы лекарственного средства. Согласно международной статистике, фармацевтическая промышленность является наиболее наукоемким и инновационным сектором мировой экономики. Основной целью государственной политики РФ по развитию национальной фармацевтической промышленности на период до 2022 года является создание условий для ее перехода на инновационную модель развития, что должно привести к росту обеспеченности населения, лекарственными средствами отечественного производства, при общем увеличении обеспеченности нуждающихся лекарствами до среднеевропейского уровня как по количественным, так и по качественным показателям. Глава I 1 Инновационные лекарственные средства Инновация-новшество, которое повышает эффективность действующей системы и оценивается получением измеримой дополнительной ценности (прибыль, опережение, лидерство, качественное превосходство). Инновационные лекарственные средства и лекарственные технологии – это новые ЛС, новые лекарственные формы или средства доставки лекарств, защищенные патентом. Какие проблемы стоят перед производителями новых инновационных ЛС? •получение новых химических продуктов; •синтез фармакологически активных метаболитов или их изомеров; •создание новых лекарственных форм (НЛФ) с улучшенными фармакокинетическими свойствами, что позволяет принимать лекарство однократно и получать высокую поддерживающую концентрацию препарата в организме в течение длительного времени, что позволяет обеспечить соответствующий фармакотерапевтический эффект; •это новые средства доставки лекарств (ингаляционные, назальные и трансдермальные ЛС); •средства, получаемые биотехнологическим и биоинженерным путем. •разработка многокомпонентных препаратов Как известно, от синтеза нового препарата и срока окончания действия патента проходит в среднем 35-40 лет. Таким образом, лекарственные препараты, как правило, морально, а иногда и с точки зрения современных знаний о развитии болезней, являются устаревшими. Кроме того, в результате критического обзора современных подходов к классификации лекарственных средств по принципу инновационности были выделены основные параметры определения степени новизны выводимого на рынок ЛП: фармацевтические, фармакотерапевтические и потребительские характеристики. Интересным являются так же результаты исследования Трофимовой Е.О. и Дельвиг-Каменской Т.Ю. (СПбГХФА). В ходе проведенной ими научной работы авторами разработаны подходы к анализу уровней инновационности лекарственных средств, призванные способствовать повышению социальной и экономической эффективности инвестиций в сфере создания новых ЛС. Разработанная классификация, которая позволяет выделить три группы инноваций (базисных, инкрементальных и модификационных), предложенных в рамках теории инноваций, учитывает фармацевтические и фармакотерапевтические характеристики ЛС и три уровня их новизны. Уровни фармацевтической новизны: новизна молекулы (новая в новом классе, новая в известном классе, модификация известной молекулы); новизна ЛС на основе известной молекулы (новая комбинация, новое средство доставки, новая дозировка, новая технология применения / источник получения активного вещества); новизна известного ЛС (новые вспомогательные вещества, новая первичная упаковка и прочие модификации). Уровни фармакотерапевтической новизны: а) — ЛС открывает новое направление в фармакотерапии заболеваний, для лечения и профилактики которых еще нет ЛС, обеспечивающих удовлетворительные результаты; б)— ЛС относится к новому направлению в фармакотерапии заболеваний, для лечения и профилактики которых уже есть ЛС, обеспечивающие удовлетворительные результаты; в) — ЛС относится к известному направлению в фармакотерапии заболеваний, для лечения и профилактики которых уже есть ЛС, обеспечивающие удовлетворительные результаты. В определении уровня инновационности фармакотерапевтических свойств помимо степени новизны направления лечения (сферы применения и механизма действия) учитывается также критерий более высокого или сравнимого уровня эффективности и/или безопасности по сравнению с используемыми препаратами (более низкий уровень эффективности/безопасности не является атрибутом инновационного ЛС). Фармакотерапевтические характеристики входят в более широкую категорию потребительских свойств ЛС. На основании матрицы, учитывающей одновременно и фармацевтические, и фармакотерапевтические/потребительские критерии новизны, были сформулированы основания для определения базисных, инкрементальных и модификационных групп продуктовых фармацевтических инноваций. Разработанная классификация позволяет проследить эволюционную связь между инновациями в фармацевтической сфере. Базисные инновации предлагают принципиально новое решение медицинской проблемы, способное сформировать новый продуктовый рынок. Группа исследователей устанавливает цели исследований, планирует программу исследований и определяет ресурсы, необходимые для выполнения поставленных целей. Именно такие революционные препараты имеют коммерческий успех на современном рынке. За последние годы фармацевтическая медицина сделала большой шаг вперед. Прежние традиционные препараты, такие, как аспирин, лечили только симптомы болезни, и это была так называемая «химическая» эра фармацевтики. В последние годы гораздо больше внимания исследователи стали уделять влиянию биологических соединений на рецепторы, с помощью чего можно по-настоящему бороться с причиной заболевания. Так сегодня лечат артериальную гипертензию, болезни сердца, желудочно-кишечного тракта, неврологические и ревматологические заболевания и ряд других. Особенно биопрепараты успешны при лечении рака. К современной фармацевтике подключилась генетика, изучающая в числе прочего и генные отклонения. По ним исследователи устанавливают, какова реакция человеческого индивидуума на конкретное лекарство как классическое, так и новое. Так гораздо конкретнее, чем прежде, разрабатывается схема лечения больного. Таким образом, стало достаточно перспективно сегодня разрабатывать и продвигать продукты фармакогенетики. Во-первых, ими не лечили прежде. Во-вторых, лечение ряда заболеваний во главе с болезнью Альцгеймера традиционными препаратами не давало положительного результата. Кроме того, фармацевтические компании начали форсировать разработку лекарств от рака. Определенные подвижки есть, но люди продолжают страдать от злокачественных заболеваний, а значит нужно продолжать искать от них панацею. Третья область перспективных исследований — это диабет, поскольку пока нет препарата, который бы боролся с первопричиной болезни. Ведь инсулин только гасит ее последствия. Так гораздо конкретнее, чем прежде, разрабатывается схема лечения больного; 1.2 Эффект от внедрения инновационных средств для общества На вопрос «Что дают на сегодняшний день дают обществу инновационные ЛС и технологии?» профессор Ю.Б. Белоусов отвечает в статье «Инновационные лекарственные препараты в реальной клинической практике»: Можно уверенно говорить, что ежегодно спасается 37,5 тысяч жизней, благодаря внедрению современных антибактериальных препаратов. Особенно демонстративны данные по лечению туберкулеза - количество смертей в 1920 году на 100 тысяч населения составляло 118, в 2000 году смертность стала менее единицы на 100 тысяч населения. Внедрение вакцин против дифтерии, кори и коклюша также привело к значительному снижению смертности. В целом сегодня спасается 295 000 жизней в год. Таблица 1. Эффект от внедрения инновационных средств для общества.
Примечание: + 7 на 100 000 населения. Таблица 2. Экономические преимущества внедрения инновационных препаратов.
2.3 Воспроизведенные лекарственные препараты В последнее время на отечественном фармацевтическом рынке фиксируется значительное увеличение количества воспроизведенных лекарственных препаратов (генериков). По данным статистики их доля составляет 77% и лишь 23% приходятся на оригинальные лекарственные средства. Постоянное увеличение количества воспроизведенных лекарственных препаратов требует повышенного внимания к контролю их качества, эффективности и безопасности. В настоящее время процесс регистрации оригинальных и воспроизведенных лекарственных средств в Российской Федерации регламентируется Российским Федеральным законом (ФЗ) «Об обращении лекарственных средств» от 12 апреля 2010 г. № 61-ФЗ и Федеральным законом от 22.12.2014 № 429-ФЗ (ред. от 13.07.2015) «О внесении изменений в Федеральный закон «Об обращении лекарственных средств». Согласно ФЗ от 22.12.2014 № 429-ФЗ (ред. от 13.07.2015) «О внесении изменений в ФЗ «Об обращении лекарственных средств» понятие «оригинальное лекарственное средство» заменяется на «референтный лекарственный препарат». Под данным термином подразумевается лекарственный препарат, впервые зарегистрированный в Российской Федерации, качество, эффективность и безопасность которого доказаны на основании результатов доклинических и клинических исследований лекарственных средств. Соответственно, можно выделить три вида эквивалентности генерика референтному лекарственному препарату: фармацевтическая, фармакокинетическая (биоэквивалентность) и терапевтическая. Лекарственные препараты считаются фармацевтическими эквивалентами, если они не отличаются по составу активных ингредиентов, имеют одинаковые лекарственную форму и способ введения. Однако фармацевтический эквивалент может отличаться от референта по составу вспомогательных веществ. Например, таблетированные лекарственные формы содержат несколько типов вспомогательных веществ: накопитель (лактоза, микрокристаллическая целлюлоза); связывающее вещество (поливинилпирролидон, гидроксипропилметилцеллюлоза); дезинтегратор- /разрыхлитель (плаздон XL, натрия кроскармелоза); лубрикатор (магния стеарат, натрия стеарилфумарат); глиант (тальк, коллоидный SiO2). Изменение состава вспомогательных веществ может существенно изменить фармакокинетику лекарственного препарата, что в свою очередь может привести к изменению его режима дозирования, профилю безопасности и эффективности. Поэтому для регистрации воспроизведенного лекарственного препарата обязательными являются исследования биоэк вивалентности. Несмотря на то что инновационное и воспроизведенное ЛС содержат одно и то же действующее вещество в одинаковой дозировке и лекарственной форме, эффективность и безопасность генерических препаратов может существенно различаться. Используя дженерик, врач и пациент предполагают его полную терапевтическую эквивалентность оригинальному препарату, однако на практике это не так. Основными причинами таких различий могут быть фармацевтическая технология производства лекарственного препарата, вспомогательные вещества (неактивные ингредиенты, наполнители, консерванты, красители и др.), их природа и количество, полиморфизм, солевая форма, упаковка препарата, условия его хранения и транспортировки. Из-за этих отличий эффективность генерических препаратов и выраженность их побочных эффектов может сильно варьировать. Было показано, что дженерики бета-адреноблокатора пропранолола в 40% случаев отличаются от оригинального препарата. В другом исследовании отмечено, что дженерические препараты стрептокиназы имеют различия в активности от 20,8% до 86,6% по сравнению с оригиналом. В ряде работ показано, что различия в терапевтической эффективности и переносимости оригинальных и воспроизведенных препаратов могут нивелировать фармакоэкономические преимущества дженериков перед оригинальными препаратами. Так, к примеру, ежегодно около 20 тыс. случаев госпитализаций в США и Канаде являются последствием замены оригинального амиодарона на его копии. При этом расходы, связанные с данными дополнительными госпитализациями, могут значительно превышать суммы, сэкономленные при закупке дженериков. К 2018 г. в России зарегистрировано уже более 20 дженерических препаратов бисопролола: Арител, Бидоп, Биол, Бипрол, Бисогамма, Бисомор, Корбис, Кординорм, Коронал и др. Эти препараты показали свою биоэквивалентность оригинальному бисопрололу (Конкор®, производитель — «Мерк КГаА», Германия). Однако отсутствует достоверная доказательная база терапевтической эквивалентности дженериков препарату Конкор®. И напротив, существует несколько доказательств, что данные препараты далеко не одинаковы по эффективности и безопасности и отличаются от оригинального бисопролола даже по фармакоэкономическим параметрам далеко не в лучшую сторону. Таким образом, несмотря на подтвержденную биоэквивалентность, оригинальные и воспроизведенные ЛП имеют целый ряд отличий не только в терапевтической эффективности, но и в фармакокинетике, обусловленных разницей в способе производства и составе вспомогательных веществ. Сами вспомогательные вещества, хотя и считаются фармакологически и химически инертными, тем не менее могут влиять на фармакодинамику и фармакокинетику ЛП за счет различий в скорости высвобождения вещества из лекарственной формы, изменения активности изоферментов CYР450 и влияния на элиминацию ЛП. Более того, в ряде случаев развития нежелательных реакций, которые возникают при применении воспроизведенных ЛП, можно избежать путем назначения оригинального ЛП, так как оригинальный препарат не содержит вспомогательных веществ, которые потенциально могли бы вызывать осложнения фармакотерапии. При этом следует отметить, что стоимость воспроизведенного ЛС ниже, чем оригинального, что определяется рядом причин. Для этого необходимо рассмотреть, из чего складывается стоимость оригинальных ЛС и дженериков. 80% стоимости оригинального ЛС составляет стоимость исследований эффективности и безопасности препарата, а 20% стоимости – это стоимость синтеза лекарственного вещества. Известно, что только 1 из 5 000 молекул доходит до рынка в виде ЛС Глава II 2. Примеры микронизированных субстанций Микронизированные субстанции глюкокортикостероидов широко используют в порошках и суспензиях для ингаляционной терапии заболеваний легких, так как частицы от 2 до 5 мкм лучше проникают в пораженные отделы респираторного тракта, обеспечивая более высокий процент респирабельной фракции активного вещества и соответственно его эффективность 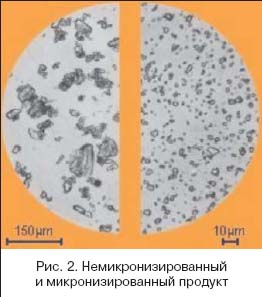 Микронизация частиц лекарства позволяет увеличить площадь всасывания, степень проникновения препарата в сосудистое русло в десятки раз. Так, в частности, по некоторым гормональным препаратам разница в площади всасывания между обычным и микронизированным веществом составляет 56 раз. Что собой представляет процесс микронизации? В результате физического воздействия на лекарственную субстанцию в условиях сохранения активности при оптимальной температуре и других параметрах производится процедура измельчения продукта. Количество частиц с заданным размером становится больше, уменьшается число частиц малого или чрезмерного диаметра. Непременно следует отметить, что производство высокотехнологичных продуктов, к числу которых относятся микронизированные формы, в обязательном порядке соответствует требованиям GMP Микронизация частиц лекарства позволяет увеличить площадь всасывания, степень проникновения препарата в сосудистое русло в десятки раз. Так, в частности, по некоторым гормональным препаратам разница в площади всасывания между обычным и микронизированным веществом составляет 56 раз. Что собой представляет процесс микронизации? В результате физического воздействия на лекарственную субстанцию в условиях сохранения активности при оптимальной температуре и других параметрах производится процедура измельчения продукта. Количество частиц с заданным размером становится больше, уменьшается число частиц малого или чрезмерного диаметра. Непременно следует отметить, что производство высокотехнологичных продуктов, к числу которых относятся микронизированные формы, в обязательном порядке соответствует требованиям GMP2.1 Топические глюкокортикостероиды Топические глюкокортикостероиды являются основным и практически безальтернативным методом наружной терапии многих дерматозов в силу способности подавлять активацию иммунной системы, ассоциированной с кожей. Для топических глюкокортикостероидов характерно повышение концентрации действующего вещества только в зоне воспалительного процесса, за счет чего не оказывается резорбтивного супрессорного воздействия на иммунную систему и не развиваются тяжелые побочные эффекты. Несмотря на очевидные преимущества топических препаратов, в ряде случаев приходится использовать системные глюкокортикостероиды. Как было отмечено ранее, одной из причин недостаточной эффективности топических глюкокортикостероидов является их недостаточная растворимость в жидкостях организма. Микронизация глюкокортикостероидов решает проблему растворимости. Благодаря микронизации топические глюкокортикостероиды легче и быстрее проникают к очагу воспаления. Доказано, что уменьшение размеров частиц гидрокортизона с 100–125 до 2–10 мкм увеличивает его высвобождение из мазей в три-четыре раза. Кроме того, микронизация действующего вещества, входящего в состав топических средств, повышает его устойчивость к ультрафиолетовому излучению. Одна из первых работ по эффективности дексаметазона в свободном виде и включенного в липидную эмульсию (микронизация) проведена K. Yokoyama и соавт. В ходе исследования установлено, что при индуцированном артрите и формировании гранулем противовоспалительное действие микронизированного дексаметазона в три – пять раз выше, чем таковое обычного дексаметазона.  2.2.1 - микронизированный Глибенкламид (Манинил) 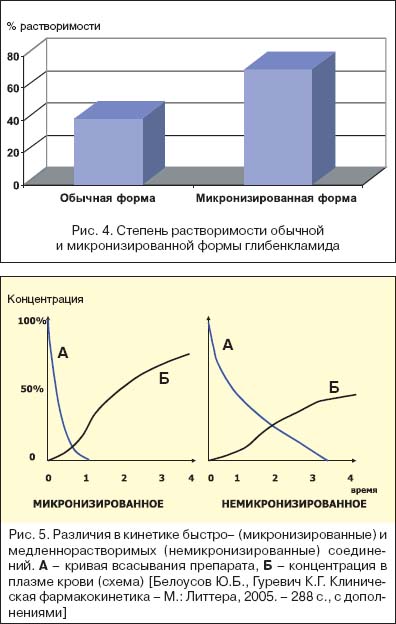 К сожалению, многие специалисты не знакомы с сутью произошедших технологических изменений в производстве, в частности, глибенкламида, и не видят принципиальных преимуществ, которые может дать новая его лекарственная форма. О чем же идет речь? Одной из трудно решаемых задач фармации и клинической фармакологии является создание оптимальных условий для абсорбции (всасывания) препарата, принимаемого внутрь. От этого зависит и скорость наступления эффекта, и установление максимальной концентрации (во временном и абсолютном значении), и ряд других факторов. Особое значение эти данные приобретают в случае использования средств с сахароснижающим эффектом – необходимо предотвращение гипогликемий, обеспечение безопасного приема в течение длительного времени и т. д. К сожалению, многие специалисты не знакомы с сутью произошедших технологических изменений в производстве, в частности, глибенкламида, и не видят принципиальных преимуществ, которые может дать новая его лекарственная форма. О чем же идет речь? Одной из трудно решаемых задач фармации и клинической фармакологии является создание оптимальных условий для абсорбции (всасывания) препарата, принимаемого внутрь. От этого зависит и скорость наступления эффекта, и установление максимальной концентрации (во временном и абсолютном значении), и ряд других факторов. Особое значение эти данные приобретают в случае использования средств с сахароснижающим эффектом – необходимо предотвращение гипогликемий, обеспечение безопасного приема в течение длительного времени и т. д. Глибенкламид (слабая кислота) относится к трудно растворимым в воде лекарственным веществам, степень абсорбции которых зависит от степени дисперсии в жидкостях интестинального тракта. В 1 л воды растворяется всего 4 мг, а степень гидрофобности – 4,85 – может быть оценена как высокая. Имеется много аналитических работ, посвященных технологии, контролю качества микронизированного глибенкламида (Манинил). Обычный кристаллический глибенкламид, производимый в различных странах, имеет максимальное растворение на уровне чуть более 40%. С помощью выверенной микронизации степень растворимости можно увеличить в 1,7 раза, а следовательно, и обеспечить лучшие условия для всасывания глибенкламида в кишечнике. Становится возможным назначить меньшую дозу, оставляя за собой право на повышение дозировки при необходимости. Более «компактные» условия для всасывания глибенкламида позволяют обеспечить более четкий режим питания и еще больше понизить относительный риск гипогликемических состояний. Фармакокинетическое моделирование может свидетельствовать о том, что при использовании форм с дополнительными преимуществами во всасывании, в т.ч. микронизированных, не только возрастают концентрации препаратов в крови, но и существенно приближается время наступления эффекта. Более полному растворению микронизированного глибенкламида в составе Манинила способствует наличие особого носителя метилгидро-ксиэтилцеллюлозы. Эта добавка индифферентна для организма, зато позволяет существенно увеличить дисперсную фазу препарата и расширить площадь всасывания глибенкламида. Целлюлоза акцептирует на себе большое количество пристеночной воды в кишечнике, создавая оптимальные условия для растворения микрокристаллов глибенкламида. Концентрация препарата в плазме крови возрастает в 3–5 раз, а содержание глюкозы снижается более эффективно (рис. 6), что дает возможность уменьшить содержание лекарственного вещества в единице лекарственной формы по сравнению со стандартной таблеткой. Имеется прочная коррелятивная связь (r=0,92) между степенью растворимости микронизированного глибенкламида в микроцеллюлозной среде и уровнем гликемии после приема препарата. Сходные результаты получены при использовании в качестве носителя глибенкламида особых липосомальных пузырьковых структур. Однако технология изготовления препаратов на липосомах пока остается достаточно затратной и в случае с глибенкламидом, имеющим малую стоимость, приводит к неоправданному удорожанию конечной лекарственной формы. Поэтому микронизация остается на данный момент наиболее оптимальной с точки зрения затратной эффективности. 2.2 Полимерные технологии Полимерные технологии в настоящее время используются в различных сферах, в том числе и для того, чтобы обеспечить направленное высвобождение лекарственного препарата в надлежащей дозе. Одним из примеров является таблетированная форма с перфорированным покрытием, через которое осуществляется постоянное высвобождение действующего вещества на протяжении 24-х часов, в результате чего пациенту нет необходимости повторно принимать таблетки. Во время производственного процесса с помощью лазера прожигается отверстие с точно заданным размером (диаметр составляет 0,3 мм) в оболочке таблетки, которая является водопроницаемой, но не водорастворимой полимерной мембраной. Ядро таблетки разделено на два слоя, один из которых содержит действующее вещество, а другое – компонент, способствующий набуханию. При попадании в желудочно-кишечный тракт такая таблетированная форма абсорбирует воду, в которой растворяется действующее вещество, в результате чего таблетка набухает. В результате этого внутри нее создается осмотическое давление, вследствие которого растворенное действующее вещество стабильно высвобождается с постоянной скоростью через отверстие в оболочке таблетки. 2.3 Примеры запатентованной инновацианных ЛП К запатентованной инновации относятся препараты, находящиеся под защитой действующего патента («Престанс», «Вальдоксан» и т.п.). В последние годы объем российского рынка инновационных препаратов возрастет в среднем до 10% в год. Второй вид — брендированная инновация — включает в себя препараты, первыми появившиеся с оригинальной формулой и составом на рынке конкретной страны («Но-шпа», «Супрастин» и др.); случается, что первым на рынок выходит не сам оригинальный препарат, а его дженерик («АЦЦ» на фармацевтический рынок России вышло раньше, чем оригинальный препарат — «Флуимуцил»). Третий вид — инновационная стратегия, представляет препараты, вобравшие в себя различные изменения. Они могут проявляться в составе, форме выпуска, дозировании, введении и т.д. Пример — появление «Престариума» 5 мг, вместо «Престариума» 4 мг. Пример — запуск в 2001 году новой формы: Предуктал МВ 35 мг с 2-х разовым приемом в сутки, вместо Предуктал 20 мг с 3-х разовым приемом; — создание новой фармацевтической формы оригинального лекарственного препарата. Пример — форма Эреспала-сироп, появившаяся в дополнение к форме Эреспал-таблетки; — выявление новых показаний и новых областей применения оригинального лекарственного препарата в результате проведения дополнительных клинических испытаний. Пример — появление нового показания у Кораксана — ХСН после проведения исследования Shift; — расширение применения лекарственного препарата другими возрастными группами (например, создание новой формы оригинального лекарственного препарата для лечения детей); — модификация упаковки лекарственного препарата (более характерно для безрецептурных лекарственных препаратов). Пример — новая упаковка Престариума, появившаяся в 2009 году, связанная с переходом на новую формулу соль периндоприл-аргинин, вместо периндоприл-третбутиламин; — перевод оригинального лекарственного препарата из рецептурной в безрецептурную категорию отпуска. Пример — Биопарокс, ставший безрецептурным в 2011 году. Пример — Оригинальный ЛП моксонидин (Физиотенз®) является гипотензивным препаратом центрального действия. Моксонидин селективно стимулирует имидазолин-чувствительные рецепторы в стволовых структурах мозга, принимающие участие в тонической и рефлекторной регуляции симпатической нервной системы, приводя к снижению системного сосудистого сопротивления и артериального давления (АД). На сегодняшний день в России помимо оригинального ЛП моксонидина зарегистрировано еще 15 средств с данным действующим веществом. В.В. Руксин и соавт. сравнили эффективность, безопасность и время наступления антигипертензивного эффекта оригинального моксонидина и двух его дженериков у пациентов с нежизнеугрожающей артериальной гипертензией при оказании скорой медицинской помощи. Было выявлено, что все 3 ЛП могут эффективно и безопасно применяться для снижения АД, однако оригинальный препарат имеет большую антигипертензивную эффективность и при его применении требуется меньше времени для достижения терапевтического эффекта по сравнению с дженериками. На основании полученных данных авторами был сделан вывод о том, что именно оригинальный моксонидин является антигипертензивным препаратом выбора как в работе выездных бригад скорой медицинской помощи, так и при оказании самопомощи (принцип «таблетка в кармане»). 2.4 Вспомогательные вещества как потенциальные причины развития нежелательных реакцийВажно отметить, что наличие в составе дженериков вспомогательных веществ, которые отсутствуют в оригинальном препарате, может приводить к развитию серьезных осложнений фармакотерапии — например, аллергических реакций. Проведенный поиск литературы не выявил описания клинических случаев с ЛП, содержащими моксонидин, которые бы наглядно демонстрировали эту точку зрения, однако была найдена публикация M. Greenhawt et al., описывающая случай анафилаксии (отек глаз, зуд в области лица) через 90 мин после приема воспроизведенного азитромицина у 47-летней женщины с анамнезом бронхиальной астмы и аллергии на карминовый краситель в составе пищевых продуктов (малиновый йогурт красного цвета, тортеллини красного цвета) и косметических средств красного цвета. Оригинальный азитромицин, в отличие от воспроизведенного, не имел в составе кармина, а потому для верификации нежелательной реакции и уточнения возможности дальнейшего применения данного антибактериального средства у конкретной пациентки авторами статьи были выполнены кожные пробы с кармином, чистым азитромицином без оболочки и отдельно с оболочкой каждого из производителей. Было выявлено, что пациентка имела выраженную положительную реакцию на чистый кармин и оболочку воспроизведенного азитромицина, в состав которой также входил кармин. Представленное клиническое наблюдение крайне интересно не только тем, что именно вспомогательное вещество, входящее в состав оболочки ЛП в крайне небольшом количестве, а не активное вещество, вызвало серьезную, жизнеугрожающую нежелательную реакцию, но также и тем, что пациентке, несмотря на установленную ранее аллергию на кармин, был назначен лекарственный препарат, содержащий это вещество. Если бы специалисты здравоохранения и сама женщина были более внимательны, этого осложнения можно было бы избежать, применяя оригинальный препарат, который не содержит в своем составе кармин. В таблице 2 систематизированы данные о рисках развития осложнений, ассоциированных с применением некоторых часто используемых в фармацевтической отрасли вспомогательных веществ, полученные из открытых литературных источников и специализированных баз данных. 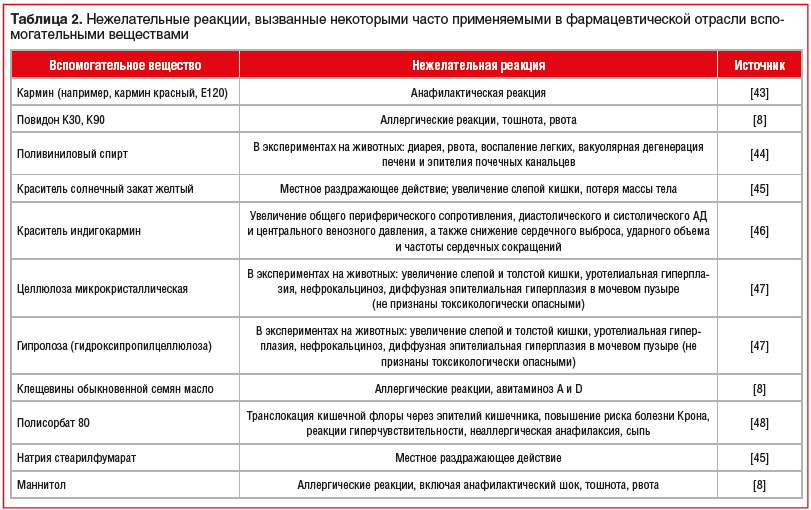 Наличие данных вспомогательных веществ в составе воспроизведенных препаратов моксонидина может быть ассоциировано с риском развития осложнений. Лечащий врач и пациент могут расценить их как осложнение от применения активного вещества и отказаться от применения эффективного антигипертензивного средства. Однако терапия может быть продолжена при условии доказанной причинно-следственной связи между осложнением фармакотерапии и конкретным вспомогательным веществом и назначения оригинального ЛП, в составе которого оно отсутствует. Заключение. Мировой опыт свидетельствует, что увеличение роли инноваций ведет к обеспечению динамичного развития и устойчивого положения предприятий на рынках выпускаемой продукции, повышению конкурентоспособности продукции, производств и экономики в целом. По всему миру фармацевтическая и медицинская промышленность переходит на инновационную модель развития, которая должна отвечать современным социально-экономическим условиям и задачам на перспективу. Именно инновации стоят за наиболее выдающимися достижениями в фармацевтической индустрии. Благодаря развитию фармацевтической отрасли увеличилась длительность жизни населения, качество медицинского обслуживания, что в целом благотворно сказывается на состоянии общества. Инновационное развитие отрасли имеет такие характерные особенности, как высокая капиталоемкость, значительный период окупаемости инвестиций, высокая степень риска ее осуществления. Несмотря на определенные проблемы, дальнейшее инновационное развитие фармацевтической отрасли просто необходимо. Развитие отрасли стимулирует экономический рост, потому как фармацевтические инновации создают рабочие места, подталкивают развитие технологий и являются важным источником дохода. К сожалению, доступ к передовым медицинским достижениям ограничен. Огромная диспропорция благосостояния в мире и бедность некоторых стран означают, что для многих людей даже простейшая медицинская помощь является недоступной. Решение этих проблем представляет собой комплексную задачу, которая потребует долгосрочных усилий от правительств, гражданского сообщества и частного сектора. Литература 1. Клунко, Н. С. Актуальные вопросы стратегического управления инновациями в фармацевтической отрасли РФ / Н. С. Клунко // Мир современной науки. – 2011. – № 4. – С. 45–51. 2. Колосова, Т. В. Управление инновационным развитием предприятия и проблемы конкурентоспособности / Т. В. Колосова. // Проблемы современной экономики. – 2010. – № 2. – С. 46–50 2. Фармацевтическая промышленность и глобальное здравоохранение: факты и цифры / Исследование AIPM. – М., 2012. 4. European Commission. 2010. «EC Joint Research Centre’s 2010 Scoreboard presentation from 17/11/2010», slide 15–16. 3 Статья - "ЭФФЕКТИВНАЯ ФАРМАКОТЕРАПИЯ. Кардиология и Ангиология" № 1 https://umedp.ru/articles/vozmozhnosti_moksonidina_v_lechenii_arterialnoy_gipertonii_i_ee_oslozhneniy.html 3. Мальцев В.И., Ефимцева Т.К., Белоусов Ю.Б., Коваленко В.Н. (ред.) Клинические испытания лекарств. – Киев, 2002. – 352 с. МОРИОН. 4. DiMasi J., Hansen R., Grabovski H. The price of innovation: new estimates of drug development costs. J. Health Econ. 2003, 22, 151-85. 5. Lloyd I. The R @ D revolution remains elusive. SCRIP Magazine, February 2004, 52-3. 6. Fontanarosa P., Renni D., DeAngelis D. Postmarketing survelliance-lack of vigalance, lack of trust. JAMA., 2004, 292, 2647-50. 7. Achikkadilis B., Antonakis N. The dinamics of economic innovation. Research policy 2001, 30, 535-88. 8. http://www.pharma2020.ru/strategy.html . |
