Ковид фарма. ковид фарма курсовая итог. Документа
 Скачать 65.74 Kb. Скачать 65.74 Kb.
|
  [Название документа] [Подзаголовок документа] User ОглавлениеВведение 2 1. Противовирусные препараты 3 1.1.Ремдесивир 3 1.2.Фавипиравир 5 1.3.Молнупиравир 7 1.4.PF-07321332 (Paxlovid ® , Pfizer) 9 2. Плазма реконвалесцента и вв иммуноглобулины 11 3. Моноклональные антитела 12 5. Роль кортикостероидов в лечении тяжелых covid-19 16 6. Другие иммуномодулирующие препараты 26 Выводы 28 Список литературы 29 ВведениеАктуальность: С созданием полезных вакцин против COVID-19, эффективность которых необычайно высока, но не абсолютна, и с учетом возможности того, что новые варианты вируса могут ограничить его эффективность, уместно переключить наше внимание с профилактических на терапевтические. сфера. Кроме того, остается большое количество непривитых. Методы лечения заболевания начинают приносить объективные и значительные плоды как в области прямой противовирусной терапии, так и в области противовоспалительного и иммунотерапевтического лечения. Хорошим примером этого является изменение положения моноклональных антител или представление новых эффективных противовирусных средств, которые можно вводить перорально. Цель работы: всестороннее изучение группы лекарственных средств, используемых для лечения коронавирусной инфекции. Задачи исследования: проанализировать механизм действия охарактеризовать фармакологические эффекты изучаемой группы препаратов выявить области применения, а также ограничения к применению рассмотреть принципы терапии 1. Противовирусные препаратыПри заболевании вирусной этиологии с некоторыми очень агрессивными и быстро развивающимися формами логично, что медикаментозные методы лечения с противовирусной активностью стали применяться рано и в определенной степени без разбора, с самого начала пандемии. Мы ограничимся здесь перечислением тех, которые показали некоторую эффективность в клинических испытаниях или кажутся очень многообещающими в этом отношении. Ремдесивир Ремдесивир представляет собой пролекарство в форме монофосфата, которое метаболизируется до активного аденозинтрифосфата. Он ингибирует репликацию нескольких семейств РНК-содержащих вирусов, в том числе коронавирусов. Этот препарат изучался против вирусов Эбола и Марбург, и клинические испытания при инфекции SARS-CoV-2 начались. Доклинические данные показали, что раннее лечение может снизить вирусную нагрузку, уменьшить повреждение легких и улучшить выживаемость. В качестве аналога аденозиннуклеозидтрифосфата (GS - 443902) активный метаболит ремдесивира препятствует действию вирусной РНК-зависимой РНК-полимеразы и уклоняется от проверки вирусной экзорибонуклеазой (ExoN), вызывая снижение продукции вирусной РНК. В некоторых вирусах, таких как респираторно-синцитиальный вирус, он вызывает остановку РНК-зависимых РНК-полимераз, но его преобладающее действие (как в случае с Эболой) заключается в необратимом обрыве цепи. В отличие от многих других терминаторов цепи, это не опосредовано предотвращением добавления, непосредственно следующего за ним нуклеотида, а вместо этого происходит с задержкой, происходящей после добавления пяти дополнительных оснований к растущей цепи РНК. Для РНК-зависимой РНК-полимеразы MERS-CoV, SARS-CoV-1 и SARS-CoV-2 остановка синтеза РНК происходит после включения трех дополнительных нуклеотидов. Следовательно, ремдесивир классифицируется как противовирусный агент прямого действия, который работает как терминатор цепи с задержкой. Наиболее частыми побочными эффектами у людей, получавших ремдесивир, были дыхательная недостаточность и биомаркеры крови с поражением органов, включая низкий уровень альбумина, низкий уровень калия, низкий уровень эритроцитов, низкий уровень тромбоцитов и повышенный билирубин (желтуха). Другие зарегистрированные побочные эффекты включают желудочно-кишечные расстройства, повышенный уровень трансаминаз в крови (энзимы печени), реакции в месте инфузии и нарушения электрокардиограммы. Ремдесивир может вызывать реакции, связанные с инфузией, включая низкое давление, тошноту, рвоту, потливость или озноб. Ремдесивир, по крайней мере, частично метаболизируется ферментами цитохрома P450 CYP2C8, CYP2D6 и CYP3A4. Ожидается, что концентрация ремдесивира в плазме крови снизится, если его вводить вместе с индукторами цитохрома P450, такими как рифампицин, карбамазепин, фенобарбитал, фенитоин, примидон и зверобой. Использование хлорохина или гидроксихлорохина с ремдесивиром может снизить противовирусную активность ремдесивира. Совместное введение ремдесивира и хлорохина фосфата или гидроксихлорохина сульфата не рекомендуется на основании данных in vitro, демонстрирующих антагонистический эффект хлорохина на активацию внутриклеточного метаболизма и противовирусную активность ремдесивира. На сегодняшний день, несмотря на то, что препарат был одобрен FDA и EMA для тяжелых пациентов, результаты нельзя считать однозначно окончательными, поскольку некоторые клинические испытания показали противоречивые результаты Недавние исследования показали снижение комбинированной конечной точки госпитализации, связанной с COVID, и смерти от всех причин на 87% у амбулаторных пациентов с высоким риском прогрессирования, получавших ремдесивир в течение 3 дней. Фавипиравир Фавипиравир является нуклеозидным, пролекарством, противовирусным препаратом широкого спектра действия, РНК-зависимым, РНК-полимеразозависимым противовирусным препаратом, который уже применялся для лечения гриппа и изучался против SARS-CoV-2, предпочтительно в Японии и других азиатских странах. В ткани молекула подвергается фосфорибозилированию до фавипиравира-RTP, который является активной формой этого препарата. Он оказывает противовирусное действие через следующие механизмы: Эта молекула действует как субстрат для фермента РНК-зависимой РНК-полимеразы (RdRp), который фермент ошибочно принимает за пуриновый нуклеотид, тем самым ингибируя его активность, что приводит к прекращению синтеза вирусного белка. Он встраивается в цепь вирусной РНК, предотвращая дальнейшее удлинение. Недавно было показано, что фавипиравир вызывает летальный мутагенез in vitro во время заражения вирусом гриппа, что делает его вирулицидным препаратом. Неясно, продемонстрирована ли подобная активность против SARS-CoV-2 или нет. Применеие Грипп: фавипиравир ингибирует 53 типа вирусов гриппа, включая сезонные штаммы A (H1N1), A (H3N2) и грипп B; пандемический вирус A (H1N1) pdm09; высокопатогенный вирус птичьего гриппа А (H5N1), выделенный от человека; A (H1N1) и A (H1N2), выделенные от свиней; и А (H2N2), А (H4N2) и А (H7N2). Он также активен в отношении лекарственно-устойчивых штаммов вируса, включая ингибиторы M2 и NA. Эбола: во время вспышки вируса Эбола в 2014 году фавипиравир был одним из препаратов, включенных в короткий список ВОЗ для испытаний. Хотя исследования in vitro показали обнадеживающие результаты для этого препарата, а клинические исследования показали тенденцию к повышению выживаемости убедительных доказательств пользы так и не было обнаружено. Активность в отношении других патогенных РНК-содержащих вирусов. В дополнение к активности в отношении вирусов гриппа и Эбола было обнаружено, что фавипиравир обладает терапевтической эффективностью в клеточных культурах и мышиных моделях аренавируса, буньявируса, филовируса, вируса Западного Нила, вируса желтой лихорадки, ящура и ящура. - вирус ротовой болезни и вирус Ласса, включая агенты, вызывающие вирусные геморрагические лихорадки и энцефалиты. Шеннон и др. обнаружили, что комплекс SARS-CoV-2-RDRp как минимум в 10 раз более активен, чем любой другой известный вирусный ингибитор РНК-зависимой РНК-полимеразы. Действие фавипиравира заключается в ингибировании этого вирусного фермента РЗРП, что позволяет фавипиравиру легко внедряться в вирусную РНК, не затрагивая ДНК человека. Они пришли к выводу, что аналоги нуклеозидов (такие как фавипиравир) являются многообещающими кандидатами для лечения COVID-19 Побочные эффекты/побочные эффекты Обсуждавшееся ранее японское исследование показало, что побочные реакции наблюдались примерно у 20% пациентов, получавших фавипиравир (в дозе ниже одобренной для лечения COVID-19). Побочные эффекты были относительно незначительными и включали гиперурикемию и диарею у 5% участников и снижение количества нейтрофилов и трансаминит у 2% участников. Одно исследование показало появление психических симптомов в связи с фавипиравиром. Влияние фавипиравира на удлинение интервала QTc все еще неясно, при этом некоторые фармакодинамические исследования указывают на положительную связь, но японское исследование предполагает обратное. В целом фавипиравир имеет хороший профиль безопасности, что было подтверждено большим систематическим обзором. Использование фавипиравира приводит к дозозависимой тенденции к увеличению гиперурикемии. Однако нет доказательств того, что гиперурикемия, вызванная фавипиравиром, приводит к клиническим проявлениям; однако для полной оценки этого риска потребуются более длительные периоды наблюдения. Имеются данные о том, что фавипиравир обладает тератогенным потенциалом и эмбриотоксичностью. Японское бюро по безопасности лекарственных средств утверждает, что фавипиравир следует строго предостерегать от использования у женщин репродуктивного возраста, и рекомендует меры предосторожности на упаковке и предупреждениях о назначении. Бюро также рекомендует избегать применения фавипиравира там, где можно использовать альтернативные препараты. Мужчин, прошедших это лечение, необходимо проинструктировать об эффективных методах контрацепции вовремя и в течение 7 дней после окончания лечения. Перед назначением фавипиравира женщинам детородного возраста необходимо обязательно исключить беременность при отрицательном тесте мочи на беременность. Молнупиравир Молнупиравир — противовирусный препарат, подавляющий репликацию некоторых РНК-содержащих вирусов. Он используется для лечения COVID-19 у лиц, инфицированных SARS-CoV-2. Молнупиравир является пролекарством синтетического производного нуклеозида N 4 -гидроксицитидина и оказывает противовирусное действие за счет внесения ошибок копирования во время репликации вирусной РНК. Молнупиравир был первоначально разработан для лечения гриппа в Университете Эмори университетской фармацевтической инновационной компанией Drug Innovation Ventures at Emory (DRIVE), но, как сообщается, от него отказались из-за проблем с мутагенностью. Затем он был приобретен базирующейся в Майами компанией Ridgeback Biotherapys , которая позже стала партнером Merck & Co. для дальнейшей разработки препарата. Молнупиравир показан для лечения коронавирусной болезни легкой и средней степени тяжести (COVID-19) у взрослых с положительными результатами прямого тестирования на вирус SARS-CoV-2 и с высоким риском прогрессирования COVID-19 в тяжелую форму. Использование во время беременности не рекомендуется. Нет данных об использовании во время беременности для оценки риска неблагоприятных исходов для матери или плода. На основании данных о животных предполагается, что препарат может нанести вред плоду. У крыс после многократного введения наблюдалась токсичность для костей и хрящей. Побочные реакции, наблюдаемые в исследовании III фазы MOVE-OUT, включали диарею (2%), тошноту (1%) и головокружение (1%), все из которых были легкими или умеренными. Механизм действия Молнупиравир ингибирует репродукцию вируса, способствуя широко распространенным мутациям в репликации вирусной РНК с помощью РНК-ориентированной РНК-полимеразы. Он метаболизируется в аналог рибонуклеозида, напоминающий цитидин , β - D - N4 - гидроксицитидин - 5'-трифосфат (также называемый EIDD-1931 5'-трифосфат или NHC-TP) .]Во время репликации фермент вируса включает NHC-TP во вновь созданную РНК вместо использования настоящего цитидина. 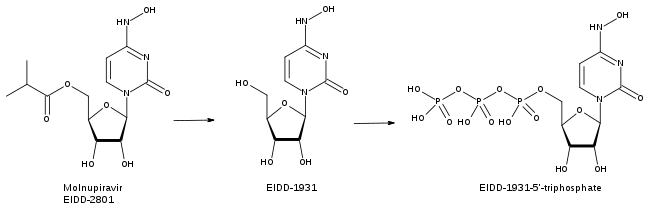 Молнупиравир может переключаться между двумя формами (таутомерами ), одна из которых имитирует цитидин (C), а другая имитирует уридин (U). NHC-TP не распознается как ошибка корректирующими экзонуклеазными ферментами вируса, которые могут заменять мутировавшие нуклеотиды исправленными версиями. Когда вирусная РНК-полимераза пытается скопировать РНК, содержащую молнупиравир, она иногда интерпретирует ее как C, а иногда как U. Это вызывает больше мутаций во всех последующих копиях, чем вирус может выжить, эффект, называемый вирусной ошибка катастрофа или летальный мутагенез. PF-07321332 (Paxlovid ® , Pfizer) Paxlovid ® , Pfizer представляет собой усиленный ритонавиром ингибитор протеазы, который снижает риск госпитализации или смерти у 90% пациентов с заболеванием легкой и средней степени тяжести. PF-07321332 нацеливается на основную протеазу (Mpro) SARSCOV-2, которая процессирует два полипротеина по крайней мере через 11 сайтов расщепления. Аминокислотная последовательность и трехмерная структура Mpro высококонсервативны во всем подсемействе Coronavirinae, что обеспечивает прочную основу для разработки терапевтических средств, нацеленных на потенциально уклоняющиеся от иммунитета варианты SARSCoV-2. Компания Pfizer только что объявила на пресс-конференции, что ее продукт Paxlovid® ( PF-07321332 + ритонавир) снижает риск госпитализации или смерти на 89% по сравнению с плацебо у взрослых, не госпитализированных, но с высоким риском неблагоприятного исхода по завершении исследования. исследование EPIC (этап 2/3). Данные будут переданы в FDA США для получения разрешения на использование в чрезвычайных ситуациях (EUA) как можно скорее . У пациентов, получавших лечение в течение 3 дней после появления симптомов (первичная конечная точка); 0,8% пациентов, получавших Паксловид®потребовалась госпитализация в первые 28 дней (3/389 госпитализировано, без летальных исходов) по сравнению с 7,0% пациентов, получавших плацебо (27/385 госпитализировано с 7 последующими смертельными исходами). Первичный анализ промежуточного набора данных оценил 1219 взрослых, зарегистрированных до 29 сентября 2021 г. На момент принятия решения о прекращении набора пациентов число пациентов составляло 70% от запланированных 3000 пациентов. Нежелательные явления, возникшие во время лечения, были сравнимы между Паксловидом® (19%) и плацебо (21%), большинство из них были легкой степени тяжести. 2. Плазма реконвалесцента и вв иммуноглобулиныИммуноглобулины и реконвалесцентная плазма (КП) получают от лиц, переболевших COVID-19. Поскольку первичный иммунный ответ хозяина появляется через 10–14 дней после заражения, плазму следует собирать у доноров не ранее, чем через вторую или третью неделю после заражения SARS-CoV-2. Плазма обеспечит пассивный иммунитет на основе антител и, следовательно, может уменьшить как тяжесть, так и продолжительность заболевания, поэтому она может быть показана госпитализированным пациентам и с особым интересом к пациентам с иммуносупрессией и недостаточной выработкой антител. В качестве продукта человеческой крови он может вызывать те же реакции, что и переливание (аллергические и анафилактические реакции, гемолиз, перегрузка жидкостью и т. д.), но исследования постоянно показывают, что переливание плазмы безопасно и имеет эффекты, сходные с эффектами обычных переливаний. Однако, несмотря на обоснованность его применения, опыт других вирусных эпидемий и его безопасность, до сих пор нет четких результатов с точки зрения эффективности. Его начали использовать при COVID-19 средней и тяжелой степени после публикации обсервационных исследований и клинических испытаний с систематическими обзорами и метаанализами, которые дали неубедительные результаты. 3. Моноклональные антителаВ последнее время мир моноклональных антител и данные об их активности получили очень большое развитие, и мы считаем, что они представляют большой интерес. Антитела нацелены на определенный антиген на поверхности клетки с помощью связывания антитело-антиген; и моноклональное означает, что каждое антитело вырабатывается из конкретной линии В-клеток, состоящей из идентичных В-клеток. Моноклональные антитела используются для лечения рака и различных аутоиммунных заболеваний, таких как рассеянный склероз и ревматоидный артрит. А также при Covid-19. Моноклональные антитела легко идентифицировать, потому что все они оканчиваются на -маб. Примеры включают трастузумаб, который можно использовать для лечения некоторых видов рака груди или желудка; а также ритуксимаб, который можно применять при хроническом лимфолейкозе и неходжкинской лимфоме; и инфликсимаб, который можно использовать для лечения воспалительных состояний, таких как определенные виды артрита или воспалительного заболевания кишечника. Моноклональные антитела вводят внутривенно. После введения они избирательно связываются со специфическим антигеном на поверхности клетки-мишени, а затем сигнализируют иммунной системе о необходимости его уничтожения. Вируснейтрализующим действием в отношении SARS-CoV-2 обладают искусственные моноклональные антитела (МКА). Рекомбинантные МКА человека класса IgG1, связываясь с неперекрывающимися эпитопами рецептор-связывающего домена S-белка, блокируют взаимодействие S-белка SARS-CoV-2 с ангиотензинпревращающим ферментом 2 (АПФ2), что приводит к подавлению инфицирования клеток хозяина и останавливает репликацию вируса. В настоящее время используются однокомпонентные (сотровимаб, регданвимаб), а также комбинированные (бамланивимаб+этесевимаб; касиривимаб+имдевимаб) препараты. В ноябре 2020 года Управление по санитарному надзору за качеством пищевых продуктов и медикаментов США или FDA выдало разрешение на экстренное использование, позволяющее назначать бамланивимаб или казиривимаб плюс имдевимаб амбулаторным пациентам с высоким риском серьезной инфекции, например, людям с раком, диабетом 2 типа, сердечной недостаточности. Бамланивимаб и казиривимаб плюс имдевимаб представляют собой моноклональные антитела, предназначенные для борьбы с COVID-19 путем предотвращения проникновения вируса в клетки-хозяева. Бамланивимаб и казиривимаб плюс имдевимаб не рекомендуются для госпитализированных пациентов, поскольку исследования показали, что это привести к осложнениям. Общие побочные эффекты моноклональных антител включают лихорадку, утомляемость, бессонницу и головную боль, а также сердечно-сосудистые реакции, такие как гипертония, приливы и отеки; дерматологические реакции, такие как сыпь, эксфолиативный дерматит и зуд; желудочно-кишечная токсичность, проявляющаяся тошнотой, диареей, болями в животе или стоматитом, а также боли в мышцах и суставах. Они также могут вызывать респираторные побочные эффекты, такие как кашель и одышка, а также гематологические нарушения, включая анемию, тромбоцитопению и лейкопению. И моноклональные антитела следует использовать с осторожностью: у пожилых людей; во время беременности или кормления грудью; и у людей с почечной недостаточностью. Кроме того, активные инфекции следует лечить до начала терапии моноклональными антителами, чтобы предотвратить обострения Сотровимаб. Это рекомбинантное сконструированное гуманизированное моноклональное антитело (IgG), которое с высокой аффинностью связывается с высококонсервативным эпитопом в рецептор-связывающем домене (RBD) S-белка (шипа) SARSCoV-2. Точный механизм его действия не совсем ясен, но, по-видимому, он предотвращает слияние после того, как вирус связывается с человеческим рецептором ангиотензин-2-превращающего фермента (ACE 2). Исследование COMET продемонстрировало, что внутримышечное введение сотровимаба не уступает по эффективности внутривенному введению в популяции с высоким риском неблагоприятного исхода. В/м введение может облегчить его введение в первичной медико-санитарной помощи. Бамланивимаб + этесевимаб. В ноябре 2020 года нейтрализующее IgG1 моноклональное антитело бамланивимаб (LYCoV555; Lilly) получило разрешение FDA на экстренное использование (EUA) для лечения, недавно диагностированного COVID-19 легкой и средней степени тяжести у пациентов в возрасте 12 лет и старше, масса тела которых равна или более 40 кг, в хорошем исходном состоянии, но с высоким риском прогрессирования заболевания в тяжелую форму или с необходимостью госпитализации Бамланивимаб и этесевимаб следует вводить как можно скорее после положительного результата теста на SARS-CoV-2 и в течение 10 дней после появления симптомов COVID-19. Пациентов следует лечить в учреждении, укомплектованном персоналом и оборудованном для лечения анафилаксии, и следует контролировать реакции гиперчувствительности во время введения препарата и в течение как минимум 1 часа после завершения инфузии. Таблица 1 Иммуномодулирующие препараты, исследуемые при лечении COVID-19.
5. Роль кортикостероидов в лечении тяжелых covid-19Использование дексаметазона рекомендуется у пациентов с COVID-19 в критическом состоянии, которым требуется оксигенотерапия или искусственная вентиляция легких. Рекомендуемая доза составляет 6 мг в сутки в течение 10 дней или до выписки из стационара. Сравнение 12 мг дексаметазона в день с 6 мг не показало различий в результатах в отношении эффективности (выживаемость без жизнеобеспечения в течение 28 дней) и безопасности у наиболее тяжелобольных пациентов. Если дексаметазон недоступен, можно рассмотреть возможность применения других глюкокортикоидов в эквивалентных дозах (общая суточная доза гидрокортизона 160 мг, метилпреднизолона 32 мг или преднизона 40 мг), хотя данные, подтверждающие использование этих альтернатив, более ограничены, чем данные для дексаметазона. Напротив, использование дексаметазона (или других глюкокортикоидов) не рекомендуется для профилактики или лечения COVID-19 легкой и средней степени тяжести (пациенты, не получающие кислород). Всемирная организация здравоохранения (ВОЗ) установила две рекомендации относительно использования кортикостероидов у пациентов с COVID-19: Назначение системных кортикостероидов вместо их отсутствия для лечения тяжелых и критически больных пациентов (сильная рекомендация, основанная на доказательствах средней степени достоверности). Воздержание от использования кортикостероидов при лечении некритических пациентов с COVID-19 (условная рекомендация, основанная на доказательствах с низким уровнем достоверности). Использование кортикостероидов при персистирующей интерстициальной болезни легких COVID-19 показало преимущества в некоторых сериях наблюдений, но для подтверждения этих результатов необходимы клинические испытания. Глюкокортикоиды представляют собой группу стероидных гормонов , которые секретируются двумя надпочечниками , расположенными наподобие шапок, по одной на каждой почке. Каждый из них имеет внутренний слой, называемый мозговым веществом, и внешний слой, называемый корой. Кора надпочечников секретирует различные кортикостероидные гормоны: подобные глюкокортикоидам под контролем адренокортикотропного гормона , или АКТГ. В норме гипоталамус , расположенный в основании головного мозга, секретирует кортикотропин - рилизинг-гормон, известный как КРГ, который стимулирует переднюю долю гипофиза к секреции адренокортикотропного гормона , известного как АКТГ. Затем АКТГ попадает в пару надпочечников и связывается с рецепторами АКТГ на клетках коры надпочечников. Это заставляет клетки коры надпочечников высвобождать глюкокортикоиды из пучковой зоны, которые обладают мощным противовоспалительным и метаболическим действием. Эти глюкокортикоиды имеют отрицательный эффект обратной связи на гипоталамо-гипофизарно-надпочечниковую ось, что означает, что избыток кортикостероидов подавляет выброс как КРГ, так и АКТГ в кровоток. Теперь, после образования, глюкокортикоиды попадают в кровообращение и через кровь достигают клеток-мишеней. Стероиды представляют собой липофильные молекулы, поэтому они пересекают клеточную мембрану , проникают внутрь клетки и связываются с цитоплазматическим рецепторным белком, называемым «глюкокортикоидным рецептором». Теперь этот « глюкокортикоид - рецепторный комплекс» претерпевает некоторые структурные изменения, которые позволяют им проникать внутрь ядра и связываться с « глюкокортикоидными ответными элементами» или GRE на хроматине. Теперь это вызывает транскрипцию специфической мРНК, которая используется для синтеза различных белков, что, в свою очередь, изменяет различные функции клеток и метаболические эффекты в организме . Наиболее важным глюкокортикоидом для человека является кортизол , и он обычно высвобождается во время стресса , например, во время болезни или голодания. Кортизол помогает регулировать как иммунный ответ , так и клеточный метаболизм , такой как глюконеогенез . Что касается иммунного ответа , кортизол способствует общему противовоспалительному состоянию путем ингибирования двух основных продуктов воспаления — простагландинов и лейкотриенов, а также ингибирования продукции интерлейкина-2 лейкоцитами. Теперь, что касается клеточного метаболизма , кортизол способствует общему катаболическому воздействию на организм . В периферической жировой ткани кортизол запускает липолиз , то есть расщепление жиров на свободные жирные кислоты. В мышцах кортизол стимулирует протеолиз, то есть расщепление белков на аминокислоты. Часто эти свободные жирные кислоты и аминокислоты служат субстратом для глюконеогенеза — процесса, при котором клетки печени производят новые молекулы глюкозы из неуглеводных источников, таких как аминокислоты и свободные жирные кислоты. Высокий уровень кортизола также увеличивает резистентность к инсулину в тканях, а это означает, что инсулин становится менее эффективным при перемещении глюкозы в клетки, что приводит к повышению уровня глюкозы в крови . Повышенный уровень глюкозы также стимулирует высвобождение большего количества инсулина . И поскольку это похоже на то, что происходит у людей с диабетом , такое действие кортизола называют диабетогенным . Конечным результатом является то, что у нас в крови гораздо больше глюкозы, которую можно использовать в качестве топлива во время стресса ! Наконец, кортизол также играет роль в поддержании уровня артериального давления , поскольку он активирует альфа1- адренорецепторы в кровеносных сосудах, что вызывает сужение сосудов. Теперь давайте переключим передачу и сосредоточимся на синтетических глюкокортикоидах . Синтетические глюкокортикоиды в нашем организме производят тот же эффект, что и эндогенный кортизол ; но они также увеличивают количество нейтрофилов в крови! Скажем так. Глюкокортикоиды снижают выработку белка, который позволяет нейтрофилам прикрепляться к эндотелиальной выстилке кровеносных сосудов. В результате нейтрофилы отделяются от эндотелиальной выстилки и попадают в кровоток. Этот процесс также известен как «демаргинация». В то же время эти препараты также снижают количество лимфоцитов, моноцитов, базофилов , эозинофилов . Теперь, исходя из продолжительности действия, синтетические глюкокортикоиды можно разделить на три группы. К первой группе относятся глюкокортикоиды короткого действия с продолжительностью действия 8-12 часов. К этой группе относятся кортизон и гидрокортизон . Кортизон принимается перорально и в печени, требует преобразования в гидрокортизон , поэтому не активен при местном применении. С другой стороны, гидрокортизон химически идентичен кортизолу и может приниматься перорально, внутривенно или внутримышечно. Затем он попадает в кровообращение, достигает клеток-мишеней и очень быстро начинает действовать, но только в течение короткого промежутка времени. Вот почему гидрокортизон является препаратом выбора при острой надпочечниковой недостаточности . Гидрокортизон также доступен в формах для местного применения. Ко второй группе относятся глюкокортикоиды средней продолжительности действия с продолжительностью действия 12-36 часов. В эту группу попадают преднизолон , преднизолон , метилПРЕДНИзолон и триамцинолон . Преднизолон принимают перорально, а преднизолон применяют перорально, внутривенно и местно. Далее метилпреднизолон можно принимать перорально, внутривенно , внутримышечно или внутрисуставно; в то время как триамцинолон применяется перорально, внутримышечно, местно и внутрисуставно. По сравнению с глюкокортикоидами короткого действия глюкокортикоиды промежуточного действия почти в 4-5 раз более эффективны, что означает, что для получения желаемого ответа требуется меньшая доза. Наконец, в третью группу входят глюкокортикоиды пролонгированного действия с продолжительностью действия 36-72 часа. К этой группе относятся бетаметазон и дексаметазон , и их можно принимать перорально; вводят в вену, мышцу или сустав. Кроме того, дексаметазон можно применять местно. Наконец, эти препараты в 25 раз более эффективны, чем глюкокортикоиды короткого действия . В настоящее время клиническое применение глюкокортикоидов можно разделить на несколько групп. Во- первых, глюкокортикоиды используются для лечения заболеваний надпочечников , характеризующихся низким уровнем кортикостероидов в организме , таких как первичная надпочечниковая недостаточность , также известная как болезнь Аддисона . При болезни Аддисона основная проблема связана с повреждением самих надпочечников . Другим заболеванием является врожденная гиперплазия надпочечников , которая характеризуется генетическими дефектами, препятствующими синтезу специфических ферментов, вырабатывающих кортизол . Теперь для лечения этих состояний мы используем глюкокортикоиды короткого действия , которые в данном случае также называют физиологической заместительной терапией. Физиологическая заместительная терапия должна имитировать нормальный физиологический режим дня, а это означает, что утром люди должны получать наибольшую дозу, а во второй половине дня меньшую дозу. Кроме того, опасный для жизни надпочечниковый криз, известный также как аддисоновский криз или острая надпочечниковая недостаточность , лечится гидрокортизоном из-за его быстрого действия. Затем глюкокортикоиды используются в качестве противовоспалительной/ иммуносупрессивной терапии у лиц с астмой ; состояния с аутоиммунными и воспалительными компонентами, такие как ревматоидный артрит , болезнь Крона , язвенный колит , обострение острого рассеянного склероза и идиопатическая тромбоцитопеническая пурпура ; и при воспалительных состояниях кожи, глаз, ушей или носа, таких как экзема , аллергический конъюнктивит или ринит . Также эти препараты используются для лечения состояний повышенной чувствительности, таких как тяжелые аллергические реакции ; и предотвращения реакции «трансплантат против хозяина» . Затем у нас есть различные состояния, которые включают рвоту, вызванную химиотерапией, гиперкальциемию и горную болезнь . Кроме того, бетаметазон можно назначать беременным женщинам до рождения, чтобы ускорить созревание легких плода. Наконец, глюкокортикоиды используются при неопластических состояниях в качестве адъювантной терапии из-за их антилимфоцитарного эффекта, который характеризуется снижением клональной экспансии Т- и В-лимфоцитов . Это делает их эффективными при лечении гематопоэтических видов рака, таких как острый лимфоцитарный лейкоз , лимфома Ходжкина и неходжкинские лимфомы. Наконец, важно отметить, что дексаметазон обычно используется для уменьшения отека головного мозга у лиц с метастатическими или первичными опухолями головного мозга . Кроме того, дексаметазон является очень сильнодействующим лекарством и часто вызывает заметное подавление гипоталамо-гипофизарно-надпочечниковой системы, даже если его вводят в низкой дозе, что означает, что дексаметазон обеспечивает отрицательную обратную связь с гипофизом , что приводит к подавлению секреции АКТГ. Это, в свою очередь, снижает естественную выработку кортизола . В связи с этим он используется в тесте подавления дексаметазона на ночь , где он используется для диагностики наличия синдрома Кушинга . Синдром Кушинга — это эндокринное заболевание, вызванное чрезмерной выработкой кортизола . Это может быть вызвано болезнью Кушинга, когда аденома гипофиза избыточно вырабатывает АКТГ. Симптомы включают ожирение, когда дополнительная жировая ткань имеет тенденцию накапливаться между плечами, что приводит к буйволиному горбу ; в туловище, вызывая туловищное ожирение; и на лице, вызывая лунное выражение лица. Гипергликемия и диабет часто возникают в результате повышенного глюконеогенеза и резистентности к инсулину. Мышечная слабость и растяжки на коже могут возникать из-за распада белка. Гипертония , остеопороз и повышенный риск бактериальных и грибковых инфекций также являются распространенными проблемами, вызванными избытком кортизола . Теперь, когда у человека подозревают синдром Кушинга , ему дают низкую дозу дексаметазона , который подавляет выработку АКТГ в гипофизе . В норме это должно вызывать снижение уровня кортизола в сыворотке , но если синдром Кушинга вызван эндогенной выработкой кортизола , то уровень кортизола должен оставаться неизменным. Высокий уровень кортизола определяет тест как положительный, что свидетельствует о наличии синдрома Кушинга . Побочные эффекты всех синтетических глюкокортикоидов редки при назначении для физиологической заместительной терапии, но риск увеличивается у лиц, получающих высокие дозы в течение длительного периода времени. Эти побочные эффекты очень похожи на синдром Кушинга , поскольку они действуют так же, как кортизол , вырабатываемый надпочечниками . Когда мы получаем эти симптомы извне, это называется ятрогенным синдромом Кушинга . Это на самом деле более распространено, чем обычный синдром Кушинга, поскольку глюкокортикоиды часто используются для лечения довольно распространенных состояний, таких как ревматоидный артрит и астма . Другие побочные эффекты включают нарушения жидкости и электролитов , такие как задержка жидкости, гипертензия и гипокалиемия ; эндокринные побочные эффекты, такие как гипергликемия, диабет и подавление гипоталамо-гипофизарно-надпочечниковой системы, что может привести к атрофии коры надпочечников. Далее, поскольку они вызывают иммуносупрессию , они связаны с повышенным риском инфицирования и нарушением заживления ран . Кроме того, глюкокортикоиды могут вызывать побочные эффекты со стороны опорно-двигательного аппарата, которые включают миопатию и аваскулярный некроз головок бедра и плечевой кости, а также остеопороз и патологические переломы, поскольку они снижают активность остеобластов и повышают активность остеокластов . Наконец, люди, получающие глюкокортикоиды , могут жаловаться на психические расстройства, такие как депрессия , бессонница , психоз и перепады настроения; но у них также могут развиться пептические язвы и катаракта . Также глюкокортикоиды вызывают торможение роста у детей. Теперь важно отметить, что люди, получающие длительную терапию глюкокортикоидами , должны получать дополнительные « стрессовые дозы» для предотвращения надпочечникового кризиса. « Стрессовые дозы» обычно используются до или после операции или во время тяжелой болезни. Кроме того, лица, получающие длительную терапию глюкокортикоидами , могут принимать удвоенную суточную дозу через день, чтобы предотвратить подавление гипоталамо - гипофизарно - надпочечниковой системы (ГГН) и возможную атрофию коры надпочечников. Этот способ лечения глюкокортикоидами также известен как терапия через день или короткая ADT. 6. Другие иммуномодулирующие препаратыПродукция цитокинов в ответ на репликацию вируса играет важную роль в повреждении легких, необходимости искусственной вентиляции легких и, в целом, в выживании пациентов с COVID-19. Это побудило к исследованию эффективности иммуномодулирующих препаратов, которые ограничивают эффекты, связанные с цитокинами. Демонстрация полезных эффектов кортикостероидов у пациентов с тяжелой пневмонией подкрепляет противовоспалительную / иммуномодулирующую терапию как способ лечения тяжелого заболевания. Исследуемые иммуномодулирующие препараты по механизму действия объединены в несколько семейств. Из них лишь немногие имеют достаточно данных, чтобы судить об их использовании при COVID-19. Интерлейкины — это крошечные сигнальные белки, похожие на интерфероны; они взаимодействуют между клетками, чтобы стимулировать клеточный иммунитет, ингибировать рост опухоли и увеличивать выработку тромбоцитов. Коронавирусную инфекцию можно лечить с помощью ингибиторов интерлейкина-6, таких как сарилумаб, тоцилизумаб и силтуксимаб. Исследователи выдвинули гипотезу, что блокирование воспалительных путей может предотвратить ухудшение симптомов COVID-19, поскольку у пациентов с тяжелыми симптомами COVID-19 часто повышены уровни в сыворотке маркеров воспаления, таких как IL-6, а также D-димера и ферритина. Однако чрезмерная стимуляция иммунной системы также может вызывать побочные эффекты. Интерфероны, например, все могут вызывать нейротоксичность, что приводит к побочным эффектам от головной боли и усталости до беспокойства, депрессии и, редко, суицидальных мыслей. Интерфероны также могут вызывать токсичность для желудочно-кишечного тракта, поэтому обычно могут возникать тошнота, рвота, диарея или боль в животе. Другие побочные эффекты включают лихорадку, реакции в месте инъекции, гриппоподобные симптомы, дерматологические побочные эффекты, такие как сыпь, зуд или алопеция, скелетно-мышечная боль, включая болезненность мышц и боль в суставах, а также усталость и потеря аппетита. Интерферон альфа 2b и пегинтерферон альфа 2а имеют предупреждение о том, что они вызывают или усугубляют опасные для жизни нейропсихиатрические, аутоиммунные, инфекционные и ишемические состояния. Интерлейкины имеют предупреждение о синдроме капиллярной утечки, который может вызвать тяжелую, опасную для жизни гипотензию и снижение перфузии органов. Другие побочные эффекты интерлейкинов включают токсичность для желудочно-кишечного тракта, лихорадку, одышку, кашель, сыпь и зуд, а также сердечные явления, такие как тахикардия, различные виды аритмии и отек. Что касается противопоказаний, то интерфероны и интерлейкины противопоказаны беременным и в период грудного вскармливания. Кроме того, интерфероны следует использовать с осторожностью у пациентов с ранее существовавшим заболеванием сердца, тяжелой почечной или печеночной недостаточностью, миелосупрессией или нарушением функции центральной нервной системы. Интерлейкины следует использовать с особой осторожностью у пациентов с сердечными аритмиями, нарушениями дыхания, почечной или печеночной недостаточностью. ВыводыРемдесивир, молнупиравир и PF-07321332 (Паксловид) — три противовирусных препарата с разными механизмами действия, которые продемонстрировали эффективность в клинических испытаниях в отношении разных маркеров прогрессирования заболевания. В настоящее время и после многих опубликованных данных реконвалесцентная плазма не может считаться терапией с установленной эффективностью у пациентов с COVID в любой из их клинических ситуаций. Существуют моноклональные антитела, как поступающие в продажу, так и находящиеся в процессе реализации, которые при введении на ранних стадиях естественного течения заболевания снижают прогрессирование заболевания до тяжелых форм. Некоторые исследуемые моноклональные антитела, если будет доказана их эффективность, могут быть введены профилактически и с длительным действием. Роль дексаметазона у тяжелых пациентов с COVID-19 хорошо известна. Альтернативная позиция других кортикостероидов в эквивалентных дозах менее ясна. Нет показаний для введения дексаметазона в менее тяжелых ситуациях. Существуют и другие иммуномодулирующие препараты с иной мишенью действия, которые уже имеют показания у больных с тяжелой пневмонией и дыхательной недостаточностью. Из уже известных препаратов с другими показаниями флувоксамин кажется особенно многообещающим в лечении COVID-19. В различных исследованиях было показано, что гидроксихлорохин, азитромицин и анти-ВИЧ комбинация лопинавира и ритонавира неэффективны и не используются в текущем лечении COVID-19. Исследования эффективности, безопасности и переносимости любого из вышеперечисленных препаратов у беременных женщин и детей ограничены. Список литературыСингх А.К., Сингх А., Сингх Р., Мишра А. Молнупиравир при COVID-19: систематический обзор литературы . Синдром метаболического диабета . 2021; 15 ( 6 ):102329. doi: 10.1016/j.dsx.2021.102329 Содани П., Муччи Л., Джиролиметти Р., Тедеско С., Монако Ф., Кампаноцци Д. и др. Успешное выздоровление от пневмонии, вызванной COVID-19, после приема барицитиниба, тоцилизумаба и ремдесивира. Отчет о клиническом случае: обзор методов лечения и клинической роли компьютерно-томографического анализа . Respir Med Case Rep . 2020; 31 :101115. doi: 10.1016/j.rmcr.2020.101115Фармакология [Электронный ресурс]: учебник / Д. А. Харкевич. – 11-е изд., испр. и доп. – М.: ГЭОТАР–Медиа, 2015. – http://www.studmedlib.ru/book/ISBN9785970434123.html. Дата обращения: 29.01.2018. Фармакология [Электронный ресурс]: учебник / под ред. Р.Н. Аляутдина. – 5-е изд., перераб. и доп. – Электрон. дан. – Москва: ГЭОТАР–Медиа, 2016. – URL: http://www.studmedlib.ru/book/ISBN9785970437339.html. Дата обращения: 29.01.2018 Машковский, М. Д. Лекарственные средства: пособие для врачей / М. Д. Машковский, науч. ред.: С. Д. Южаков. – Изд. 15-е, перераб., испр. и доп. – Москва: Новая Волна, 2008. – 1206 с Государственный реестр лекарственных средств. – Режим доступа: http://grls.rosminzdrav.ru/GRLS.aspx Холман В., Холман В., Макинтош С., Пейнтер В., Пейнтер Г., Буш Дж. и др.. Ускоренное первое клиническое испытание на людях EIDD-2801/MK-4482 (молнупиравир), аналога рибонуклеозида с мощным противовирусным действием. активность против SARS-CoV-2 . Zuo Z, Wu T, Pan L, Zuo C, Hu Y, Luo X и др.. Методы и механизмы лечения коронавирусной болезни, 2019 г. Фронт Фармакол . 2020; 11 :583914. doi: 10.3389/fphar.2020.583914. Авенданьо-Сола С., Рамос-Мартинес А., Муньес-Рубио Э., Руис-Анторан Б., Мало де Молина Р., Торрес Ф. и др. Многоцентровое рандомизированное открытое клиническое исследование реконвалесцентной плазмы у пациентов, госпитализированных с COVID -19 пневмония . Джей Клин Инвест . 2021. doi: 10.1172/jci152740. |
