Биохимия. ЭКЗАМЕНАЦИОННЫЕ ВОПРОСЫ ПО БИОЛОГИЧЕСКОЙ ХИМИИ. Экзаменационные вопросы по биологической химии для студентов лечебного, педиатрического и медикопрофилактического факультетов
 Скачать 6.22 Mb. Скачать 6.22 Mb.
|
|
Реакция активация метионина Активной формой метионина является S-аденозилметионин (SAM) - сульфониевая форма аминокислоты, образующаяся в результате присоединения метионина к молекуле аденозина. Аденозин образуется при гидролизе АТФ. Эту реакцию катализирует фермент метионин аденозилтрансфераза, присутствующий во всех типах клеток. Структура (-S+-CH3) в SAM - нестабильная группировка, определяющая высокую активность метильной группы (отсюда термин "активный метионин"). Эта реакция уникальна для биологических систем, так как, по-видимому, является единственной известной реакцией, в результате которой освобождаются все три фосфатных остатка АТФ. Отщепление метильной группы от SAM и перенос её на соединение-акцептор катализируют ферменты метилтрансферазы. SAM в ходе реакции превращается в S-аденозилгомоцистеин (SAT) Примеры реакций трансметилирования Синтез фосфатидилхолина из фосфатидилэтиноламина Фосфатидилхолины (лецитины) - наиболее распространённая группа глицерофосфолипидов, участвующих в образовании мембран клеток и липопротеинов, в составе которых осуществляется транспорт липидов 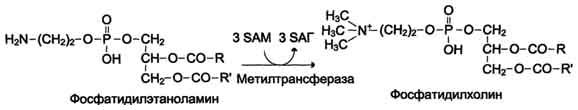 Синтез креатина.Креатин необходим для образования в мышцах высокоэнергетического соединения - кре-атинфосфата. Синтез креатина идёт в 2 стадии с участием 3 аминокислот: аргинина, глицина и метионина. В почкахобразуется гуанидинацетат при действии глицинамидинотрансферазы 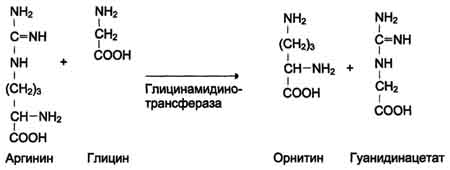 Затем гуанидинацетат транспортируется в печень,где происходит реакция его метилирования 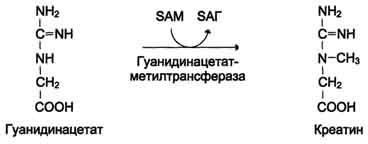 Креатин с кровотоком переносится в мышцы и клетки мозга,где из него образуется высокоэнергетическое соединение - креатинфосфат. Определение содержания креатина и креати-нина в крови и моче используется для характеристики интенсивности работы мышц в спортивной медицине и при некоторых патологических состояниях. Определение активности фермента креатинкиназы и его изоферментных форм в крови используется в медицине для диагностики таких заболеваний, как инфаркт миокарда, миопатии, мышечные дистрофии и др. Реакции трансметилирования используются также для: синтеза адреналина из норадреналина; синтеза анзерина из карнозина; метилирования азотистых оснований в нук-леотидах и др.; инактивации метаболитов (гормонов, медиаторов и др.) и обезвреживания чужеродных соединений, включая и лекарственные препараты. 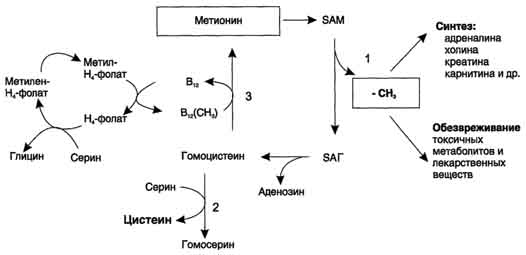 86. Метилирование ДНК. Представление о метилировании чужеродных и лекарственных соединений. Метилирование ДНК — это модификация молекулы ДНК без изменения самой нуклеотидной последовательности ДНК, что можно рассматривать как часть эпигенетическойсоставляющей генома. Метилирование ДНК заключается в присоединении метильной группы к цитозину в позиции С5 цитозинового кольца. У человека за процесс метилирования ДНК отвечают три фермента, называемые ДНК-метилтрансферазами 1, 3a и 3b (DNMT1, DNMT3a, DNMT3b), соответственно. Предполагается, что DNMT3a и DNMT3b — это de novo метилтрансферазы, которые осуществляют формирование паттерна метилирования ДНК на ранних стадиях развития, а также его изменения в процессе дифференцировки клеток. Существует гипотеза о том, что метилирование ДНК de novo вызывается, в частности, интерферирующими РНК при помощи РНК-зависимого метилирования ДНК — процесса, возникшего в ходе эволюции с целью репрессии мобильных элементов генома. DNMT1 является ДНК-метилтрансферазой, которая поддерживает метилированное состояние ДНК, присоединяя метильные группы к одной из цепей ДНК в точках, где другая, комплементарная ей цепь, метилирована. Белок DNMT3L гомологичен другим DNMT-белкам, но не имеет каталитической активности. Вместо этого, DNMT3L поддерживает de novo метилтрансферазы, способствуя связыванию этих ферментов с ДНК и стимулируя их активность. Метилирование. В организме метилированию могут подвергаться амины, фенолы и тиолы. В результате метилирования образуются соответствующие N-, О- и S-метильные конъюгаты. При метилировании чужеродных соединений и некоторых метаболитов переносчиком метильных групп является кофермент S-аденозилметионин. С участием метильных групп этого кофермента происходит метилирование перечисленных выше соединений. Реакции метилирования происходят под влиянием ферментных систем (метилтрансфераз). Η-метилирование. При N-метилировании метильная группа S-аденозилметионина под влиянием N-метилтрансферазы присоединяется к атомам азота метаболитов или чужеродных соединений. О-Метилирование. Этому типу конъюгации подвергаются соединения, содержащие фенольные группы. Под влиянием ферментов (О-метилтрансфераз) метильная группа кофермента S-аденозилметионина присоединяется к атомам кислорода фенольных гидроксилов. Для реакции метилирования фенолов кроме кофермента требуется присутствие ионов магния или ионов других двухвалентных металлов. Соединения, содержащие одну фенольную группу, при наличии указанных ферментов не метилируются. S-метилирование. Некоторые чужеродные соединения, содержащие тиоловые группы (-SH), в организме подвергаются метилированию. При этом метильная группа кофермента S-аденозилметионина в присутствии ферментов (метилтрансфераз) переносится к атомамсеры метаболитов или чужеродных соединений с образованием соответствующих S-метилпроизводных этих соединений. 87. Источники и образование одноуглеродных групп. Тетрагидрофолиевая кислота и цианкобаламин и их роль в процессах трансметилирования. Образование и использование одноуглеродных фрагментов.Особое значение реакций катаболизма серина и глицина заключается в том, что они сопровождаются образованием одноуглеродного метиленового фрагмента (-СН2-). Метиленовая группа в молекуле метилен- Н4-фолата может превращаться в другие одноуглеродные группы (фрагменты): метенильную (-СН=), формильную (-НС=О), метильную (-СН3) и формиминогруппу (-CH=NH). Ещё один источник формального и форми-мино-фрагментов - гистидин. Катаболизм гистидина происходит только в печени (очень небольшой процент в коже) в результате следующих реакций 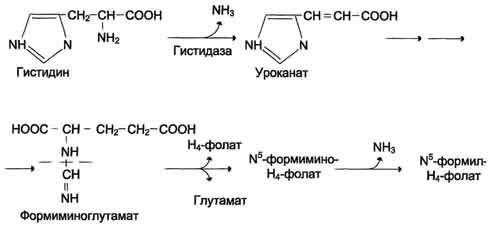 Конечными продуктами катаболизма гистидина являются глутамат, NH3 и одноуглеродные фрагменты - формимино-Н4-фолат и формил-Н4-фолат. Все образующиеся производные Н4-фолата играют роль промежуточных переносчиков и служат донорами одноуглеродных фрагментов при синтезе некоторых соединений: пуриновых оснований и тимидиловой кислоты (необходимых для синтеза ДНК и РНК), регенерации метионина, синтезе различных формиминопроизводных (формиминоглицина и т.д.) 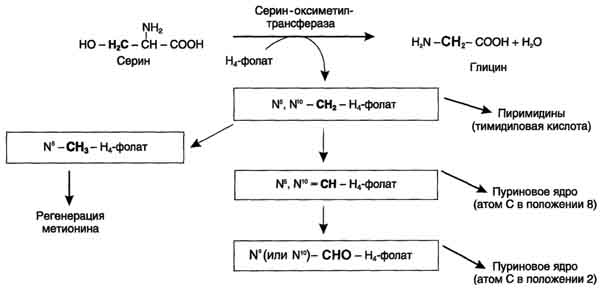 Перенос одноуглеродных фрагментов к акцептору необходим не только для синтеза ряда соединений, но и для регенерации свободного Н4-фолата в печени. Доказано, что коферментные функции ТГФК непосредственно связаны с переносом одноуглеродных групп, первичными источниками которых в организме являются β-углеродный атом серина, α-углеродный атом глицина, углерод метальных групп метионина, холина, 2-й углеродный атом индольного кольца триптофана, 2-й углеродный атом имидазольного кольца гистидина, а также формальдегид,муравьиная кислота и метанол. К настоящему времени открыто шесть одноуглеродных групп, включающихся в разнообразные биохимические превращения в составе ТГФК: формильная (—СНО), метильная (—СН3), метиленовая (—СН2—), метенильная (—СН=), оксиметильная (—СН2ОН) и формими-новая (—CH=NH). Выяснено, что присоединение этих фрагментов к ТГФК является ферментативной реакцией ковалентного связывания их с 5-м или 10-м атомом азота (или с обоими атомами вместе). Имеются данные, что производные ТГФК участвуют в переносе одно-углеродных фрагментов при биосинтезе метионина и тимина(перенос метильной группы), серина (перенос оксиметильной группы), образовании пуриновых нуклеотидов (перенос формильной группы) и т.д. Недостаточность фолиевой кислоты у человека возникает редко. Гиповитаминоз фолиевой кислоты приводит к нарушению обмена одноуглеродных фрагментов. Такое же нарушение наблюдается и при недостаточности витамина В12, использование которого связано с обменом фолиевой кислоты. Первое проявление дефицита фолиевой кислоты - мегалобластная (макроцитарная) анемия. Она характеризуется уменьшением количества эритроцитов, снижением содержания в них гемоглобина, что вызывает увеличение размера эритроцитов. Причина этих симптомов - нарушение синтеза ДНК и РНК из-за недостатка их предшественников - тимидиловой кислоты и пуриновых нуклеотидов вследствие дефицита производных Н4-фолата. Клетки кроветворной ткани быстро делятся, поэтому они в первую очередь реагируют на нарушение синтеза нуклеиновых кислот снижением скорости эритропоэза. Мегалобластная анемия возникает чаще всего в результате недостаточности фолиевой кислоты и/или витамина В12. 88. Антивитамины фолиевой кислоты. Механизм действия сульфаниламидных препаратов. В медицинской практике (в частности, в онкологии) нашли применение некоторые синтетические аналоги (антагонисты) фолиевой кислоты. Так, метатрескат, казывает выраженное иммуносупрессивное действие даже в относительно низких дозах, не обладающих заметной гематологической токсичностью. Благодаря этому метотрексат шире, чем другие цитостатики с иммуносупрессивной активностью, применяется в качестве иммуносупрессивного препарата. Аминоптерин является наиболее активным цитостатиком-антагонистом фолиевой кислоты; отличается высокой токсичностью, вследствие чего показан лишь при тяжёлых формах псориаза. Все современные сульфаниламидные препараты сходны между собой по спектру и механизму противомикробного действия. К ним весьма чувствительны стрептококки, стафилококки, пневмококки, гонококки, менингококки, кишечная, дизентерийная, дифтерийная и сибиреязвенная палочки, а также холерные вибрионы, бруцеллы и хламидии (возбудители трахомы и др.). На микроорганизмы сульфаниламиды оказывают бактериостатическое влияние. Механизм бактериостатического действия сульфаниламидов заключается в том, что эти вещества, имея структурное сходство с пара-аминобензойной кислотой (ПАБК), оказываются ее конкурентными антагонистами. ПАБК необходима микроорганизмам для синтеза фолиевой кислоты, которая превращается в фолиниевую кислоту, участвующую в синтезе нуклеиновых кислот. Синтез нуклеиновых кислот, как известно, является основным фактором, обеспечивающим развитие и размножение любых клеток, в том числе микроорганизмов. Замещая ПАБК в процессе синтеза фолиевой кислоты, сульфаниламиды нарушают образование этой кислоты и таким образом препятствуют образованию нуклеиновых кислот, что сопровождается задержкой развития и размножения микроорганизмов . Для развития клеток организма человека также необходима фолиевая кислота. Однако в отличие от микроорганизмов клетки человека сами не синтезируют фолиевую кислоту, а поглощают ее из крови, в которую эта кислота всасывается из кишечника. Этим объясняется тот факт, что клетки человека практически нечувствительны к действию сульфаниламидов в отличие от микроорганизмов. Особенностями механизма действия сульфаниламидов объясняется также и то, что в средах с высоким содержанием ПАБК (кровь, гной) антибактериальная активность сульфаниламидов заметно снижается. Аналогичное явление наблюдается в случае применения сульфаниламидов совместно с лекарственными веществами, при распаде которых в организме выделяется ПАБК (например, с новокаином). Действие сульфаниламидов ослабляется также при совместном применении с фолиевой кислотой или с веществами, участвующими в ее синтезе (например, с метионином). 89. Обмен фенилаланина и тирозина. Фенилкетонурия; биохимический дефект, проявление болезни, методы предупреждения, диагностика и лечение. Фенилаланин - незаменимая аминокислота, так как в клетках животных не синтезируется её бензольное кольцо. Тирозин - условно заменимая аминокислота, поскольку образуется из фенилаланина. Содержание этих аминокислот в пищевых белках (в том числе и растительных) достаточно велико. Фенилаланин и тирозин используются для синтеза многих биологически ктивных соединений. В разных тканях метаболизм этих аминокислот происходит по-разному. 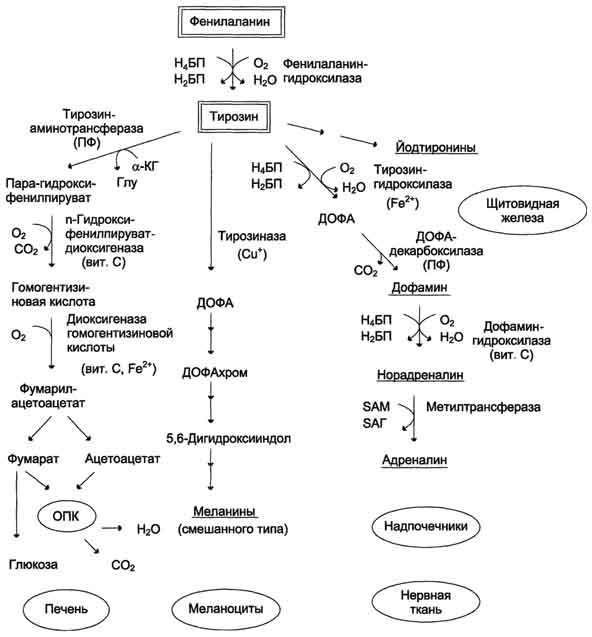 Метаболизм феиилаланина Основное количество фенилаланина расходуется по 2 путям: включается в белки; превращается в тирозин. Превращение фенилаланина в тирозин прежде всего необходимо для удаления избытка фенилаланина, так как высокие концентрации его токсичны для клеток. Образование тирозина не имеет большого значения, так как недостатка этой аминокислоты в клетках практически не бывает. Основной путь метаболизма фенилаланина начинается с его гидроксилирования, в результате чего образуется тирозин. Эта реакция катализируется специфической монооксиге-назой - фенилаланингидр(жсилазой, кофермен-том которой служит тетрагидробиоптерин (Н4БП). Активность фермента зависит также от наличия Fe2+. Реакция необратима. Н4БП в результате реакции окисляется в дигидробиоптерин (Н2БП). Регенерация последнего происходит при участии дигидроптеридинредуктазы с использованием NADPH + H+. Обмен тирозина значительно сложнее, чем обмен фенилаланина. Кроме использования в синтезе белков, тирозин в разных тканях выступает предшественником таких соединений, как катехоламины, тироксин, меланины, и ка-таболизируется до СО2 и Н2О. Катаболизм тирозина в печени В печени происходит катаболизм тирозина до конечных продуктов. Специфический путь катаболизма включает несколько ферментативных реакций, завершающихся образованием фумарата и ацетоацетата Трансаминирование тирозина с ос-кетоглутаратом катализирует тирозинаминотрансфе-раза(кофермент ПФ) - индуцируемый фермент печени млекопитающих. В результате образуется п-гидроксифенилпируват. В реакции окисления п-гидроксифенилпирувата в гомогентизиновую кислоту происходит декарбоксилирование, гидроксилирование ароматического кольца и миграция боковой цепи. Реакцию катализирует фермент n-гидроксифенилпируватдиоксигеназа, кофакторами которого выступают витамин С и Fe2+. Превращение гомогентизиновой кислоты в фумарилацетоацетат сопровождается расщеплением ароматического кольца. Эта реакция катализируется диоксигеназой гомогентизиновой кислоты, в качестве кофермента содержащей Fe2+. Обмен фенилаланина и тирозина связан со значительным количеством реакций гидроксилирования, которые катализируют оксигеназы. Ферменты оксигеназы (гидроксилазы) используют молекулу О2 и кофермент-донор водорода (чаще - Н4БП). Для катализа оксигеназам необходимы кофакторы - Fe2+ или гем (для некоторых - Сu+), а для многих ещё и витамин С. Оксигеназы делят на 2 группы: Монооксигеназы - один атом О2 присоединяют к продукту реакции, другой используют для образования Н2О; Диоксигеназы - оба атома О2 используют для образования продукта реакции. Почти все процессы расщепления ароматических колец в биологических системах катализируются диоксигеназами, подклассом ферментов, открытым японским биохимиком Осами Хайяши. В результате разрыва бензольного кольца образуется малеилацетоацетат, который в процессе цис- и транс-изомеризации превращается в фумарилацетоацетат. Гидролиз фумарилацетоацетата при действии фумарилацетоацетатгидролазы приводит к образованию фумарата и ацетоацетата. Фумарат может окисляться до СО2 и Н2О или использоваться для глюконеогенеза. Ацетоацетат - кетоновое тело, окисляемое до конечных продуктов с выделением энергии. Превращение тирозина в меланоцитах. В пигментных клетках (меланоцитах) тирозин выступает предшественником тёмных пигментов - меланинов. Среди них преобладают 2 типа: эумеланины и феомеланины. Эумеланины (чёрного и коричневого цвета) - нерастворимые высокомолекулярные гетерополимеры 5,6-дигидроксииндола и некоторых его предшественников. Феомеланины - жёлтые или красновато-коричневые полимеры, растворимые в разбавленных щелочах. Находятся они, в основном, в составе волос. Меланины присутствуют в сетчатке глаз. Цвет кожи зависит от распределения меланоцитов и количества в них разных типов меланинов. |
