реферат. химия. Электрохимические процессы
 Скачать 43.99 Kb. Скачать 43.99 Kb.
|
Электрохимические процессыПроцессы взаимного превращения химической и электрической форм энергии называют электрохимическими процессами. Электрохимические процессы можно разделить на две основные группы: 1) процессы превращения химической энергии в электрическую (в гальванических элементах); 2) процессы превращения электрической энергии в химическую (электролиз). Электрохимическая система состоит из двух электродов и ионного проводника между ними (расплав, раствор электролита или твёрдые электролиты – проводники 2-го рода). Электродами называют проводники первого рода, имеющие электронную проводимость и находящиеся в контакте с ионным проводником. Для обеспечения работы электрохимической системы электроды соединяют друг с другом металлическим проводником, называемым внешней цепью электрохимической системы. Гальванический элемент Гальванический элемент (ГЭ) – это устройство, в котором химическая энергия окислительно-восстановительной реакции превращается в энергию электрического тока. Процессы окисления в электрохимии получили название анодных процессов, а электроды, на которых идут процессы окисления, называют анодами Процессы восстановления в электрохимии получили название катодных процессов, а электроды, на которых идут процессы восстановления, называют катодами Суммарная химическая реакция, протекающая в гальваническом элементе, называется токообразующей Анод – Катод + Уравнение Нернста : Причиной возникновения и протекания электрического тока в гальваническом элементе является разность окислительно-восстановитель-ных потенциалов (электродных потенциалов1) частных реакций, определяющих электродвижущую силу Еэ гальванического элемента, и в рассматриваемом случае: 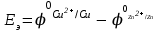 . .В общем случае: Еэ = к - а, где к – потенциал катода, а – потенциал анода. Еэ всегда больше нуля (Еэ> О). Электродный потенциал – разность потенциалов, возникающая между металлом и раствором его соли Электролиз Электролизом называются окислительно-восстановительные реакции, протекающие на электродах в растворе или расплаве электролита под действием постоянного электрического тока, подаваемого от внешнего источника. При электролизе происходит превращение электрической энергии в химическую. Прибор, в котором проводят электролиз, называют электролизером. На отрицательном электроде электролизера (катоде) происходит процесс восстановления – присоединения окислителем электронов, поступающих из электрической цепи, а на положительном электроде (аноде) – процесс окисления – переход электронов от восстановителя в электрическую цепь. Таким образом, распределение знаков заряда электродов противоположно тому, которое имеется при работе гальванического элемента. Причина этого заключается в том, что процессы, протекающие при электролизе, в принципе обратны процессам, идущим при работе гальванического элемента. При электролизе процессы осуществляются за счёт энергии электрического тока, подводимой извне, в то время как при работе гальванического элемента энергия самопроизвольно протекающей в нём химической реакции превращается в электрическую энергию. Поляризация и перенапряжение Потенциалы электродов, определённые в растворах электролитов в условиях отсутствия в цепи электрического тока, называются равновесными потенциалами (в стандартных условиях – стандартные электродные потенциалы).При прохождении электрического тока потенциалы электродов изменяются. Изменение потенциала электрода при прохождении тока называется поляризацией: = i - р, где: – поляризация; i – потенциал электрода при прохождении тока; р– равновесный потенциал электрода. Когда известна причина изменения потенциала при прохождении тока вместо термина «поляризация», используют термин «перенапряжение». Его также относят к некоторым конкретным процессам, например, к катодному выделению водорода (водородное перенапряжение). При прохождении тока изменяются потенциалы электродов электролизёра, т.е. возникает электродная поляризация. Вследствие катодной поляризации (к) потенциал катода становится более отрицательным, а из-за анодной поляризации (а) потенциал анода становится более положительным. Последовательность электродных процессов при электролизе растворов электролитов В процессах электролиза растворов электролитов могут участвовать молекулы воды, ионы Н+ и ОН  в зависимости от характера среды. При определении продуктов электролиза водных растворов электролитов можно в простейших случаях руководствоваться следующими соображениями: в зависимости от характера среды. При определении продуктов электролиза водных растворов электролитов можно в простейших случаях руководствоваться следующими соображениями:Катодные процессы. 1.1. На катоде в первую очередь идут процессы, характеризуемые наибольшим электродным потенциалом, т.е. в первую очередь восстанавливаются наиболее сильные окислители. 1.2. Катионы металлов, имеющих стандартный электродный потенциал больший, чем у водорода (Cu2+, Ag+ , Hg2+, Au3+ и др. катионы малоактивных металлов – см. р.11.2), при электролизе практически полностью восстанавливаются на катоде: Men+ + neˉ Me. 1.3. Катионы металлов, потенциал которых значительно меньше, чем у водорода (стоящих в «Ряду напряжений» от Li+ до Al3+ включительно, т.е. катионы активных металлов), не восстанавливаются на катоде, так как на катоде восстанавливаются молекулы воды: 2Н2О + 2еˉ Н2 + 2ОН  . .Электрохимическое выделение водорода из кислых растворов происходит вследствие разряда ионов водорода: 2Н+ + 2еˉ Н2. 1.4. Катионы металлов, имеющих стандартный электродный потенциал, меньше, чем у водорода, но больше чем у алюминия (стоящих в «Ряду напряжений» от Al3+ до 2Н+ - катионы металлов средней активности), при электролизе на катоде восстанавливаются одновременно с молекулами воды: Меn+ + neˉ Me 2Н2О + 2еˉ Н2 + 2ОН  . .К данной группе относятся ионы Sn2+, Pb2+, Ni2+, Co2+, Zn2+, Cd2+ и т.д.. При сравнении стандартных потенциалов этих ионов металлов и водорода можно было бы сделать вывод о невозможности выделения металлов на катоде. Анодные процессы. 2.1. На аноде в первую очередь идут процессы, характеризуемые наименьшим электродным потенциалом, т.е. в первую очередь окисляются сильные восстановители. 2.2. Обычно аноды подразделяют на инертные (нерастворимые) и активные (растворимые). Первые изготовляют из угля, графита, титана, платиновых металлов, имеющих значительный положительный электродный потенциал или покрытых устойчивой защитной плёнкой, служащих только проводниками электронов. Вторые – из металлов, ионы которых присутствуют в растворе электролита – из меди, цинка, серебра, никеля и др. 2.3. На инертном аноде при электролизе водных растворов щелочей, кислородосодержащих кислот и их солей, а также НF и ее солей (фторидов) происходит электрохимическое окисление гидроксид-ионов с выделением кислорода. В зависимости от рН раствора этот процесс протекает по-разному и может быть записан различными уравнениями: а) в кислой и нейтральной среде 2 Н2О – 4еˉ = О2 + 4 Н+; б) в щелочной среде 4ОН  – 4еˉ = О2 + 2Н2О. – 4еˉ = О2 + 2Н2О.Потенциал окисления гидроксид-ионов (потенциал кислородного электрода) можно рассчитать по формуле (см. раздел 10.3): 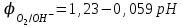 . .Кислородосодержащие анионы SO  , SO , SO , NO , NO ,CO ,CO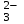 , PO , PO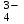 и т.д. или не способны окисляться, или их окисление происходит при очень высоких потенциалах, например: 2SO и т.д. или не способны окисляться, или их окисление происходит при очень высоких потенциалах, например: 2SO - 2eˉ = S2O - 2eˉ = S2O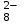 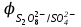 = 2,01 В. = 2,01 В.2.4. При электролизе водных растворов бескислородных кислот и их солей (кроме НF и ее солей) у инертного анода разряжаются их анионы. Отметим, что выделение хлора (Cl2) при электролизе раствора НCl и её солей, выделение брома (Br2) при электролизе раствора HBr и её солей противоречит взаимному положению систем. 2Cl  - 2eˉ = Cl2 - 2eˉ = Cl2 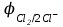 = 1,356 В = 1,356 В2Br  - 2eˉ = Br2 - 2eˉ = Br2 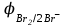 = 1,087 В = 1,087 В2H2O- 4eˉ = O2 + 4 Н+ 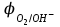 = 0,82 В (рН = 7) = 0,82 В (рН = 7)2.5. Если потенциал металлического анода меньше, чем потенциал ионов ОН  или других веществ, присутствующих в растворе или на электроде, то протекаетэлектролиз с активным анодом. Активный анод окисляется, растворяясь: или других веществ, присутствующих в растворе или на электроде, то протекаетэлектролиз с активным анодом. Активный анод окисляется, растворяясь: Ме – neˉ Men+. Применение электролиза Практически нет ни одной отрасли техники, где бы он не применялся. В энергетике водород, полученный электролизом, используют для охлаждения генераторов на тепловых и атомных ЭС. Электролизом солей получают различные металлы: Cu, Zn, Cd, Ni, Mn и др. металлы. Электролиз используется для нанесения металлических покрытий на металлы и пластмассы (гальванические покрытия). Электролизом воды получают O2, H2, Cl2 и щёлочи из раствора хлорида натрия. Электролиз используют для зарядки аккумуляторов 1 |
