Лабораторная 1. Электрохимические свойства металлов. Гальванические элементы
 Скачать 75.57 Kb. Скачать 75.57 Kb.
|
|
1 Лабораторная работа «ЭЛЕКТРОХИМИЧЕСКИЕ СВОЙСТВА МЕТАЛЛОВ. ГАЛЬВАНИЧЕСКИЕ ЭЛЕМЕНТЫ» Цель работы: 1. Исследование электрохимических свойств металлов. 2. Ознакомление с устройством гальванических элементов и изучение окислительно-восстановительных процессов, протекающих при их работе. Оборудование и реактивы: Милиамперметр; U – образный электролитический мостик; химические стаканы; пробирки; наждачная бумага; пластинки: меди, цинка, никеля; гранулы цинка, олова, кадмия. Растворы: хлорида калия (KCl), насыщ.; сульфата меди (II) (CuSO4), 1М; сульфата цинка (ZnSO4), 1М, 0,0001М; сульфата никеля (NiSO4), 1М; сульфата железа (II) (FeSO4), 1М; хлорида олова (II) (SnCl2), 1М; ацетата свинца (II) ((CH3COO)2Pb), 1M; нитрата серебра (AgNO3), 1%, серной кислоты (H2SO4), 2н. ОПЫТ 1. Исследование активности металлов Налить в отдельные пробирки по 1 мл растворов солей: цинка, железа (II), меди (II), олова (II), свинца (II), серебра и H2SO4. Опустить в растворы (кроме раствора с одноименными ионами) гранулы металлического цинка. Отметить наблюдения. Повторить аналогичные опыты с пластинками меди; гранулами олова и кадмия. Из каких растворов вытесняются металлы? Результаты опыта оформить в виде таблицы (см. таблицу 1.1), в которой при взаимодействии металла с раствором соли или кислоты ставить знак «+». Написать уравнения соответствующих окислительно-восстановительных реакций. Записать металлы по убыванию их восстановительной способности, определенной экспериментально. Выписать значения их стандартных электродных потенциалов (см. приложение А). Соответствует ли экспериментальный ряд металлов их положению в электрохимическом ряду напряжений
Zn + 2H₂SO₄ = ZnSO₄ + SO₂ + 2H₂O Cd + H2SO4 → CdSO4 + 2H Sn + 2H2SO4 → SnSO4 + SO2 + 2H2O Cu + 2H2SO4 → CuSO4 + SO2 + 2H2O Cd + ZnSO4 → Zn + CdSO4 Sn + ZnSO4 = Zn + SnSO4 Zn+FeSO4 = ZnSО4 + Fe Cd + FeSO4 → Fe + CdSO4 Sn + FeSO4 → SnSO4 + Fe Cu + Fe2(SO4)3 = CuSO4 + 2FeSO4 SnCl2 + Zn = Sn + ZnCl2 SnCl2 + Cd → Sn + CdCl2 Cu + SnCl2 = CuCl + Sn Pb(CH3COO)2 + Zn = Zn(CH3COO)2 + Pb Cd + Pb(CH3COO)2 = Cd(CH3COO)2 + Pb Pb(CH3COO)2 + Sn → Sn(CH3COO)2 + Pb CuSO4 + Zn → ZnSO4 + Cu CuSO4 + Cd → CdSO4 + Cu(↓) Sn + CuSO4 → SnSO4 + Cu Zn + 2AgNO3 → 2Ag + Zn(NO3)2 Cd + 2AgNO3 → 2Ag + Cd(NO3)2 Sn + 2AgNO3 → 2Ag + Sn(NO3)2 2AgNO3 + Cu → Cu(NO3)2 + 2Ag(↓) Экспериментальный ряд металлов соответствует их положению в электрохимическом ряду напряжений ОПЫТ 2. Химический гальванический элемент Собрать гальванический элемент, как показано на рисунке 1.8. Для этого цинковую и медную пластинки хорошо очистить наждачной бумагой и опустить в стаканы с растворами одноименных солей. Для замыкания внутренней цепи элемента, солевой мостик (гальванический ключ) заполненный раствором хлорида калия, опустить в растворы солей. Электроды с помощью проводов соединить с миллиамперметром. Что наблюдается? Заменить в собранном гальваническом элементе цинковую пластину на никелевую (предварительно зачищенную наждачной бумагой), опустив в раствор одноименной соли и следить за показанием прибора. В каком случае гальванический элемент работает лучше, почему? 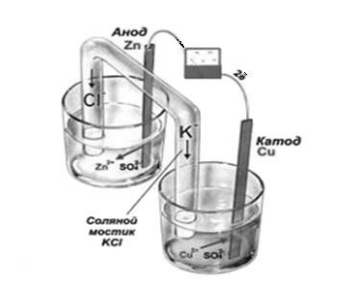 Рисунок 1.8 – Схема установки медноцинкового гальванического элемента Во время его работы, когда замкнута электрическая цепь, происходит процесс окисления металлического цинка. На его поверхности соприкосновения с раствором соли наблюдается превращение атомов в катионы Zn2+. Процесс сопровождается выделением «свободных» электронов, которые передвигаются по внешней цепи. Реакцию, протекающую на цинковом электроде, можно представить в следующем виде: Восстановление катионов металла осуществляется на медном электроде. Отрицательные частицы, которые попадают сюда с цинкового электрода, объединяются с катионами меди, осаждая их в виде металла. Данный процесс имеет следующий вид: Если сложить две реакции, рассмотренные выше, получается суммарное уравнение, описывающее работы цинково-медного гальванического элемента. В качестве анода выступает цинковый электрод, катодом служит медь. Современные гальванические элементы и аккумуляторы предполагают применение одного раствора электролита, что расширяет сферы их применения, делает их эксплуатацию более комфортной и удобной. ОПЫТ 3. Концентрационный гальванический элемент Две цинковые пластинки хорошо очистить наждачной бумагой и опустить в стаканы с растворами сульфата цинка разных концентраций: 1М и 0,0001 М. Пластики соединить с клеммами миллиамперметра, а стаканы – гальваническим ключом. Следить за показаниями миллиамперметра. Составить электрохимическую схему гальванического элемента с указанием процессов, протекающих на электродах. Рассчитать ЭДС полученного концентрационного элемента. Провести расчет ЭДС гальванических элементов, если концентрации растворов сульфата цинка: 1М и 0,1М; 1М и 0,001М. В каком случае вырабатывается большее количество электричества, почему? Cм1(ZnSO4) = 0,1M Cм2(ZnSO4) = 0,001M Имеем так называемый концентрационный элемент. Концентрационным гальваническим элементом называется гальванический элемент, составленный из одинаковых электродов, погруженных в раствор одного и того же электролита, концентрации которого различны. Процессы, протекающие на электродах концентрационного гальванического элемента. Катод (+) Zn(2+) + 2e = Zn | 1 – восстановление Анод (–) Zn – 2e = Zn(2+) | 1 – окисление Будем считать, что сульфат цинка ZnSO4 в растворах электролитов продиссоциировал полностью. Поскольку мы имеем концентрационный элемент, то у катода молярная концентрация ионов цинка Zn(2+) будет выше, чем у анода. [Zn(2+)]к = Cм1(ZnSO4) = 0,1M – молярная концентрация у катода [Zn(2+)]а = Cм2(ZnSO4) = 0,001M – молярная концентрация у анода В схеме гальванического элемента анод записывается слева, а катод справа, тогда схема гальванического элемента. Zn | ZnSO4 (0,001M) || ZnSO4 (0,1M) | Zn ЭДС концентрационного гальванического элемента по уравнению Нернста при 298ºК. Е = Е(катода) – Е(анода) = (0,059/2)*lg([Zn(2+)]к/[Zn(2+)]а) = 0,0295*lg(0,1/0,001) = 0,0295*lg100 = 0,059 В 2 Лабораторная работа «КОРРОЗИЯ МЕТАЛЛОВ Цель работы: смоделировать в лабораторных условиях процессы электрохимической коррозии металлических изделий и методы защиты металлов от коррозийных разрушений. Оборудование и реактивы: пробирки; штатив для пробирок; наждачная бумага; фильтровальная бумага, пластинки: цинка, алюминия, оцинкованного железа, луженого железа; медный стержень; стальные гвозди; железные стружки; уротропин; 2%-ные растворы: сульфата меди (CuSO4), нитрата ртути (I) (Hg2(NO3)2), нитрата ртути (II) (Hg(NO3)2),гидроксида натрия (NaOH); растворы: серной кислоты (H2SO4), разб.; азотной кислоты (HNO3), конц.; красной кровяной соли (K3[Fe(CN)6]), 1M. ОПЫТ 1. Коррозия при контакте двух различных металлов В пробирку поместить цинковую пластинку. Прилить разбавленной серной кислоты. Отметить выделение водорода и объяснить возможность протекания реакции с помощью значения стандартного электродного потенциала (см. приложение А). Ввести в раствор кислоты медный стержень, не доводя его до соприкосновения с цинковой пластинкой. Наблюдается ли выделение водорода на меди? Прикоснуться медным стержнем цинковой пластинки. На каком металле будет наблюдаться выделение водорода? Записать схему коррозийного медноцинкового гальванического элемента с водородной деполяризацией на катоде. Как повлиял контакт с медью на коррозию цинка? Медь не вытесняет водород из разбавленных кислот так как она стоит в ряде напряжений металлов правее водорода. Таким образом потенциала меди недостаточно для вытеснения водорода из разбавленных кислот. Если прикоснутся цинковой пластинкой образуется гальванический элемент где медь будет катодом Электродные процессы: Анод: Zn0 - 2e- = Zn2+ Катод: 2H+ +2e- = H2O - процесс на медной пластинке Zn + 2H+ = Zn2+ + H2 ОПЫТ 2. Влияние гальванопары, возникающей в результате химической реакции, на процесс растворения металла В две пробирки налить по 2 мл разбавленной серной кислоты и внести по одной пластинке цинка. Наблюдать медленное выделение водорода в пробирках. В одну из пробирок добавить 1 мл раствора сульфата меди. Что наблюдается? Почему возросла скорость выделения водорода при добавлении раствора сульфата меди? Объяснить результаты опыта. Разбавленная серная кислота реагирует с цинком, а с медью – нет, т. к. медь в ряду активности металлов стоит после водорода, а цинк до водорода. Zn + H2SO4 ⟶ ZnSO4 + H2↑ 2H+ + 2ē ⟶ H20 1 окислитель (восстановление) Zn0 - 2ē ⟶ Zn+2 1 восстановитель (окисление) ОПЫТ 3. Коррозия алюминия на воздухе и в воде Алюминий способен проявлять высокую химическую активность, если с его поверхности снять защитную оксидную пленку. Для удаления оксидной пленки, опустить две алюминиевые пластинки в раствор щелочи на 1-2 минуты, промыть водой и осушить фильтровальной бумагой. Опустить обе пластинки в раствор Hg2(NO3)2 на 1-2 минуты. Вынув алюминиевые пластинки из пробирки, осушить фильтровальной бумагой и сделать 2-3 царапины на поверхности металла. Одну пластинку оставить на воздухе. Что происходит с алюминиевой пластинкой на воздухе? Каков состав белого порошка, которым обрастает пластинка? Другую пластинку поместить в дистиллированную воду. Какой газ выделяется при опускании алюминиевой пластинки в воду? Если выделение газа незначительно, осторожно потереть поверхность пластинки стеклянной палочкой. Записать схемы гальванических элементов и уравнения анодного и катодного процессов, протекающих в первом и втором случаях. Алюминий очень активный металл, его Е 0 = –1,663 В. Однако алюминий при комнатной температуре не изменяется на воздухе, поскольку его поверхность покрыта тонкой плёнкой оксида, обладающей очень сильным защитным действием. При действии на алюминий водных растворов щелочей слой оксида растворяется, причём образуется алюминаты — соли, растворимые в воде, содержащие алюминий в составе аниона: Al2O3 + NaOH → NaAlO2 — метаалюминат Na; или: Al2O3 + 2NaOH + 3H2O = 2Na[Al(OH)4]. Алюминий, лишённый защитной плёнки, взаимодействует с водой, вытесняя из неё водород: 2Al + 6H2O = 2Al(OH) 3 + 3H2↑. Далее происходит обменная реакция c нитратом ртути (II): 2Al + 3Hg(NO3)2 = 3Hg + 2Al(NO3)3. Возникает коррозионная гальванопара в нейтральной среде: (–) Al │H2O, O2 │Hg (+); Е 0 Al3+/Al= –1,67 B; Е 0 Hg2+/Hg= +0,79 B. Анод Al0 – 3 ē → Al3+ (окисление); катод 2H2O + O2 + 4 ē = 4OH– (восстановление на ртути). Таким образом, происходит коррозия алюминия с кислородной деполяризацией. Продукт коррозии в нейтральной среде — гидроксид алюминия (рыхлые белые хлопья): Al3+ + OH– = Al(OH)3↓. ОПЫТ 4. Катодные и анодные защитные покрытия В две пробирки налить (1/2 объема) воды и добавить в каждую пробирку по 1-2 мл H2SO4 и по 2-4 капли раствора красной кровяной соли K3[Fe(CN)6]. В одну пробирку поместить оцинкованное железо, а в другую – луженое железо. Отметить изменение цвета раствора в пробирках. Учесть, что красная кровяная соль образует с ионами Fe2+ соединение синего цвета. Объяснить наблюдения, записать уравнения анодных и катодных процессов и привести схемы работы коррозийных гальванопар. В каком случае корродирует железо? Указать, какое из изученных покрытий было анодным, а какое – катодным. 2Al + 3 H2SO4 → 3H2 + Al2(SO4)3 (протекает медленно) СuSO4 + Al → Cu↓ + Al2(SO4)3 Добавим в одну из пробирок NaCl . Тогда там будет наблюдаться более интенсивное выделение водорода, таким образом хлор служит активатором коррозии. Fe+K4[Fe(CN)6]= Fe[Fe(CN)6]+3K А (–) Fe | H2O, O2 | Cu (+) K A(–): Fe0 – 2ē = Fe2+ K(+): 2Н2О + О20 + 4ē = 4ОН- 2Fe + O2 + 2H2O = 2Fe(OH)2 При дальнейшем окислении железа получим: 4Fe(OH)2 + O2 + 2H2O = 4Fe(OH)3 ОПЫТ 5. Влияние ингибитора на скорость коррозии Налить в 3 пробирки (до 1/4 объема) раствор соляной кислоты. В одну из пробирок поместить пластинку цинка, во вторую – железные стружки и в третью – пластинку алюминия. Наблюдать выделение водорода. Затем добавить в каждую из пробирок немного уротропина. Какой наблюдается эффект? Наиболее интенсивнее в пробирке с алюминием, наименее-в пробирке с железом Al+2HCI=AlCI2+H2 Zn+2HCI=ZnCI2+H2 Fe+2HCI=FeCI2+H2 |
