ЭЛЕКТРОХИМИЯ_Лекция. Электрохимия
 Скачать 334 Kb. Скачать 334 Kb.
|
Электрохимические ячейки.Электрохимическая ячейка обычно состоит из двух полуэлементов, каждый из которых представляет собой электрод, погруженный в свой электролит. Электроды изготавливают из электропроводящего материала (металла или углерода), реже из полупроводника. Носителями заряда в электродах являются электроны, а в электролите – ионы. Являющийся электролитом водный раствор поваренной соли (хлорида натрия NaCl) содержит заряженные частицы: катионы натрия Na+ и анионы хлора Cl–. Если поместить такой раствор в электрическое поле, то ионы Na+ будут двигаться к отрицательному полюсу, ионы Cl– – к положительному. Расплавы солей, например NaCl, тоже электролиты. Электролитами могут быть и твердые вещества, например -глинозем (полиалюминат натрия), содержащий подвижные ионы натрия, или ионообменные полимеры. Полуэлементы разделяются перегородкой, которая не мешает движению ионов, но предотвращает перемешивание электролитов. Роль такой перегородки может выполнять солевой мостик, трубка с водным раствором, закрытая с обоих концов стекловатой, ионообменная мембрана, пластина из пористого стекла. Оба электрода электролитической ячейки могут быть погружены в один электролит. Электрохимические ячейки бывают двух типов: гальванические элементы и электролитические ячейки (электролизеры). В гальваническом элементе химические реакции протекают самопроизвольно на границе раздела электрод/электролит, а электроды соединены друг с другом проводником. Несколько гальванических элементов, соединенных последовательно, образуют батарею – химический источник тока. В электролитической ячейке реакции на границе раздела электрод/электролит протекают за счет внешнего источника электрической энергии; последняя превращается в химическую энергию продуктов реакций, протекающих на электродах. Устройство гальванического элемента представлено на рис. 1, а электролизера – на рис. 2. Отметим, что одна и та же ячейка в зависимости от режима работы может вести себя то как гальванический элемент, то как электролизер. Так, автомобильный свинцовый аккумулятор действует как гальванический элемент, когда используется для запуска двигателя (при этом он разряжается), и как электролизер, когда заряжается от автомобильного генератора или от зарядного устройства. 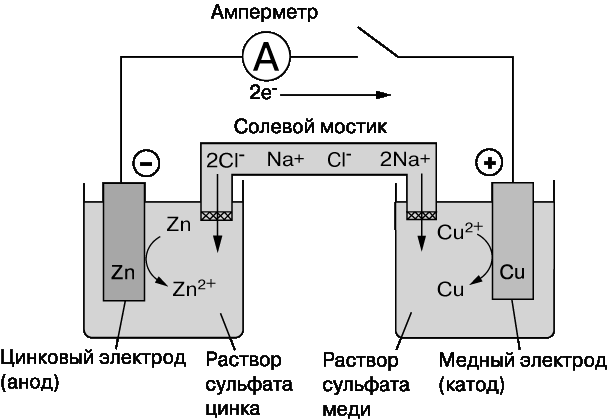 Простой гальванический элемент, созданный в 1836 Дж.Даниелем (рис. 1), состоит из двух электродов: цинкового, погруженного в водный раствор сульфата цинка, и медного, погруженного в водный раствор сульфата меди (II). Такой элемент аналогичен медно-цинковым пáрам в вольтовом столбе. При замкнутой внешней цепи атомы цинка на поверхности цинкового электрода окисляются до ионов с высвобождением электронов: Zn Zn2+ + 2e– . Эти электроны перемещаются по внешней цепи на медный электрод и восстанавливают ионы меди до атомов: Cu2+ + 2e– Cu. Поток электронов во внешней цепи – это и есть ток, вырабатываемый элементом. Суммарная реакция, приводящая к химическому превращению и к генерации электрической энергии, имеет вид Точно такая же реакция протекает при добавлении металлического цинка в раствор сульфата меди, но в этом случае химическая энергия переходит в тепловую. Электрохимические ячейки часто представляют схематически, обозначая границу между электродом и электролитом вертикальной или косой чертой (| или /), а солевой мостик – двумя косыми черточками (//). Так, гальваническому элементу на рис. 1 отвечает запись где M – молярная концентрация раствора. В электролитической ячейке, изображенной на рис. 2, протекают те же реакции, что и в промышленных электролизерах для получения хлора и щелочи: превращение рассола (концентрированного водного раствора хлорида натрия) в хлор и гидроксид натрия NaOH: 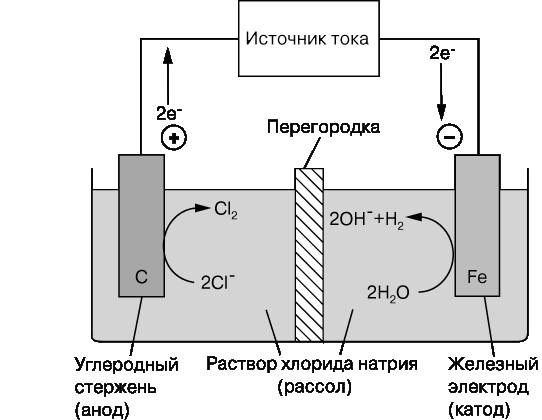 Хлорид-ионы на графитовом электроде окисляются до газообразного хлора, а вода на железном электроде восстанавливается до водорода и гидроксид-иона. Электролиты остаются электронейтральными благодаря перемещению ионов натрия через перегородку – ионообменную мембрану. Электрод, на котором осуществляется окисление (цинк на рис. 1 и графит на рис. 2), называется анодом, а электрод, на котором происходит восстановление, – катодом. |
