ЭЛЕКТРОХИМИЯ_Лекция. Электрохимия
 Скачать 334 Kb. Скачать 334 Kb.
|
Многоэлементные ЭХГ.И стаканчиковые, и кнопочные элементы используются в многоэлементных ЭХГ. Такие батареи электропитания обычно имеют квадратную или прямоугольную форму в плане. Из плоских «галетных» элементов легко составляются пакеты. В многоэлементных сухих ЭХГ чаще всего применяются первичные элементы Лекланше, цинкхлоридные и щелочные первичные элементы. Вторичные ЭХГВторичные ЭХГ (электрические аккумуляторы) перезаряжаются пропусканием постоянного тока в направлении, противоположном направлению тока в режиме разрядки. При этом активные соединения в элементе восстанавливаются в результате обратной химической реакции. Свинцовый аккумулятор.Свинцовый аккумулятор – самый распространенный в настоящее время. Его положительным электродом служит свинцовая решетка с ячейками, заполненными пастообразным пероксидом (перекисью) свинца PbO2. Отрицательный электрод, той же формы, несколько тоньше, а его ячейки заполнены пастой из губчатого свинца. Каждый элемент содержит много таких пластин обоих видов. Группы чередующихся электродных пластин разделены изолирующими перегородками из дерева, стекла, пластмассы или резины. Вся сборка, погруженная в электролит (разбавленный раствор серной кислоты), представляет собой один гальванический элемент. Из нескольких элементов, соединенных последовательно, составляется батарея. ЭДС одного элемента равна 2 В. Состояние свинцового аккумулятора оценивается путем измерения относительной плотности электролита. Непосредственно после зарядки она составляет примерно 1,26, а по мере разрядки понижается почти до 1,0 (это объясняется тем, что серная кислота образует химическое соединение с материалом пластин, давая в остатке воду). 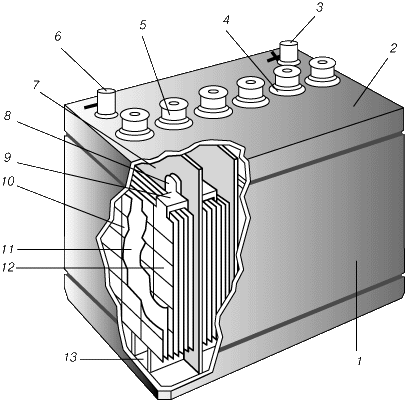 Свинцовая батарея недорога, имеет довольно большую ЭДС и хорошо сохраняет заряд. Она способна без повреждения давать кратковременно большой ток и очень хорошо подходит для пуска автомобильных двигателей. Ее можно сотни раз перезаряжать без ухудшения рабочих характеристик. Однако она приходит в негодность, если ее надолго оставляют разряженной. Железо-никелевый аккумулятор.Положительным электродом такого аккумулятора, предложенного Т.Эдисоном, служит оксид никеля, отрицательным – железо, электролитом – гидроксид калия. В процессе разрядки оксид никеля превращается в никель, железо – в оксид железа, а электролит не меняется. Такой аккумулятор легче свинцового и не повреждается при хранении в разряженном состоянии. Его ЭДС меньше, чем у свинцового, и несколько понижается в ходе разрядки, в среднем составляя ок. 1,2 В. С учетом своего большого срока службы и сравнительно низких потерь он применяется главным образом в промышленном оборудовании. Никель-кадмиевый аккумулятор.Никель-кадмиевый аккумулятор допускает многократную перезарядку, сохраняет почти постоянной ЭДС в процессе разрядки и более неприхотлив, чем все другие аккумуляторы. Он хорошо работает при пониженных температурах и может быть герметизирован. Последнее означает, что его можно переворачивать вверх дном, не боясь пролить электролит; он не требует периодического добавления воды. Такие аккумуляторы обладают достоинством многократной перезарядки. В заряженном состоянии положительным электродом служит пероксид никеля, отрицательным – металлический кадмий. Электролит – гидроксид калия. Средняя ЭДС аккумулятора около 1,2 В. Никель-кадмиевые аккумуляторы широко применяются в малых переносных бытовых электроприборах в тех случаях, когда желательна возможность перезарядки. В качестве автомобильных они слишком дороги. Другие перезаряжаемые ЭХГ.Здесь мы скажем несколько слов о высокотемпературных аккумуляторах, полимерных аккумуляторах и топливных элементах. Высокотемпературные аккумуляторыработают при 300–400 C; в качестве отрицательного электрода в них обычно используется металлический натрий или литий, в качестве положительного – сера, хлор или сульфид железа. Они отличаются высокой плотностью мощности и энергии (в 2–4 раза больше, чем в свинцовых аккумуляторах) и, в перспективе, низкой стоимостью. Их широкому применению препятствуют значительное тепловыделение и коррозия. Полимерные аккумуляторы.В качестве возможного материала для электродов аккумуляторов исследуются такие недорогие и легкие электропроводящие полимеры, как полиацетилен и полианилин. Перезаряжаемые БЭ с проводящими пластмассовыми электродами в соответствующем электролите смогут, по-видимому, успешно конкурировать как со свинцовыми, так и с никель-кадмиевыми аккумуляторами. Топливные элементыТопливный элемент, электрохимический генератор, устройство, обеспечивающее прямое преобразование химической энергии в электрическую. Хотя то же самое происходит в электрических аккумуляторах, топливные элементы имеют два важных отличия: 1) они функционируют до тех пор, пока топливо и окислитель поступают из внешнего источника; 2) химический состав электролита в процессе работы не изменяется, т.е. топливный элемент не нуждается в перезарядке. Принцип действия.Топливный элемент (рис. 1) состоит из двух электродов, разделенных электролитом, и систем подвода топлива на один электрод и окислителя на другой, а также системы для удаления продуктов реакции. В большинстве случаев для ускорения химической реакции используются катализаторы. Внешней электрической цепью топливный элемент соединен с нагрузкой, которая потребляет электроэнергию. 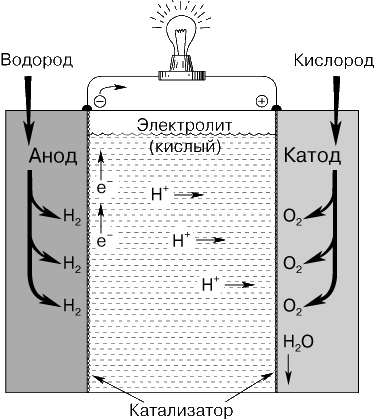 В изображенном на рис. 1 топливном элементе с кислым электролитом водород подается через полый анод и поступает в электролит через очень мелкие поры в материале электрода. При этом происходит разложение молекул водорода на атомы, которые в результате хемосорбции, отдавая каждый по одному электрону, превращаются в положительно заряженные ионы. Этот процесс может быть описан следующими уравнениями: Ионы водорода диффундируют через электролит к положительной стороне элемента. Подаваемый на катод кислород переходит в электролит и также реагирует на поверхности электрода с участием катализатора. При соединении его с ионами водорода и электронами, которые поступают из внешней цепи, образуется вода: В топливных элементах со щелочным электролитом (обычно это концентрированные гидроксиды натрия или калия) протекают сходные химические реакции. Водород проходит через анод и реагирует в присутствии катализатора с имеющимися в электролите ионами гидроксила (OH–) с образованием воды и электрона: На катоде кислород вступает в реакцию с водой, содержащейся в электролите, и электронами из внешней цепи. В последовательных стадиях реакций образуются ионы гидроксила (а также пергидроксила O2H–). Результирующую реакцию на катоде можно записать в виде: Поток электронов и ионов поддерживает баланс заряда и вещества в электролите. Образующаяся в результате реакции вода частично разбавляет электролит. В любом топливном элементе часть энергии химической реакции превращается в тепло. Поток электронов во внешней цепи представляет собой постоянный ток, который используется для совершения работы. Большинство реакций в топливных элементах обеспечивают ЭДС около 1 В. Размыкание цепи или прекращение движения ионов останавливает работу топливного элемента. Процесс, происходящий в водородно-кислородном топливном элементе, по своей природе является обратным хорошо известному процессу электролиза, в котором происходит диссоциация воды при прохождении через электролит электрического тока. Действительно, в некоторых типах топливных элементов процесс может быть обращен – приложив к электродам напряжение, можно разложить воду на водород и кислород, которые могут быть собраны на электродах. Если прекратить зарядку элемента и подключить к нему нагрузку, такой регенеративный топливный элемент сразу начнет работать в своем нормальном режиме. Теоретически размеры топливного элемента могут быть сколь угодно большими. Однако на практике несколько элементов объединяются в небольшие модули или батареи, которые соединяются либо последовательно, либо параллельно. Типы топливных элементов.Существуют различные типы топливных элементов. Их можно классифицировать, например, по используемому топливу, рабочему давлению и температуре, по характеру применения. Элементы на водородном топливе.В этом типичном описанном выше элементе водород и кислород переходят в электролит через микропористые углеродные или металлические электроды. Высокая плотность тока достигается в элементах, работающих при повышенной температуре (около 250 С) и высоком давлении. Элементы, использующие водородное топливо, получаемое при переработке углеводородного топлива, например природного газа или нефтепродуктов, по-видимому, найдут наиболее широкое коммерческое применение. Объединяя большое число элементов, можно создавать мощные энергетические установки. В этих установках постоянный ток, вырабатываемый элементами, преобразуется в переменный со стандартными параметрами. Новым типом элементов, способных работать на водороде и кислороде при нормальных температуре и давлении, являются элементы с ионообменными мембранами (рис. 2). В этих элементах вместо жидкого электролита между электродами располагается полимерная мембрана, через которую свободно проходят ионы. В таких элементах наряду с кислородом может использоваться воздух. Образующаяся при работе элемента вода не растворяет твердый электролит и может быть легко удалена. 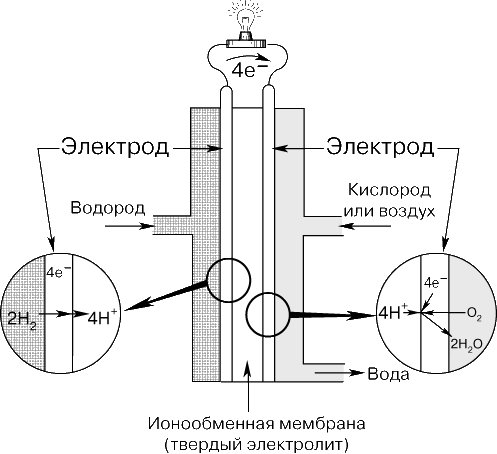 Элементы на углеводородном и угольном топливах.Топливные элементы, которые могут превращать химическую энергию таких широко доступных и сравнительно недорогих топлив, как пропан, природный газ, метиловый спирт, керосин или бензин, непосредственно в электричество, являются предметом интенсивного исследования. Однако пока не достигнуто заметных успехов в создании топливных элементов, работающих на газах, получаемых из углеводородного топлива, при нормальной температуре. Для повышения скорости реакции углеводородного и угольного топлива приходится повышать рабочую температуру топливного элемента. Электролитами служат расплавы карбонатов или других солей, которые заключаются в пористую керамическую матрицу. Топливо «расщепляется» внутри элемента с образованием водорода и оксида углерода, которые поддерживают протекание токообразующей реакции в элементе. Элементы, работающие на других видах топлива.В принципе реакции в топливных элементах не обязательно должны быть реакциями окисления обычных топлив. В перспективе могут быть найдены и другие химические реакции, которые позволят осуществить эффективное непосредственное получение электричества. В некоторых устройствах электроэнергия получается при окислении, например, цинка, натрия или магния, из которых изготавливаются расходуемые электроды. Коэффициент полезного действия.Превращение энергии обычных топлив (угля, нефти, природного газа) в электричество было до сих пор многоступенчатым процессом. Сжигание топлива, позволяющее получить пар или газ, необходимые для работы турбины или двигателя внутреннего сгорания, которые, в свою очередь, вращают электрический генератор, – процесс не очень эффективный. Действительно, коэффициент использования энергии такого превращения ограничен по второму закону термодинамики, и его вряд ли можно существенно поднять выше существующего уровня. Коэффициент использования энергии топлива самых современных паротурбинных энергетических установок не превышает 40%. Для топливных элементов нет термодинамического ограничения коэффициента использования энергии. В существующих топливных элементах от 60 до 70% энергии топлива непосредственно превращается в электричество, и энергетические установки на топливных элементах, использующие водород из углеводородного топлива, проектируются на КПД 40–45%. Применения.Топливные элементы могут в недалеком будущем стать широко используемым источником энергии на транспорте, в промышленности и домашнем хозяйстве. Высокая стоимость топливных элементов ограничивала их применение военными и космическими приложениями. Предполагаемые применения топливных элементов включают их применение в качестве переносных источников энергии для армейских нужд и компактных альтернативных источников энергии для околоземных спутников с солнечными батареями при прохождении ими протяженных теневых участков орбиты. Небольшие размеры и масса топливных элементов позволили использовать их при пилотируемых полетах к Луне. Топливные элементы на борту трехместных кораблей «Аполлон» применялись для питания бортовых компьютеров и систем радиосвязи. Топливные элементы можно использовать в качестве источников питания оборудования в удаленных районах, для внедорожных транспортных средств, например в строительстве. В сочетании с электродвигателем постоянного тока топливный элемент будет эффективным источником движущей силы автомобиля. Для широкого применения топливных элементов необходимы значительный технологический прогресс, снижение их стоимости и возможность эффективного использования дешевого топлива. При выполнении этих условий топливные элементы сделают электрическую и механическую энергию широко доступными во всем мире. Топливные элементы отличаются от других ЭХГ в двух важных отношениях. Во-первых, они могут работать в непрерывном режиме без простоев для перезарядки, так как их активный материал подводится из внешнего источника. Во-вторых, их электролит в процессе работы не изменяется. Топливные элементы в принципе более экономичны и дешевы, чем другие ЭХГ, так как их активный материал представляет собой обычное топливо, а не металл особой очистки. Их теоретический КПД близок к 100%. Топливные элементы ожидает ряд применений, в которых важны их малые размеры и высокая экономичность. Они могут использоваться как автономные источники тока для автомобилей и катеров, электрогенераторы для индивидуальных домашних хозяйств, переносные силовые блоки для инструментов и другого оборудования. В топливных элементах одного из наиболее перспективных типов в качестве топлива используется газообразный водород, в качестве окислителя – кислород, а электролитом служит гидроксид калия. Водород и кислород вводятся в элемент через пористые трубчатые электроды и вступают в реакцию окисления, образуя воду. С электродов снимается возникающее при этом напряжение. Исследуются возможности работы топливных элементов на еще более дешевых энергоносителях, таких, как бензин и природный газ. Солнечные батареиСолнечные (фотоэлектрические) батареи преобразуют солнечную энергию в электрическую. По своему принципу действия они, в общем, аналогичны транзистору. Обычно их изготавливают из полупроводникового кремния, легированного небольшими добавками таких примесей, как мышьяк и бор. Типичные размеры солнечных элементов 20100,4 мм. Солнечный элементарный источник тока можно представить в виде двух сложенных тонких листков, соединенных между собой так, что образуется p-n-переход. В одном листке примесными являются атомы бора, в другом – мышьяка. При освещении элемента между двумя слоями кремния, как между электродами обычной батареи электропитания, возникает ЭДС. Но в кремниевой солнечной батарее ЭДС существует, пока на нее падает солнечный свет. Когда она вырабатывает электрический ток, в ней не происходит никаких химических превращений. Поэтому ее срок службы не ограничен. Некоторые солнечные батареи преобразуют в электроэнергию ок. 1/7 энергии солнечного света. Ядерные источники токаВ ядерном реакторе атомной электростанции за счет энергии ядерного топлива выделяется тепло, которое используется для получения пара, приводящего в действие электрогенератор. Ядерный же источник тока преобразует ядерную энергию непосредственно в электрическую. Ядерная батарея электропитания состоит из радиоактивного источника, испускающего электроны с большой кинетической энергией, коллектора, собирающего эти электроны, и изолятора, сквозь который электроны проходят на пути к коллектору. Зажимы, предусмотренные на коллекторе и радиоактивном источнике, служат внешними выводами батареи. Накапливаясь на коллекторном электроде, отрицательно заряженные электроны заряжают и его. Поскольку электроны уходят с электрода радиоактивного источника, на нем остается положительный заряд. В результате между двумя электродами возникает ЭДС. Если к двум зажимам присоединить провод, то по нему пойдет ток от коллектора к радиоактивному источнику, так же, как и в случае ЭХГ. Ядерные батареи электропитания отличаются очень большими ЭДС, которые можно понижать при помощи электросхем деления напряжения. Такие генераторы тока применяются на искусственных спутниках Земли и межпланетных станциях, а также в труднодоступных точках на Земле для питания научной аппаратуры, длительное время работающей автоматически. |
