Предмет
|
Химия
|
Класс 9
|
Тема урока
|
Электролитическая диссоциация
|
Педагогические цели урока
|
1.Создание условий для освоения учащимися интерактивных технологий обучения.
2.Создание условий для формирования личности ребенка путем его взаимодействия со сверстниками
3.Создание условия для развития и совершенствования УУД.
|
Задачи урока
|
Освоить материал по теме электролитическая диссоциация.
Развить умение работать коллективно.
Развить умения анализировать, сравнивать и систематизировать полученную информацию.
|
Тип урока
|
Урок комплексного, практического применения знаний и умений
|
Планируемые образовательные результаты
|
Предметные
|
Метапредметные
|
Личностные
|
Научиться:
- объяснять процесс электролитической диссоциации;
-записывать молекулярные уравнения химических реакций;
- записывать полные и сокращенные ионные реакции;
- сильные и слабые электролиты;
-записывать ступенчатую диссоциацию веществ;
Знать:
- условия протекания реакций замещения и ионного обмена;
|
Регулятивные: Научиться самостоятельно выстраивать план решения поставленной учителем задачи.
Познавательные: Научиться использовать интернет-источники информации для решения познавательных и учебных задач.
Коммуникативные: Научиться полно и точно выразить свои мысли, мнение.
|
Формирование мотивации к обучению и воспитанию, стремления к саморазвитию.
|
Условия реализации урока
|
Информационные ресурсы (в том числе ЦОР и Интернет):
https://interneturok.ru/lesson/chemistry/9-klass/bhimicheskaya-svyaz-elektroliticheskaya-dissociaciyab/elektroliticheskaya-dissotsiatsiya
https://foxford.ru/wiki/himiya/teoriya-elektroliticheskoy-dissotsiatsii-ted
https://scienceforyou.ru/teorija-dlja-podgotovki-k-egje/reakcii-ionnogo-obmena
- электронный тест, созданный в программе Google Forms
https://forms.gle/BKk2Qyq1KsYQWXPf8
|

Учебная литература:
Химия. 9 класс. Учебник - Габриелян О.С.
Химия. Уроки в 9 классе: пособие для учителя / Н. Н. Гара. — 2-е изд., перераб. — М. : Просвещение
Пособие по химии для поступающих в вузы - Хомченко Г.П.
Хомченко И. Г. Сборник задач и упражнений no химии для средней школы.- 2-е изд., испр. и доп.- М.: РИА «Новая волна»: Издатель Умеренков - 214 с.
|

Оборудование:
Экран, проектор, компьютер, набор реактивов, прибор для демонстрации электропроводимости веществ, карточки с индивидуальными заданиями.
|
Основные понятия: «электролит», «неэлектролит», «электролитическая диссоциация», «электрический ток».
|
Технологии и приемы: здоровьесберегающая технология, технология смешанное обучение, проблемное обучение, домашняя самостоятельная работа с видеофрагментами и литературой, составление опорного конспекта.
|
Модель смешанного обучения: перевернутый класс.
|
Форма проведения урока: Эвристическая беседа, групповая работа, лабораторная работа.
|
Самоятоятельное изучение материала дистанционно до начала урока:
1. https://interneturok.ru/lesson/chemistry/9-klass/bhimicheskaya-svyaz-elektroliticheskaya-dissociaciyab/elektroliticheskaya-dissotsiatsiya
2. https://foxford.ru/wiki/himiya/teoriya-elektroliticheskoy-dissotsiatsii-ted
3. https://scienceforyou.ru/teorija-dlja-podgotovki-k-egje/reakcii-ionnogo-obmena
|
1. Этап: Мотивация к учебной деятельности. (3 - 5 мин)
Цель: мотивировать учащихся к активной познавательной учебной деятельности
|
Деятельность
учителя
|
Задания для учащихся, выполнение которых приведёт к достижению запланированных результатов
|
Деятельность
учеников
|
Предметные
результаты
|
УУД
|
Приветствие, учитель сообщает тему урока, проверяет степень подготовленности учащихся к уроку. Мотивация детей к активному включению в учебную деятельность.
|
Добрый день, ребята, сегодня нас ждет увлекательное занятие, на котором мы проведем занятный эксперимент. В начале урока предлагаю вам решить небольшой ребус для разминки.

После выполнения задания учитель предлагает ребятам сформулировать тему урока и отразить основные понятия, необходимые для усвоения темы. Где данная тема может применяться по отношению к ранее изученным темам?
|
Разгадывают ребус (слово: электролит).
Ребята открывают конспекты, подготовленные дома, называют тему рока и дают основные понятия и термины, которые, по их мнению, являются главными в изучении темы.
Ребята отвечают, что данная тема важна при грамотной записи молекулярных и сокращенных ионных уравнений.
|
Освоение химической терминологии по теме «электролитическая диссоциация»
|
Познавательные:
- предоставлять информацию в виде конспектов;
- обобщать понятия.
Личностные:
- Умение открыто и грамотно высказывать свое мнение.
|
2. Этап: Актуализация субъектного опыта учащихся. (5 - 7 мин.)
Цель: актуализировать мыслительные операции, необходимые для плодотворной работы на уроке, организовать побуждающий диалог по объяснению нового знания. Соотнесение нового знания с тем, что уже известно.
|
Деятельность
учителя
|
Задания для учащихся, выполнение которых приведёт к достижению запланированных результатов
|
Деятельность
учеников
|
Предметные
результаты
|
УУД
|
Рассказывает о дальнейшем плане проведения урока. Задает вопросы по теме урока, чтобы выявить пробелы в знаниях учащихся. Комментирует дальнейшую работу, делит ребят на 2 группы.
|
Что такое электролиты? Как протекает процесс электролитической диссоциации? Какие электролиты относятся к слабым, а какие к сильным? При записи сокращенных ионных уравнений какие вещества записываются в молекулярном виде?
|
Задают вопросы по домашнему заданию, отвечают на вопросы учителя, используя составленный дома конспект. Объединяются в группы, слушают, в чем заключается предстоящая работа в группах. Ребята в микрогруппах обсуждают предстоящее задание.
|
Формирование научных представлений в области общей химии.
|
К: умение взаимодействовать со старшими и сверстниками.
Р: умение выстраивать план работы.
|
3. Этап: Организация познавательной деятельности. (30-32 минуты)
Цель: развитие предметных и метапредметных умений в области химии через работу в микрогруппах и выполнение лабораторной
|
Проведение демонстрационного опыта “Определение электропроводности растворов неэлектролитов/ электролитов”
|
Условие проведения опыта, которое ребятам необходимо записать:
Оборудование: Установка для испытаний веществ на электропроводность (выпрямитель, электроды, лампа накаливания), химические стаканы.
Техника безопасности. Необходимо соблюдать правила работы с кислотами и правила обращения с электроприборами. Опыт проводить с напряжением не более 42 В.
Описание опыта: опыт реализуется посредством использования прибора для определения электропроводности, который представляет собой электрическую цепь, состоящую из последовательно соединённых: источника тока, эбонитовой пластинки с вмонтированными в неё угольными электродами, и лампы. Электроды сперва помещают в воду, затем в сухой хлорид натрия, а по завершении в раствор хлорида натрия. Лампочка загорается только в случае раствора хлорида натрия, являющегося проводником электрического тока.

|

H2O
Ученики записывают ход эксперимента и делают зарисовку установки, записывают уравнение диссоциации протекающей реакции.
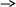 NaCl р-р Na+ + Cl- NaCl р-р Na+ + Cl-
|
Формирование умений называть признаки и условия протекания химических реакций;
Формирование умений выявлять признаки, свидетельствующие о протекании химической реакции при выполнении химического опыта;
Формирование умений составлять уравнения химических реакций;
Формирование умений соблюдать правила техники безопасности при реализации химических экспериментов;
Формирование умений пользоваться лабораторным оборудованием и посудой.
|
К:
Умения принимать позицию собеседника, понимая позицию другого, различать в его речи: мнение (точку зрения), доказательство (аргументы), факты;
Умения строить позитивные отношения в процессе учебной и познавательной деятельности;
Умения организовывать учебное взаимодействие в группе (определять общие цели, распределять роли, договариваться друг с другом и т. д.);
Умения осознанно использовать речевые средства в соответствии с задачей коммуникации для выражения своих чувств, мыслей и потребностей для планирования и регуляции своей деятельности;
|
Ребята получают карточки с одним проблемным вопросом и условия, для составления задачи.
Пока первая группа проделывает химический опыт с учителем, вторая группа составляет задачу и ее решение. Затем наоборот.
|
Карточка заданий для первой группы
Ребятам необходимо ответить на один из проблемных вопросов, попытаться привести химические опыты и сформулировать развернутый ответ (изобразить схему распада на ионы гидроксида натрия) , а также составить текст задачи по приведенным критериям:
Твердые щелочи изменяют окраску фенолфталеина? (предоставить видеоотчет)
(Опыт проводится в присутствии учителя: В одну СУХУЮ ПРОБИРКУ насыпают немного твердого натрия или калия и добавляют каплю фенолфталеина. Тот же опыт проделывают с водным раствором щелочи).
1) Условие составления задачи для первой группы:
• в ходе реакции образуется осадок, массу которого необходимо вычислить;
• известна масса одного из исходных веществ, которая содержит некоторый % примесей;
• привести уравнение химической реакции, предоставить подробный ход решения задачи и ответ.
Карточка задний для второй группы
Ребятам необходимо ответить на один из проблемных вопросов, попытаться привести химические опыты и сформулировать развернутый ответ, а также составить текст задачи по приведенным критериям:
1) Условие составления задачи для второй группы:
• в ходе реакции выделяется газообразное вещество, объем которого необходимо найти;
• известна масса раствора и его массовая доля одного из исходных веществ;
• привести уравнение химической реакции, предоставить подробный ход решения задачи и ответ.
Будет ли железо взаимодействовать с раствором сульфата меди(II), если соль растворена не в воде, а в ацетоне? (записать уравнение химической реакции и предоставить видеоотчет)
(В две пробирки наливают раствор сульфата меди (II). В одну из пробирок прилить 1 мл ацетона, а в другую - 1 мл воды. Встряхнуть обе пробирки. В растворы опустить 2-3 гранулы цинка).
Затем ребята предоставляют условия задач второй команде и пытаются их решить (максимум 7 минут)
|
Ученики первой группы проводят химический опыт, в результате фенолфталеин окрашивается в малиновый цвет при добавлении к водному раствору щелочи и не окрашивается при добавлении к тв. щелочи. Ученики это объясняют тем, что электролиты обладают своими свойствами только в водной среде. Приводят уравнение диссоциации:

H2O
 NaCl р-р Na+ + Cl- NaCl р-р Na+ + Cl-
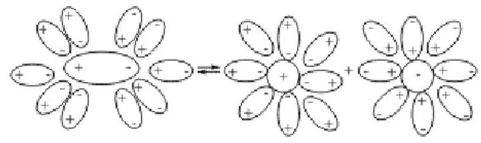
После выполнения лабораторного опыта ребята приступают к составлению задачи. Так как им попалась задача на выпадение осадка и примеси, то они понимают, что будут использовать следующие формулы для решения задач:
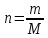 ; ;
m(чис-го)=m(в-ва) – (m*Wприм.)
Втора группа, ознакомившись с условиями составления задачи, выбирают следующие формулы для решения задачи:
n=m/M;
m(в-ва)=Wр-ра*m(р-ра);
V=Vm * n
Далее группа выполняет эксперимент, в результате которого в пробирке с водой образуется на дне пробирки медь, а в пробирке с ацетоном реакция не протекает. Ребята делают выводы о том, что вещества с ковалентной полярной связью (кислоты) и ионной связью (щелочи, соли) проявляют электролитические свойства только в водных растворах.
В итоге ребята оценивают качество составленных задач, производят взаимную проверку решения задач. Делятся знаниями, полученными в ходе эксперимента. Обе группы приходят к выводу, что электролиты проявляют свои свойства только в водных растворах.
|
|
П:
Умения определять обстоятельства, которые предшествовали возникновению связи между явлениями, из этих обстоятельств выделять определяющие, способные быть причиной данного явления, выявлять причины и следствия явлений;
Умения излагать полученную информацию, интерпретируя ее в контексте решаемой задачи;
Умения выявлять и называть причины события, явления, в том числе возможные / наиболее вероятные причины, возможные последствия заданной причины, самостоятельно осуществляя причинно-следственный анализ;
Р:
Умения определять и реализовывать необходимые действие(я) в соответствии с учебной и познавательной задачей и составлять алгоритм их выполнения;
Умения обосновывать и осуществлять выбор наиболее эффективных способов решения учебных и познавательных задач;
Умения соотносить свои действия с планируемыми результатами, осуществлять контроль своей деятельности в процессе достижения результата, определять способы действий в рамках предложенных условий и требований, корректировать свои действия в соответствии с изменяющейся ситуацией.
|
4. Этап: Итог урока. (5 мин.)
Цель: обобщить знания, полученные на уроке. Организовать взаимооценку выполнения заданий. Обсудить домашнее задание, которое будет закреплять полученные на уроке знания (выполнение онлайн-теста). https://forms.gle/BKk2Qyq1KsYQWXPf8. Обсудить тему следующего урока.
|
Подвести итоги занятия.
Дать ссылку на тест.
Обсудить следующую тему рока, дать необходимый для изучения материал.
Организовать рефлексию:
Ребята оставляют на партах красные, желтые и зеленые карточки, давая таким образом оценку уроку.
|
Что вы изучили сегодня на уроке?
Что показалось наиболее сложным?
Какие вопросы вы бы хотели еще отработать?
|
Записывают в дневнике задания
Учащиеся оставляют цветные карточки
|
Умение давать развернутые ответы, опираясь на знания в области химии.
|
Р: уметь проводить самооценку и давать объективную оценку происходящему
|
 Скачать 202.27 Kb.
Скачать 202.27 Kb.