электрозис. электролиз краткое описание. Электролиз окислительновосстановительный процесс, вызванный действием постоянного тока. Слово электролиз означает разложение под действием электричества. Электролиз расплавов
 Скачать 84.11 Kb. Скачать 84.11 Kb.
|
|
Электрический ток вызывает окислительно-восстановительные реакции в растворах и расплавах электролитов. Впервые электрический ток в химии использовал английский учёный Гемфри Дэви. Подвергая электролизу расплавы различных соединений, он открыл шесть неизвестных до него элементов, что стало одним из самых выдающихся событий в истории открытия новых химических элементов. Электролиз окислительно-восстановительный процесс, вызванный действием постоянного тока. Слово «электролиз» означает «разложение под действием электричества».  Электролиз расплавов Электролиз расплавовЭлектролиз расплавов рассмотрим на примере хлорида натрия (рис. 1). В расплаве хлорид натрия диссоциирует, образуя катионы и анионы хлора : На катоде всегда происходит процесс восстановления, а на аноде — процесс окисления. Таким образом, при электролизе расплава хлорида натрия на катоде происходит процесс восстановления катионов натрия, а на аноде — процесс окисления анионов хлора: Катодная реакция: || Анодная реакция: || Суммарный процесс: — расплав 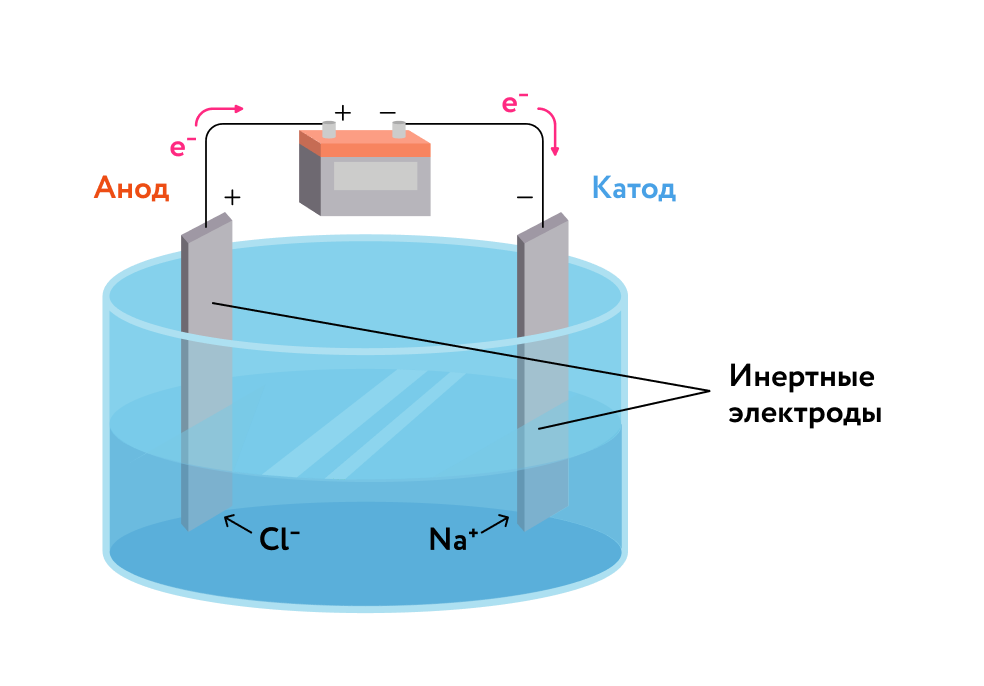 Рис. 1. Электролиз расплава хлорида натрия Электролиз расплавов солей (чаще всего хлоридов) используется в промышленности для получения щелочных и щёлочноземельных металлов.  Электролиз растворов Электролиз растворовЭлектролиз растворов — более сложный процесс, так как кроме ионов металла и кислотного остатка в растворе присутствуют молекулы воды и ионы и , которые также могут участвовать в окислительно-восстановительном процессе при прохождении электрического тока.  Правила для определения продуктов электролиза Правила для определения продуктов электролизаДля правильного нахождения продуктов, образующихся на электродах при электролизе водных растворов электролитов, следует руководствоваться следующими основными правилами.  1. На катоде восстанавливается наиболее сильный окислитель. 1. На катоде восстанавливается наиболее сильный окислитель.Процессы на катоде зависят от положения металла в электрохимическом ряду напряжений. Если металл расположен в ряду напряжений до алюминия включительно, то на катоде будет выделяться только водород вследствие восстановления молекул воды: . Если катион металла находится в ряду напряжений между алюминием и водородом, то на катоде одновременно восстанавливаются и ионы металла, и молекулы воды. Если катион металла находится в ряду напряжений после водорода, то на катоде идёт только процесс восстановления катионов металла. Если в растворе одновременно находятся катионы нескольких металлов, то они будут выделяться на катоде в порядке увеличения их активности, т. е. справа налево в соответствии с положением в электрохимическом ряду напряжений.  2. На аноде окисляется наиболее сильный восстановитель. 2. На аноде окисляется наиболее сильный восстановитель.Процессы на аноде зависят от материала анода и от природы аниона. Если анод растворимый (железо, медь, цинк, серебро и др.), то независимо от природы аниона идёт окисление металла анода: . Если анод нерастворимый, т. е. инертный (уголь, графит, платина, золото), то при электролизе растворов солей бескислородных кислот, кроме фторидов, на аноде идёт процесс окисления аниона, а при электролизе растворов солей кислородсодержащих кислот и фторидов на аноде выделяется кислород вследствие окисления молекул воды: . Анион при этом не окисляется, оставаясь в растворе. При электролизе растворов щелочей происходит окисление гидроксид-ионов: . Рассмотренные правила обобщены в таблицах.  Катодные процессы при электролизе растворов солей Катодные процессы при электролизе растворов солей
 Анодные процессы при электролизе водных растворов Анодные процессы при электролизе водных растворов
 Примеры процессов электролиза Примеры процессов электролизаРассмотрим сначала примеры процессов электролиза растворов различных веществ на инертных электродах, руководствуясь перечисленными правилами.  Пример 1. Электролиз водного раствора серной кислоты Пример 1. Электролиз водного раствора серной кислотыНапишем уравнения катодной и анодной реакций и уравнение реакции суммарного процесса: Катодная реакция: |2| Анодная реакция: |1| анионы не окисляются Суммарный процесс: Таким образом, на катоде выделяется водород, а на аноде — кислород. Процесс электролиза в данном случае сводится к разложению молекул воды.  Пример 2. Электролиз водного раствора гидроксида калия Пример 2. Электролиз водного раствора гидроксида калияНапишем уравнения катодной и анодной реакций и уравнение реакции суммарного процесса: Катодная реакция: |2| Анодная реакция: |1| Суммарный процесс: Таким образом, на катоде выделяется водород, а на аноде — кислород. Процесс электролиза в данном случае сводится к разложению молекул воды.  Пример 3. Электролиз водного раствора сульфата натрия Пример 3. Электролиз водного раствора сульфата натрияНапишем уравнения катодной и анодной реакций и уравнение реакции суммарного процесса: Катодная реакция: |2| Анодная реакция: |1| анионы не окисляются Суммарный процесс: Таким образом, на катоде выделяется водород, а на аноде — кислород. Процесс электролиза в данном случае сводится к разложению молекул воды.  Пример 4. Электролиз водного раствора нитрата меди() на инертных электродах Пример 4. Электролиз водного раствора нитрата меди() на инертных электродахНапишем уравнения катодной и анодной реакций и уравнение реакции суммарного процесса: Катодная реакция: |2| Анодная реакция: |1| анионы не окисляются Суммарный процесс: Таким образом, на катоде выделяется медь, а на аноде — кислород. В анодном пространстве накапливается азотная кислота.  Пример 5. Электролиз водного раствора бромида меди() на инертных электродах Пример 5. Электролиз водного раствора бромида меди() на инертных электродахНапишем уравнения катодной и анодной реакций и уравнение реакции суммарного процесса: Катодная реакция: |1| Анодная реакция: |1| Суммарный процесс: Таким образом, на катоде выделяется медь, а на аноде — бром.  Пример 6. Электролиз водного раствора хлорида натрия на инертных электродах Пример 6. Электролиз водного раствора хлорида натрия на инертных электродахНапишем уравнения катодной и анодной реакций и уравнение реакции суммарного процесса: Катодная реакция: |1| Ионы не восстанавливаются Анодная реакция: |1| Суммарный процесс: Таким образом, на катоде выделяется водород, а на аноде — хлор. В катодном пространстве накапливается гидроксид натрия. Какими будут продукты электролиза раствора в отсутствие мембраны? В результате взаимодействия между образующимися на катоде и аноде продуктами электролиза возможны следующие процессы: в холодном растворе: ; в горячем растворе: Электролиз водного раствора хлорида натрия в отсутствие мембраны является промышленным способом получения гипохлорита и хлората натрия.  Электролиз водных растворов солей карбоновых кислот Электролиз водных растворов солей карбоновых кислотВ результате электролиза водных растворов солей щелочных металлов карбоновых кислот происходит образование углеводородов вследствие рекомбинации углеводородных радикалов. Впервые этот процесс осуществил Г. Кольбе (). В общем виде электролиз солей карбоновых кисло можно записать следующим образом: Катодная реакция: Анодная реакция: Суммарный процесс: в молекулярном виде: (если катодное и анодное пространство разделены), или: (если катодное и анодное пространство не разделены) Таким образом, при электролизе солей карбоновых кислот на катоде образуется водород, а на аноде — углеводород и углекислый газ; в катодном пространстве накапливается щёлочь. В случае если катодное и анодное пространства не разделены, углекислый газ взаимодействует со щёлочью, в результате чего образуется гидрокарбонат: .  Пример 7. Напишите уравнения реакций, протекающих на катоде и аноде, и молекулярное уравнение электролиза водного раствора ацетата натрия на инертных электродах Пример 7. Напишите уравнения реакций, протекающих на катоде и аноде, и молекулярное уравнение электролиза водного раствора ацетата натрия на инертных электродахВ случае электролиза водного раствора ацетата натрия будут происходить следующие процессы: Катодная реакция: Анодная реакция: Суммарный процесс: в молекулярном виде: или  Электролиз растворов солей с растворимым анодом Электролиз растворов солей с растворимым анодомВ качестве растворимых анодов используют и другие металлы. При этом металл анода окисляется (растворяется), а образующиеся катионы металла перемещаются к катоду и восстанавливаются на нём до металла. Таким образом, металл растворимого анода осаждается на катоде.  Пример 8. Электролиз водного раствора сульфата меди() с медным анодом Пример 8. Электролиз водного раствора сульфата меди() с медным анодомНа катоде и аноде происходят следующие процессы: Катодная реакция: |1| Анодная реакция: |1| Суммарный процесс в этом случае записать нельзя. Электролиз с растворимым анодом находит применение для электролитической очистки металлов (электролитическое рафинирование). Так, из черновой меди, содержащей примеси серебра, цинка и железа, изготавливают анод и проводят электролиз сульфата меди() с растворимым анодом. В качестве катода используется медная пластина из чистого металла.  Количественное описание процессов электролиза. Закон Фарадея Количественное описание процессов электролиза. Закон Фарадея Количественно процессы электролиза можно охарактеризовать, используя законы Фарадея. Если учесть, что электроны являются участниками электродных реакций, то к ним можно применить законы химической стехиометрии. Число молей электронов пропорционально заряду, прошедшему через раствор: , где — заряд, прошедший через раствор или расплав; — сила тока, А; — продолжительность электролиза, с; — постоянная Фарадея, Клмоль | |||||||||||||||||||||||
