Электромагнитный спектр и его характеристика. Электромагнитный спектр и его характеристика
 Скачать 75.38 Kb. Скачать 75.38 Kb.
|
|
Электромагнитный спектр и его характеристика Электромагнитное излучение имеет двойственную природу: волновую и корпускулярную. Скорость распространения Электромагнитных волн в вакууме является константой, численное значение которой составляет 3·1010 см/сек. Хотя эта величина и является постоянной, частота и длина волны излучения могут быть переменными. Между этими величинами существует зависимость, выражаемая уравнением: С = λ · ν (1), где С – скорость света в вакууме; ν – частота колебаний, имеет размерность С-1 или Гц (герц); λ – длина волны излучения, выражаемая в долях метра: см, мкм (10-6), нм (10-9 м) и ангстремах (Å = 10-10 м); В видимой областях длину волны обычно выражают в нм (нанометрах), в ИК-области – мкм (микрометрах) или волновых числах, ν’. Волновое число – это число волн, приходящееся на 1 см длины светового луча, оно прямо пропорционально частоте, а, значит, и энергии квантов: ν’ = 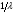 = = 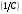 · ν (2) · ν (2)ν’ имеет размерность см-1 (обратные сантиметры). Из уравнения (1) следует, что существует обратно пропорциональная зависимость между частотой и длиной волны. Испускание и поглощение электромагнитного излучения происходит квантами, энергия которых описывается уравнением: ΔЕ = h · ν = h · 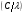 (3), где (3), гдеh – постоянная Планка (6,5 · 10-27 эрг/сек). Из уравнения (3) следует, что энергия кванта пропорциональна частоте колебаний и обратно пропорциональна длине волны. Каждая основная область электромагнитного спектра связана, по крайней мере, с одним типом переходов. Например, поглощение в видимой и ультрафиолетовой областях приводит к переходам электронов из основного электронного состояния в возбужденное электронное состояние, а поглощение инфракрасного излучения определенной частоты вынуждает связанные атомы колебаться относительно их средних положений. Как происходят взаимодействие вещества с электромагнитным излучением? В соответствии с квантово-механическими представлениями электроны в молекулах органических соединений могут располагаться на связывающих, несвязывающих и разрыхляющих орбиталях. На связывающих орбиталях располагаются электроны, участвующие в образовании валентных связей – σ, π-электроны. σ-электроны участвуют в образовании простых (одинарных связей) π-кратных (двойных и тройных). На несвязывающих орбиталях располагаются электроны, не участвующие в образовании химических связей – это n-электроны; ими являются свободные электроны пары гетероатомов – O, N, Hal. Расположение электронов на связывающих и несвязывающих орбиталях соответствует основному состоянию молекулы. Нахождение электронов на разрыхляющих – возбужденному, которое возникает при поглощении молекулой определенного количества энергии. При возбуждении возможен переход электронов с одних орбиталей на другие, что можно выразить схемой, представленной на рис. 1. Рис. 1. Схема энергетических электронных уровней и возможных электронных переходов С точки зрения квантовой механики разрешенными являются следующие переходы: σ → σ* n → σ*π → π*n → π* Различные электронные переходы требуют неодинаковой энергии, поэтому полосы в спектре поглощения располагаются при разных длинах волн. Наибольшей энергии требуют σ → σ* переход, связанный с возбуждением внутренних электронов σ- связи. Он соответствует поглощению в далекой УФ-области, такие переходы наблюдаются в насыщенных соединениях – алканах (область 160-180 нм). Переход n → σ* связан уже с меньшими затратами энергии, полосы поглощения располагаются в области 200-300 нм. Еще меньшая энергия требуется для перехода на разрыхляющих π* - орбиталь; переходы n → π* и π → π* встречаются в молекулах соединений с сопряженными связями, в том числе в молекулах ароматических соединений. Таким образом, в общем случае энергия разрешенных правилами отбора электронных переходов системы возрастает в последовательности: n → π* < π → π* < n → σ* < σ → σ* Следовательно, существенными элементами, обуславливающими наличие электронных спектров органических молекул, является кратная связь и неподеленная электронная пара. Их наличие, многочисленные сочетания в молекулах с разнообразными заместителями объясняют совокупность электронных спектров органических соединений. Группировки, содержащие в своем составе сопряженные двойные связи и неподеленные пары электронов, называются хромофорами. Электронные переходы, вызванные поглощением определенных квантов световой энергии, характеризуются наличием определенных полос поглощения в электронных спектрах атомов или молекул. Природа полос поглощения в УФ (200-400 нм) и видимой (400-800 нм) областях спектра одинакова и связана, главным образом, с числом и расположением электронов в поглощающих молекулах и ионах. Вещества, поглощающие только в УФ-области, для человеческого глаза являются бесцветными. Путем изучения модельных соединений были определены длины волн УФ- и видимого света, поглощаемые тем или иными структурными элементами (хромофорами). Ориентировочные значения максимумов поглощения некоторых хромофоров приведены в табл. 2. На положение максимума поглощения хромофоров влияют и другие группы, усиливающие светопоглощение хромофорами. Такие группы называются ауксохромами. Они могут быть электродонорными (-ОН, -NН2, - ОСН3, -NHCH3, -N(СН3)2) и электроноакцепторными (-SO2NH2, -COOH, -NO2, простая и сложноэфирная группы). При облучении исследуемого вещества электромагнитным излучением с постепенно изменяющейся λ (или энергией) можно проследить изменение интенсивности его поглощения. Графическое изображение этой зависимости – называется спектром. Он может быть построен как график зависимости оптической плотности (D), коэффициента поглощения (или его логарифма) от длины волны света, падающего на исследуемый образец. Область интенсивного поглощения в нем называется полосой, максимумом поглощения. Длина волны, при которой наблюдается максимум, обозначается λmax, ее называют также аналитической длиной волны. В спектрах может наблюдаться от одного до нескольких максимумов, соответствующих различным типам электронных переходов. Поглощение называют характеристическим, если оно вызывается определенной группой атомов, причем характер поглощения относительно мало изменяется с изменением остальной части молекулы. Наличие в спектрах характеристических полос поглощения позволяет обнаружить в веществе определенные структурные элементы и, таким образом, сделать вывод о строении органического соединения. Вид спектральной кривой зависит от растворителя, от наличия в молекуле исследуемого вещества тех или иных заместителей, от поведения вещества в растворе (в частности, от способности образовывать внутри- и межмолекулярные водородные связи, от наличия или отсутствия динамической изомерии и т.д.). Все эти факторы могут вызвать сдвиг λmax и изменение интенсивности поглощения. Для характеристики подобных изменений применяют специальные термины. Если полоса поглощения смещается в сторону более длинных волн, говорят о батохромном смещении или углублении окраски (красное смещение), а если полоса поглощения сдвигается в сторону более коротких волн, эффект называется гипсохромным или повышением окраски (голубое или синее смещение). Спектрофотометрия в видимой области спектра В спектрофотометрическом методе используются приборы – спектрофотометры (СФ-26, СФ-46 и др.). В качестве источника излучения для определения окрашенных веществ в видимой области спектра также используются лампы накаливания. Излучение от источника света попадает в монохроматор, позволяющий получить луч света определенной длины волны. Луч проходит через кювету с исследуемым веществом и далее через фотоэлементы на регистрирующее устройство (потенциометр). В современных регистрирующих приборах световой поток делится на два одинаковых луча, один из которых проходит через исследуемый раствор, а другой – через растворитель, причем уравнивание интенсивностей, прошедших через кювету световых потоков, производится автоматически. Типы реакций, применяемых в фотометрии. Требования к ним В видимой области спектра вещества поглощают электромагнитное излучение либо за счет собственной окраски (калия перманганат, фурацилин, рибофлавин, этакридина лактат и др.), либо за счет образования окрашенных соединений. Образование окрашенных соединений осуществляется с помощью различных типов реакций, к которым предъявляются определенные требования: - при взаимодействии определяемого вещества цветореагентом должно получиться устойчивое окрашенное соединение, имеющее постоянный состав; - реакция должна быть стехиометричной; - реакция должна протекать по возможности быстро; - она должна быть избирательной и чувствительной; - используемые реагенты должны быть доступны, безвредны и экономически рентабельны. Для получения окрашенных соединений используются реакции: - получения аци-солей с натрия гидроксидом на препараты, содержащие нитрогруппу (фурацилин, фуразолидон, левомицетин, нитроксолин): 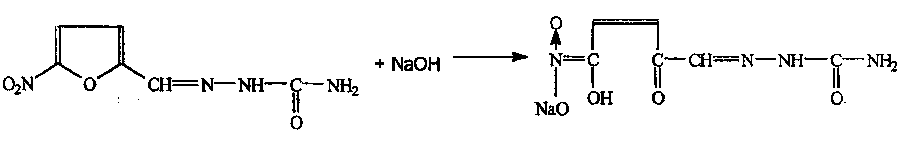 - диазотирования с последующим азосочетанием на препараты, содержащие первичную ароматическую аминогруппу (анестезин, новокаин, сульфаниламиды и др.): 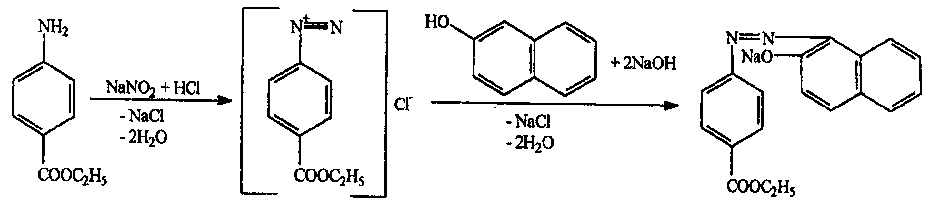 - получение гидроксаматов меди и железа для препаратов, содержащих сложноэфирную (новокаин), лактонную (пилокарпин), лактамную (бензилпенициллина калиевая и натриевая соли) группы: 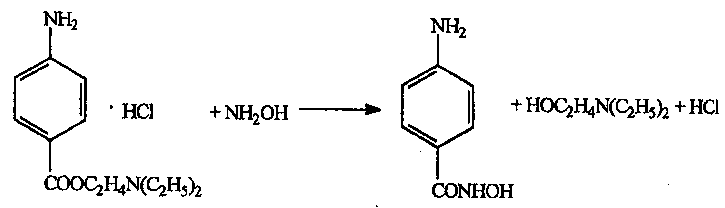 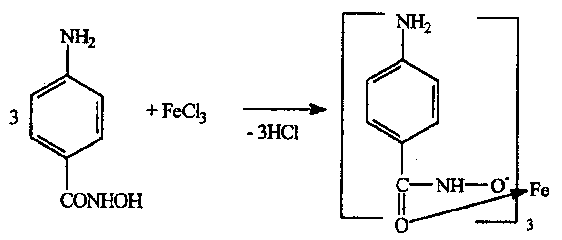 - комплексообразования с железа (ΙΙΙ) хлоридом, железоаммониевыми квасцами (кислота салициловая), с меди (ΙΙ) сульфатом (производные барбитуровой кислоты, глицерин): 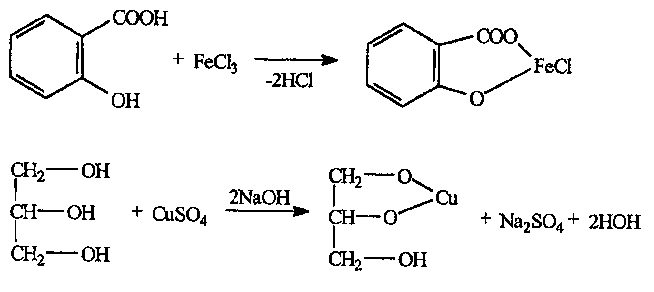 |
