Электроотрицательность атомов химических элементов. Электроотрицательность химических элементов
 Скачать 167 Kb. Скачать 167 Kb.
|
|
Тема: Электроотрицательность химических элементов. Цель: познакомить учащихся с понятием «электроотрицательность». Планируемые результаты: Предметные: формулировать определения понятия «электроотрицательность»; устанавливать внутри- и межпредметные связи; составлять сравнительные и обобщающие таблицы, схемы. Метапредметные: П.: умения сравнивать и анализировать информацию; делать выводы; давать определения понятиям; работать по заданному плану, алгоритму; Р.: умения самостоятельно приобретать новые знания; самостоятельно организовывать собственную учебную деятельность; К.: умения взаимодействовать с одноклассниками; работать в коллективе с выполнением различных ролей. Личностные: умение адекватно выражать свое отношение к фактам и явлениям окружающей действительности, к прочитанному, увиденному, услышанному. Оборудование: учебники, тетради, таблица ПСХЭ. ХОД УРОКА I. ОРГАНИЗАЦИЯ НАЧАЛА УРОКА: II. ПРОВЕРКА ДОМАШНЕГО ЗАДАНИЯ И АКТУАЛИЗАЦИЯ ЗНАНИЙ: Устный опрос по прошлой теме. III. ИЗУЧЕНИЕ НОВОГО МАТЕРИАЛА И ПЕРВИЧНЫЙ КОНТРОЛЬ: Мотивация: Демонстрируем учащимся любой предмет и задаем вопрос: «Почему этот предмет (тело) может существовать? Почему оно не рассыпается? Почему могут существовать другие предметы и мы с вами?». В процессе беседы осуществляем совместное целеполагание и определяем тему урока. Напомнить (обобщить устные ответы учащихся): - понятие химической связи; - причина возникновения химической связи; - типы химической связи. 1. Электроотрицательность химических элементов: Постановка проблемы: одинаково ли воздействие атомов на общую электронную пару. Атомы разных элементов по-разному относятся к общим электронным парам: те неметаллы, что сильнее, будут сильнее оттягивать к себе общие электронные пары, совсем как у Крылова: «У сильного всегда бессильный виноват». Эта способность атомов химических элементов оттягивать к себе общие электронные пары называется электроотрицательностью (ЭО). ЭО — это условная, безразмерная характеристика именно атома элемента. Численные значения ЭО атомов химических элементов приведены в Периодической системе элементов. 2. Зависимость ЭО элемента от положения его в ПСХЭ: В периодах электроотрицательность элементов возрастает с увеличением заряда ядер атомов (т. е. слева направо), а в главных подгруппах — снизу вверх. Чем больше ЭО элемента, тем сильнее его атомы притягивают электроны и труднее их отдают. Наибольшую электроотрицательностьность среди элементов имеют атомы фтора (4,1), а наименьшую — атомы цезия, франция (0,86). У атомов металлов электроотрицательность обычно меньше 1,8—2,0, а у атомов неметаллов — больше 1,8—2. Общие электронные пары смещаются в сторону более электроотрицательного элемента, и чем больше разность величин ЭО (ΔЭО) связанных атомов, тем больше полярность связи. Основной особенностью ковалентной полярной связи является то, что она образуется между атомами различных неметаллов. Как, например, в молекуле HCl. У атома водорода в нашем случае один неспаренный электрон, ему до завершения внешнего энергетического уровня не хватает одного электрона. У атома хлора семь электронов на внешнем уровне, один из которых неспаренный, ему тоже не хватает одного электрона до завершения уровня. Тогда атом водорода и атом хлора объединяют свои неспаренные электроны и между ними образуется химическая связь. Эту связь тоже можно изобразить в виде чёрточки. Образовавшаяся общая электронная пара не в равной степени будет принадлежать этим атомам. Для этой оценки используют понятие электроотрицательности. Электроотрицательность (ЭО) – способность атомов химического элемента притягивать к себе общие электронные пары, участвующие в образовании химической связи. 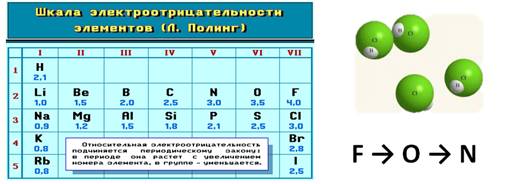 Электроотрицательность служит характеристикой металличности и неметалличности химических элементов. Первое место по электроотрицательности занимает фтор, он же самый неметаллический, второе место занимает кислород и третье – азот. Т.к. электроотрицательность – мера металличности, то она, как правило, по периодам и группам изменяется в той же последовательности, т.е. в периодах слева направо увеличивается, а в группах сверху вниз уменьшается. 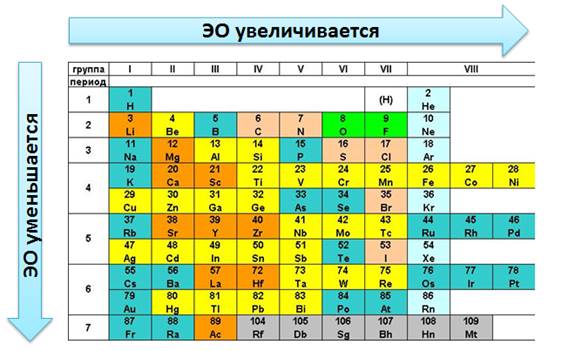 Посмотрев на молекулу HCl, можно с уверенностью определить, что в данной молекуле более электроотрицательный атом хлора, поэтому общая электронная пара будет смещена больше к нему. В результате этого, на атомах появляются частичные заряды. Смещение электронной плотности показывается стрелкой, а частичные заряды буквой дельта. В молекуле появляется два полюса: положительный и отрицательный, поэтому такую связь называют полярной. 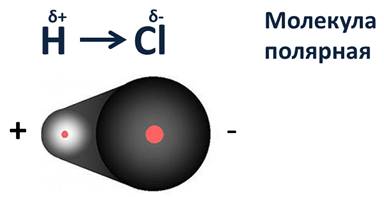 Механизм образования связей в молекуле воды (Н2О) Водород – элемент IA группы, значит, у него один электрон, который участвует в образовании химической связи. У второго атома водорода тоже один электрон, который участвует в образовании химической связи. Атом кислорода находится в VIA группе, поэтому у него на внешнем уровне 6 электронов, а число неспаренных находим по формуле 8 – 6 = 2. Эти два электрона и будут участвовать в образовании химической связи. Неспаренные электроны объединяются и образуется две общие электронные пары. Из этих атомов более электроотрицательный кислород, поэтому именно к нему будут смещены общие пары электронов и молекула будет полярной, связь – ковалентной полярной. 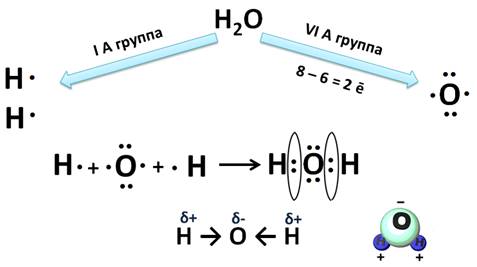 Доказано, что молекула воды на самом деле имеет не линейное строение, а угловое. В этой молекуле атом водорода связан только одной связью с кислородом, а кислород двумя связями с атомами водорода. Это число ковалентных связей, которыми атом одного химического элемента связан с атомами этого же или других элементов, называется валентностью. Условно валентность обозначается черточкой, когда необходимо записать структурные формулы. Например, в молекуле NH3, атом азота связан с тремя атомами водорода. Поэтому говорят, азот трехвалентен. В молекуле СН4четырехвалентный углерод связан с одновалентными атомами водорода. 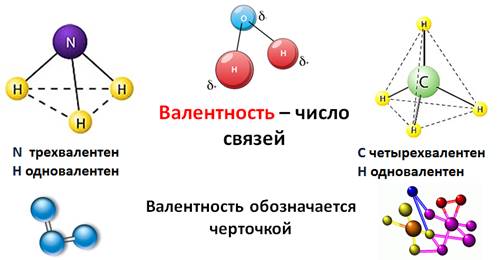 Следует различать элементы с постоянной и переменной валентностью. Элементами с постоянной валентность являются: · H, Cl, F – одновалентные, · О – двухвалентный, · B, Al – трехвалентные. Элементы с переменной валентностью: S, N, C, P и др. 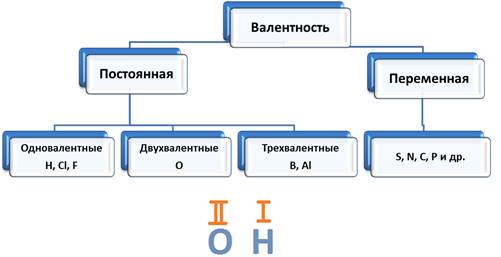 Для вывода формулы соединения азота с кислородом, где азот четырехвалентен, нужно сделать так: записываем знаки NO. Над знаками элементов ставим валентности римскими цифрами. У азота она дана по условию – четыре, у кислорода она постоянная и равна двум. Найдем наименьшее общее кратное между валентностями. Наименьшее общее кратное равно четырем. Разделим наименьшее общее кратное на валентности и получим индексы. Четыре делим на четыре будет единица, помните, индекс единица не ставится, затем четыре делим на два, будет два, следовательно, индекс у кислорода будет два. 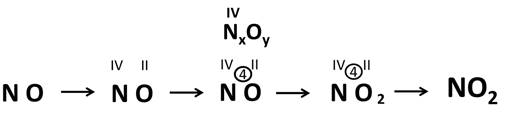 Аналогично поступают, когда по формуле, необходимо найти валентности элементов. Определим валентность фосфора в соединении Р2О3. У кислорода, как нам известно, валентность постоянная и равна двум. Определим число валентностей всех атомов кислорода, для этого 2 умножим на три, будет шесть. Разделим шесть на число атомов фосфора, т.е. на два, в результате будет три, значит, валентность фосфора в нашем случае равна трем. IV. Закрепление изученного материала. 1. Какие элементы проявляют большую ЭО: а) Mg, P, Cl б) O, S, Se. Ответ обоснуйте. 2. Почему ЭО кислорода больше чем у углерода? 3. В какой молекуле полярность связи больше: HF или OF2? Объясните почему. V. ПОДВЕДЕНИЕ ИТОГОВ: 1. Пополнилась ли сегодня ваша «копилка» знаний? 2. Если «да», то какие знания вы сегодня приобрели? VI. ДОМАШНЕЕ ЗАДАНИЕ: §…, упр.1, 2; учить определения. |
