химическая термодинамика-лекция. Элементы химической термодинамики и биоэнергетики. Термодинамика
 Скачать 117.5 Kb. Скачать 117.5 Kb.
|
|
Элементы химической термодинамики и биоэнергетики. Термодинамика – наука, которая изучает взаимные превращения различных видов энергии (механической, электрической, химической и т.д.). Химическая термодинамика изучает превращения различных видов энергии при химических и физико-химических процессах в макросистемах. Она является теоретической основой биоэнергетики. Биоэнергетика – наука, изучающая молекулярные механизмы преобразования энергии в организме. Основные понятия химической термодинамики. Термодинамическая система – тело или группа тел, которые находятся во взаимодействии и фактически или мысленно обособленны от окружающей среды (клетка живого организма, орган, совокупность макросистем, любые химические реакции). Классификация термодинамических систем: I. По количеству фаз (наличию поверхности раздела) Фаза – однородная часть системы с одинаковыми свойствами в любой точке и отделенная от других частей системы поверхностью раздела. Гомогенные (состоят из одной фазы и не имеют поверхности раздела: смесь газов, воздух, гомогенные химические реакции) Гетерогенные (состоят из двух или более фаз, имеющих поверхность раздела: вода-лед, вода-масло, гетерогенные реакции) II. По взаимодействию термодинамической системы с окружающей средой. 1. Открытые (происходит обмен веществом и энергией между системой и окружающей средой: любой организм, орган, клетка) 2. Закрытые (система обменивается с окружающей средой только энергией: нагревательный прибор) 3. Изолированные (отсутствует обмен с внешней средой: не существуют в природе, идеальная модель) 2. Термодинамические параметры – совокупность физических и химических величин, характеризующих состояние системы. I. а). Основные (независимые): количество вещества n, масса m, объем V, температура Т, давление Р, концентрация С. б). Термодинамические функции состояния системы (зависимые): внутренняя энергия (U), энтальпия (Н), энтропия (S) и энергия Гиббса (G). II. а) Экстенсивные – параметры, значения которых пропорциональны числу частиц в системе (n, m, v). б) Интенсивные – параметры, значения которых не зависят от числа частиц в системе (Т, Р, С). 3. Термодинамический процесс – переход системы из одного состояния в другое, которое сопровождается изменением одного или нескольких параметров. Изменение параметра обозначается - -разность между величиной параметра в конечном и начальном состоянии. (Т = Т2(кон) – Т1(нач)) а). Изотермический процесс (Т = 0). б). Изобарический (изобарный) процесс (Р = 0). в). Изохорический (изохорный) процесс (V = 0). г). Адиабатический процесс, протекающий без теплообмена с окружающей средой. д) Обратимый термодинамический процесс, который допускает возможность возвращения системы в первоначальное состояние без затраты энергии. Закономерности изменения параметров термодинамических систем в различных процессах сформулированы в основных законах термодинамики (их три). I закон термодинамики Закон определяет взаимосвязь внутренней энергии системы U, теплоты Q и работы А. Закон сохранения и превращения энергии. В любом процессе теплота, подведенная к системе или выделенная ею, расходуется на изменения внутренней энергии системы и совершение работы. Q = U + A, 1. Теплота (Q) – неупорядоченная форма передачи энергии. 2. Внутренняя энергия (U) –включает потенциальную энергию взаимодействия частиц системы и кинетическую энергию их движения (поступательное, колебательное, вращательное). 3 Работа (А) – упорядоченная форма перехода одного вида энергии в другой. В химической термодинамике работу самопроизвольно идущей реакции принято выражать как работу расширения сжатого газа: A = pV. Для изохорического процесса (V = cоnst): V = V2-V1 = 0 pV = 0 А = 0 QV = U. В изохорических процессах теплота, подведенная к системе или выделенная ею, расходуется на изменение внутренней энергии системы. В химических процессах определяется тепловым эффектом реакции. Для изобарического процесса (Р = cоnst): Qр = U + А = U + pV, где U+ рV обозначают Н и называют энтальпией. Отсюда Qр = Н2-Н1= Н. Qр = Н В изобарических процессах теплота, подведенная к системе или выделенная ею, расходуется на изменение энтальпии. Энтальпия – это термодинамическая функция состояния, которая характеризует общее энергосодержание системы с учетом работы. Энтальпия зависит от природы вещества, а также от основных параметров: количества вещества, температуры и давления. Измерить абсолютное значение энтальпии невозможно, поэтому определяют только изменение энтальпии Н (единицы измерения кДж). Для сравнения энергосодержания различных систем используют значение стандартной энтальпии. Стандартная энтальпия – это энтальпия, измеренная при стандартных условиях. Обозначается Н0 и измеряется в кДж/моль. Стандартные условия: количества вещества 1 моль; давление 101325 Па или 1 атм; температура 298К или 25С Изменение энтальпии – это тепловой эффект химической реакции. Тепловые эффекты химических реакций изучает раздел химической термодинамики, называемый термохимия. Химические уравнения, в которых указаны агрегатные состояния веществ и энтальпия реакции, называют термохимическими уравнениями. Пример. С6Н12О6(к) + 6 О2(г) = 6 СО2(г) + 6 Н2О(ж) Энтальпия реакции – это тепловой эффект реакции. Энтальпия образования – это тепловой эффект реакции образования 1 моль вещества из простых веществ. Стандартная энтальпия образования простых веществ равна 0. Энтальпия разложения – это тепловой эффект реакции разложения 1 моль вещества до простых веществ. Энтальпия сгорания – это тепловой эффект реакции горения 1 моль вещества с образованием высших оксидов. Стандартная энтальпия сгорании углекислого газа и воды равна 0. Энтальпия нейтрализации – это тепловой эффект реакции нейтрализации с образованием 1 моль воды. Энтальпия растворения – это тепловой эффект растворения 1 моль вещества. Она складывается из энтальпий разрушения кристаллической решетки вещества и энтальпии сольватации (гидратации) молекул или ионов. В экзотермических процессах, протекающих с выделением энергии, Н < 0. В эндотермических процессах, протекающих с поглощением энергии, Н > 0. Энтальпия и теплота имеют противоположные знаки. Закон Гесса и его следствия. Тепловой эффект химической реакции зависит только от начального и конечного состояния реагирующих веществ и не зависит от пути, по которому реакция протекает. Существует 5 следствий из закона Гесса. Наиболее часто в расчетах используют первое следствие: Тепловой эффект химической реакции равен сумме стандартных энтальпий образования продуктов реакции за вычетом суммы стандартных энтальпий образования исходных веществ с учетом стехиометрических коэффициентов. Н0r = [6·Н0f(CO2) + 6·Н0f(H2O)] – [1·Н0f(C6H12O6)] Закон Гесса является следствием I-го закона термодинамики. Его практическое значение состоит в том, что можно вычислять тепловые эффекты химических реакций, которые нельзя провести экспериментально, например, протекающие в живых организмах. Благодаря закону Гесса была определена энергетическая ценность или калорийность продуктов питания – это энергия, которая выделяется при полном окислении 1г или 100 г продукта. В медицине ее выражают в калориях: 1 ккал = 4,18 кДж. Энергетическая ценность различных классов «физиологического топлива»: углеводов – 16,8 кДж/г, жиров – 37,8 кДж/г, белков – 16,8 кДж/г. По закону Гесса рассчитан тепловой баланс организма при различных физических нагрузках. Энергозатраты в зависимости от рода деятельности: -в состоянии покоя – 6300-7560 кДж -легкая физическая нагрузка – 8400-10500 кДж -умеренная нагрузка (врачи, студенты) – 12500-15100 кДж -тяжелая физическая нагрузка – 16800-25200 кДж Суточная потребность взрослого человека составляет следующее соотношение белков, жиров и углеводов = 1 : 1 : 4 II закон термодинамики. Имеет 5 эквивалентных формулировок. К примеру две из них: Теплота не может самопроизвольно переходить от холодного тела к горячему. В изолированных системах энтропия для необратимых процессов увеличивается, а для обратимых процессов не изменяется. На основании II закон термодинамики можно определить принципиальную возможность самопроизвольного протекания химического процесса и предел его протекания. Установлено, что самопроизвольно (без затрат работы и энергии извне) протекают процессы, которые сопровождаются уменьшением энергии системы и увеличением в ней беспорядка. Для характеристики второго фактора используют функцию энтропия, S, Дж/К Энтропия – это термодинамическая функция состояния, которая является количественной мерой беспорядка в системе. Энтропия зависит от природы вещества и сложности системы, а также от основных параметров: количества вещества, температуры и давления. При увеличении количества частиц и температуры энтропия возрастает (S > 0), а при увеличении давления она уменьшается (S < 0). Стандартную энтропию S0 измеряют в Дж/мольК. Стандартные энтропии простых веществ не равны нулю. По закону Гесса изменение энтропии в каком-нибудь процессе зависит только от начального и конечного состояний и не зависит от пути перехода. S = Sкон – Sисх Изменение энтропии в химической реакции по 1-му следствию закона Гесса определяется разностью алгебраических сумм стандартных энтропий продуктов реакции и исходных веществ с учетом стехиометрических коэффициентов. S0r = [n·S0(прод)] – [n·S0(исх)] В открытых и закрытых системах самопроизвольно необратимо идут процессы с увеличением беспорядка в системе(S > 0). В изолированных системах для обратимого процесса энтропия не изменяется (S=0), а для необратимого – энтропия возрастает. Энергия Гиббса. Большинство химических процессов протекают с изменением и энтальпии и энтропии. Их разность называют изобарно-изотермическим потенциалом, изобарным потенциалом, свободной энергией Гиббса и обозначают G. Энергия Гиббса является обобщенной функцией состояния, учитывающей и энергетику и неупорядоченность частиц в системе при изобарно-изотермических условиях. Энергия Гиббса зависит от природы вещества, а так же от основных параметров: количества вещества, температуры и давления. Абсолютное значение энергии Гиббса измерить невозможно, поэтому определяют изменение энергии Гиббса. Изменение энергии Гиббса в результате химической реакции в стандартных условиях обозначается G0r и измеряется в кДж. Расчет: Изменение энергии Гиббса в стандартных условиях можно рассчитать по первому следствию закона Гесса. G0r = [n·G0f(прод)] – [n·G0f(исх)] Изменение энергии Гиббса для биохимических процессов (в условиях отличных от стандартных) можно рассчитать по уравнению Гиббса: G = H – TS, - где H – максимальная энергия, выделяемая или поглощаемая при химической реакции (энтальпийный фактор); - TS – связанная энергия, которая не может быть использована для совершения работы (энтропийный фактор); - G – свободная энергия, которая может быть использована для совершения работы. Критерии самопроизвольных процессов. Изменение энергии Гиббса (G) характеризует направление протекания химических превращений: Для открытых и закрытых термодинамических систем в изобарно-изотермических условиях самопроизвольно протекают только те процессы, в которых энергия Гиббса уменьшается G < 0. Процессы, для которых G > 0 в принципе невозможны без совершения работы или затрат энергии. Если в системе наступило термодинамическое равновесие, то дальнейшее изменение энергии Гиббса происходить не будет G = 0. Из уравнения Гиббса G = H – TS следует, что изменение свободной энергии зависит от H – энтальпийного фактора и TS – энтропийного фактора. Тогда для самопроизвольного процесса (Gr<0) в открытых и закрытых системах, энтальпия должна уменьшаться (Н<0), а энтропия возрастать (S>0). Направленность протекания реакций при разных знаках H и S
Для изолированных систем критерий самопроизвольного процесса – увеличение энтропии S > 0. Термодинамика и живые организмы. Биоэнергетика. Живые организмы подчиняются всем основным законам природы. К ним полностью применим закон сохранения и превращения энергии, а также II начало термодинамики. Как говорилось ранее, изучением трансформации энергии в организме занимается биоэнергетика. Живые организмы, являясь открытыми гетерогенными системами, обмениваются с внешней средой и массой и энергией. В процессе жизнедеятельности организм поглощает в виде пищи разнообразные вещества, ассимилирует и преобразует их в состав своего тела, а затем, в процессе диссимиляции разрушает и удаляет в виде отработанных продуктов во внешнюю среду. Такой путь называется метаболическим. Начальные продукты метаболизма – углеводы, конечные – СО2, Н2О, NH3, СО(NH2)2. Человеческий организм, как двигатель внутреннего сгорания, преобразует химическую энергию веществ пищи в движение и тепло. Сами питательные вещества не могут быть топливом клеточных процессов. Энергия освобождается в результате обмена веществ. Центральное место в нем принадлежит процессам: тканевому дыханию, брожению, гликолизу (распаду). Принцип энергетического сопряжения Биохимические реакции, сопровождающиеся уменьшением энергии Гиббса (Gr < 0), называют экзэргоническими; а сопровождающиеся увеличением энергии Гиббса (Gr > 0) – эндэргоническими. Последние невозможны без подвода энергии извне. В живых системах эндэргонические реакции могут протекать за счет энергетического сопряжения с экзэргоническими реакциями. Для этого необходимо, чтобы обе реакции имели какое-либо общее промежуточное соединение, и чтобы на всех стадиях сопряженных реакций суммарный процесс характеризовался отрицательным значением изменения энергии Гиббса. Особенности термодинамики биохимических процессов (МУ стр. 19-21) Большинство биохимических реакций, протекающих в организме, обратимы. Первая, главная особенность протекания обратимых биохимических реакций в организме – это стремление достичь динамического равновесия, при котором реакции протекают в двух противоположных направлениях с одинаковой скоростью. 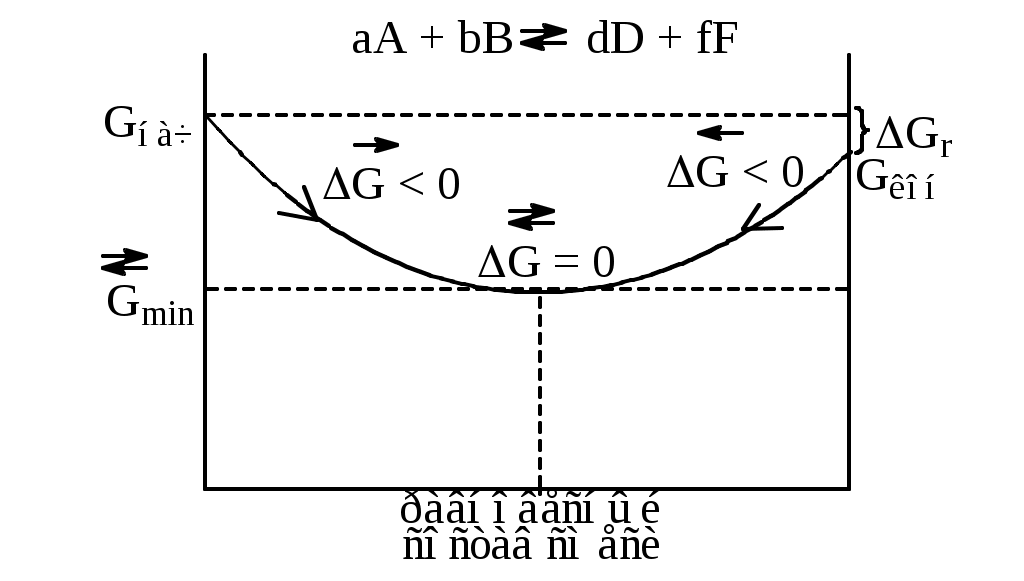 К равновесному состоянию G = min возможен подход и со стороны исходных веществ и со стороны продуктов реакции. Т.о. система самопроизвольно приходит к состоянию равновесия, из которого без внешнего воздействия выйти не может, т.к. это требует увеличения энергии Гиббса Р ⇄ авновесное состояние системы характеризуется: э ⇄ нергетической выгодностью (G = min) максимальным значением энтропии (S = max), т.к. равновероятно протекание одновременно прямой и обратной реакций о ⇄ ⇄ ⇄ ⇄ тсутствием изменений значений параметров и функций состояния системы: концентрации реагентов (сi = 0), энтальпии (H = 0), энтропии (S = 0) и энергии Гиббса (G = 0). Следовательно, в состоянии химического и биохимического равновесия система удовлетворяет обеим тенденциям развития, т.к. при этих условиях достигает min возможного значения энергии Гиббса и max возможного значения энтропии. Именно благодаря этой особенности обратимых процессов большинство биохимических реакций организма обратимы. Вторая особенность – многостадийность биохимических процессов, протекающих в организме. Вероятность обратимого протекание отдельной стадии выше, чем всего процесса в целом из-за небольшой разницы между величинами Gнач и Gкон для отдельной стадии. Обратимость отдельных стадий биохимических процессов позволяет живому организму легко регулировать синтез тех или иных соединений в зависимости от потребности и поддерживать стационарное состояние. Оно характеризуется для живого организма постоянством параметров (Т, р, с) внутренних сред организма и неизменностью во времени скоростей поступления и выделения веществ и энергии. Несмотря на постоянство термодинамических величин, они не имеют равновесных значений в этом состоянии. Биологическое развитие организма возможно только в системе, находящейся в стационарном состоянии. Стационарное состояние живого организма характеризуется постоянством термодинамических величин и неизменностью во времени скоростей поступления и удаления веществ и энергии. Термодинамическая особенность стационарного состояния открытых систем сформулирована И.Р. Пригожиным (1946г). Принцип Пригожина. В открытой системе в стационарном состоянии прирост энтропии в единицу времени S/ принимает минимальное положительное значение для данных условий, т.е. S/ min. Т.к. энтропия является мерой рассеяния энергии, принцип Пригожина приводит к важному заключению: при стационарном состоянии изменение энергии Гиббса в открытой системе минимально. Эти термодинамические особенности открытых систем объясняют устойчивость живого организма и его способность в течение срока жизни сохранять на определенном уровне энтропию, энергию Гиббса и относительное постоянство своей внутренней среды, называемое в биологии гомеостазом. Гомеостаз – относительное динамическое постоянство состава и свойств внутренней среды организма, обуславливающих устойчивость физиологических функций. Основные положения, вытекающие из законов термодинамики, применимые к живым системам: 1 развитие системы происходит под влиянием двух тенденций – стремлением системы к минимуму энергии и максимуму энтропии. 2 экзэргонические реакции в организме протекают самопроизвольно, так как G<0. 3 эндэргонические – требуют затраты энергии, так как G>0. 4 состояние равновесия в обратимых процессах характеризуется G = 0 и является энергетически самым выгодным, так как G = min, а S = max 5 открытые системы в стационарном состоянии характеризуются минимальным приростом энтропии в единицу времени S/ min. Итак, пища – источник энергии. Как же это «топливо» сгорает и как, содержащаяся в нем энергия используется? Позавтракав, мы ввели в организм порцию углеводов. Уже во рту пища начинает перерабатываться. На крахмал, клетчатку, сахар действуют различные биокатализаторы – ферменты. Они расщепляют сложные сахариды на глюкозные звенья. Расщепление завершается в желудке. Через стенки кишок глюкоза всасывается в кровь и разносится по всему организму. Молекула глюкозы проникла в клетку. Затем начинаются сложные, многостадийные ее превращения. В них участвуют специальные ферменты и аккумулятор энергии аденозинтрифосфат, 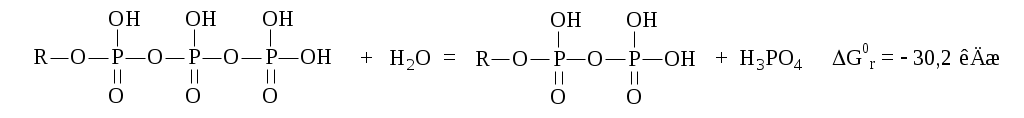 Реакция протекает при рН=7 и tС=37 в присутствии Mg2+. При этом и выделяется энергия, необходимая клетке. Отметим, что это высокая энергия, если сравнить с тем, что при гидролизе обычных химических связей выделяется 13 кДж/моль. На первой стадии молекула глюкозы реагирует с ферментом глюкокиназой и молекулой АТФ. АТФ при этом отдает свою энергию и превращается в АДФ. Дальше начинается целая цепь превращений, в которых молекула глюкозы дробится на мелкие фрагменты. В результате освобождается энергия, которая частично трансформируется в энергию АТФ. За одну «сгоревшую» молекулу глюкозы клетка получает 38 молекул АТФ. Полученная энергия идет на поддержание нужной температуры тела и совершение работы внутри организма (дыхание, кровообращение, перемещение метаболитов) и внешней работы, связанной со всеми перемещениями человека и трудовой деятельностью. Т.о. – основной поставщик энергии для организма – гликолиз органических веществ (распад углеводов). Гликолиз может протекать при достаточном количестве кислорода (аэробном) и тогда образуются СО2 и Н2О (С6Н12О6 + 6О2 = 6СО2 + 6Н2О) и выделяется 2801,69 кДж/моль тепла; а в отсутствие кислорода (анаэробном) образуется молочная кислота (С6Н12О6 (глюкоза) = 2С3Н6О3 (молочная кислота)) и выделяется 210 кДж/моль тепла; 126 кДж рассеивается в виде тепловой энергии в окружающую среду, 84 кДж накапливается в АТФ в организме. Одним основных термодинамических условий существования живой клетки является сохранение ряда постоянных параметров (Т, р, с) внутренних сред организма, которое достигается благодаря обмену массой и энергией между клеткой и окружающей средой. Так, изменение концентрации веществ во внутренних средах организма может быть причиной его заболевания или гибели. Например, снижение содержания глюкозы в крови до 5 г/л или, наоборот, ее повышении до 30 г/л может привести к смерти. Живые организмы – высокоорганизованные сложные системы с высокой степенью упорядоченности и обладают малой энтропией по сравнению с окружающей средой. По второму закону термодинамики они неустойчивы и должны разрушаться. Но этого не происходит. С повышением энтропии организм борется двумя путями: – Усваивает ВМС (белки, липиды, углеводы), имеющие малую энтропию по сравнению НМС. – Выделяют в окружающую среду конечные продукты метаболизма НМС (СО2, Н2О, NH3, СО(NH2)2), обладающие повышенной энтропией по сравнению с ВМС. Следовательно, живые организмы в течение срока жизни сохраняют высокую организованность системы. | |||||||||||||||||||||||
