физика. физика 2. Любое макроскопическое тело или группа макроскопических тел называется
 Скачать 24.27 Kb. Скачать 24.27 Kb.
|
|
9. Любое макроскопическое тело или группа макроскопических тел называется термодинамической системой. Тепловое или термодинамическое равновесие - такое состояние термодинамической системы, при котором все ее макроскопические параметры остаются неизменными: не меняются объем, давление, не происходит теплообмен, отсутствуют переходы из одного агрегатного состояния в другое и т.д. При неизменных внешних условиях любая термодинамическая система самопроизвольно переходит в состояние теплового равновесия. Температура - физическая величина, характеризующая состояние теплового равновесия системы тел: все тела системы, находящиеся друг с другом в тепловом равновесии, имеют одну и ту же температуру. Абсолютный нуль температуры - предельная температура, при которой давление идеального газа при постоянном объеме должно быть равно нулю или должен быть равен нулю объем идеального газа при постоянном давлении. Термометр - прибор для измерения температуры. Обычно термометры градуируют по шкале Цельсия: температуре кристаллизации воды (таяния льда) соответствует 0°С, температуре ее кипения - 100°С. Кельвин ввел абсолютную шкалу температур, согласно которой нулевая температура соответствует абсолютному нулю, единица измерения температуры по шкале Кельвина равна градусу Цельсия: [Т] = 1 К (Кельвин). Связь температуры в энергетических единицах и температуры в градусах Кельвина: где k = 1,38*10 -23 Дж/К - постоянная Больцмана. Связь абсолютной шкалы и шкалы Цельсия: T = t + 273 где t - температура в градусах Цельсия. Средняя кинетическая энергия хаотического движения молекул газа пропорциональна абсолютной температуре: 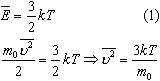 Средняя квадратичная скорость молекул Учитывая равенство (1), основное уравнение молекулярно-кинетической теории можно записать так: p=nkT УРАВНЕНИЕ СОСТОЯНИЯ ИДЕАЛЬНОГО ГАЗА Пусть газ массой m занимает объем V при температуре Т и давлении р, а М- молярная масса газа. По определению, концентрация молекул газа: n = N/V, где N-число молекул. Подставим это выражение в основное уравнение молекулярно-кинетической теории: 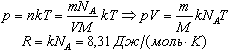 Величину R называют универсальной газовой постоянной, а уравнение, записанное в виде |
