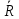ЛР131. Лабораторная работа 131 Определение универсальной газовой постоянной методом откачки
 Скачать 101.06 Kb. Скачать 101.06 Kb.
|
|
Лабораторная работа №131 Определение универсальной газовой постоянной методом откачки Цель работы: экспериментальное определение универсальной газовой постоянной R. Краткая теория Термодинамической системой называется совокупность тел (газы, жидкости и т.д.), способных обмениваться с внешней средой энергией и веществом. Состояние термодинамической системы характеризуют физическими величинами, называемыми термодинамическими параметрами. К ним относятся давление, температура, объём, плотность и т.д. Давлением называется среднее значение силы, действующей по нормали на единицу площади поверхности со стороны молекул газа или жидкости: 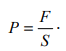 Размерность давления в Международной системе единиц измерения физических величин СИ: В рамках молекулярно-кинетической теории температура характеризует интенсивность теплового движения молекул вещества. Средняя кинетическая энергия поступательного движения молекулы газа пропорциональна температуре: 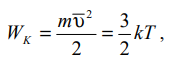 где k = 1,38 10-23 Дж/К – постоянная Больцмана. Определенная таким образом температура Т называется абсолютной и измеряется по шкале Кельвина. Размерность: Т К (градус Кельвина). Между абсолютной и температурой по шкале Цельсия существует линейная связь: Плотностью вещества называется физическая величина, равная массе вещества, содержащегося в единице объёма: 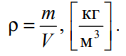 Плотность вещества обратно пропорциональна удельному объёму: 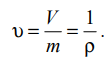 Параметры состояния – величины, зависимые друг от друга. Уравнение вида: связывающее функциональной зависимостью параметры состояния, называется термическим уравнением состояния системы. Теоретически уравнение состояния определяется только для идеального газа. Газ называется идеальным, если выполнены три условия: 1) молекулы имеют пренебрежительно малые размеры; 2) молекулы не взаимодействуют друг с другом; 3) соударения молекул абсолютно упругие. Состояние идеального газа определяется уравнением Менделеева-Клапейрона: 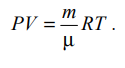 Здесь m – масса газа, µ – молярная масса, 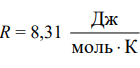 – универсальная газовая постоянная. – универсальная газовая постоянная.Величина: 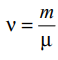 называется количеством вещества и измеряется в моль. 1 моль – такое количество вещества, в котором содержится столько молекул, сколько имеется атомов в 12 г изотопа углерода С12. Число молекул в 1 моле вещества называется числом Авогадро: NA = 6,02 1023 моль-1. Описание методики измерения Универсальную газовую постоянную можно определить из уравнения Менделеева-Клапейрона. Все величины, входящие в это уравнение, можно определить непосредственно, за исключением массы газа, т.к. её можно измерить только вместе с массой сосуда m0. Массу сосуда можно исключить, используя уравнение Менделеева-Клапейрона для двух разных давлений P1 и P2 при неизменных объёме и температуре:  Решив эти уравнения относительно R, находим: 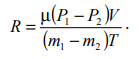 Описание установки Приборы и принадлежности: стеклянная колба, насос Комовского, манометр, весы с разновесами. Общий вид установки представлен на рисунке 17. 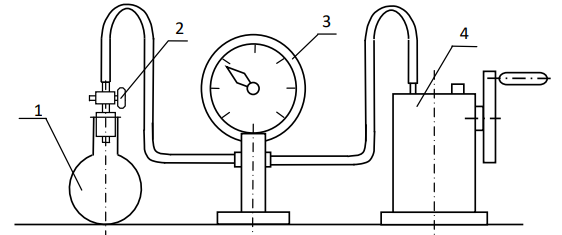 Рис.17. Лабораторная установка на основе наноса Комовского Установка состоит из стеклянной колбы 1 с краном 2, ручного насоса 4. Давление газа после откачки измеряется манометром 3. Манометр измеряет избыточное давление Pu = P2 – P1. Поэтому расчётная формула имеет вид: 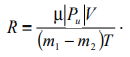 (109) (109)Измерения и обработка результатов измерений 1. Снять резиновую трубку с колбы, открыть кран и определить суммарную массу колбы и содержащегося в ней воздуха (m0 + m1). 2. Колбу соединить с насосом и откачать воздух примерно до значения Рu = -0,8 кГс/см2. Измерить Рu и закрыть кран. 3. Определить массу колбы с оставшимся воздухом (m0 + m2). Трубку предварительно отсоединить. 4. Определить массу откаченного воздуха как разность 5. Измерить температуру Т воздуха в лаборатории. 6. По формуле (109) вычислить значение универсальной газовой постоянной R. Значение молярной массы можно взять для азота. 7. Измерения выполнить три раза. Результаты измерений занести в таблицу 13. Таблица 13
V=2 л = 2·10-3 м3; t = 26°С = 26 + 273 = 299 К; μ = 0,028 кг/моль; коэффициент Стьюдента принять 1,9. 8. Вычислить доверительный интервал 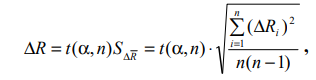 гдеt (, n) – коэффициент Стьюдента, n – количество независимых опытов. 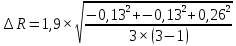 = 0,25 = 0,25R = 7,48±0,25 (Дж/моль·К) 9. Среднее значение R, вычисленное по результатам опытов, сравнить с теоретическим значением. Определить основные источники погрешностей. Rтеор = 8,31 Дж/моль·К Rвыч = 7,48 Дж/моль·К Контрольные вопросы 1. Какие величины называются параметрами состояния? Дайте их определение. Параметры состояния – величины, зависимые друг от друга. Уравнение вида: связывающее функциональной зависимостью параметры состояния, называется термическим уравнением состояния системы. Теоретически уравнение состояния определяется только для идеального газа. 2. Какой газ называется идеальным? Газ называется идеальным, если выполнены три условия: 1) молекулы имеют пренебрежительно малые размеры; 2) молекулы не взаимодействуют друг с другом; 3) соударения молекул абсолютно упругие. 3. Как записывается уравнение состояния идеального газа? Состояние идеального газа определяется уравнением Менделеева-Клапейрона: 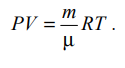 4. Что называется одним молем вещества? 1 моль – такое количество вещества, в котором содержится столько молекул, сколько имеется атомов в 12 г изотопа углерода С12. 5. Какие факторы влияют на точность измерений параметров состояния газа? На точность полученных результатов влияли следующие факторы: класс измерительного прибора, точность отсчета при измерении. |